Enlace glucosídico
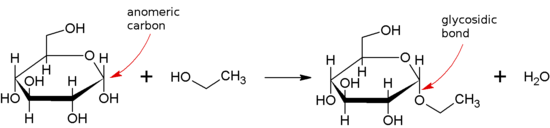
Un enlace glucosídico o enlace glucosídico es un tipo de enlace covalente que une una molécula de carbohidrato (azúcar) a otro grupo, que puede ser o no otro carbohidrato.
Se forma un enlace glucosídico entre el grupo hemiacetal o hemicetal de un sacárido (o una molécula derivada de un sacárido) y el grupo hidroxilo de algún compuesto como un alcohol. Una sustancia que contiene un enlace glucosídico es un glucósido.
El término 'glucósido' ahora se amplía para cubrir también compuestos con enlaces formados entre grupos de azúcares hemiacetal (o hemicetal) y varios grupos químicos distintos de los hidroxilos, como -SR (tioglucósidos), -SeR (selenoglucósidos), -NR1R2 (N-glucósidos), o incluso -CR1R2R3 (C-glucósidos).
En particular, en los glucósidos naturales, el compuesto ROH del que se ha eliminado el residuo de carbohidrato a menudo se denomina aglicona, y el residuo de carbohidrato en sí mismo a veces se denomina 'glicona'.
Enlaces S-, N-, C- y O-glucosídicos
Los enlaces glucosídicos de la forma discutida anteriormente se conocen como enlaces O-glucosídicos, en referencia al oxígeno glucosídico que une el glucósido con la aglicona o azúcar del extremo reductor. En analogía, también se consideran los enlaces S-glucosídicos (que forman tioglucósidos), en los que el oxígeno del enlace glucosídico se reemplaza por un átomo de azufre. De la misma manera, los enlaces N-glucosídicos, tienen el oxígeno del enlace glucosídico reemplazado por nitrógeno. Las sustancias que contienen enlaces N-glucosídicos también se conocen como glicosilaminas. Los enlaces C-glicosilo tienen el oxígeno glucosídico reemplazado por un carbono; el término "C-glucósido" se considera un nombre inapropiado por la IUPAC y se desaconseja. Todos estos enlaces glucosídicos modificados tienen diferente susceptibilidad a la hidrólisis y, en el caso de las estructuras de C-glicosilo, suelen ser más resistentes a la hidrólisis.
Numeración y distinción α/β de enlaces glucosídicos
Cuando un centro anomérico está involucrado en un enlace glucosídico (como es común en la naturaleza), entonces uno puede distinguir entre enlaces α- y β-glucosídicos por la estereoquímica relativa de la posición anomérica y el estereocentro más alejado de C1 en el sacárido.
Los farmacólogos suelen unir sustancias al ácido glucurónico a través de enlaces glucosídicos para aumentar su solubilidad en agua; esto se conoce como glucuronidación. Muchos otros glucósidos tienen importantes funciones fisiológicas.
Enfoques químicos
Nüchter et al. (2001) han mostrado un nuevo enfoque para la glucosidación de Fischer. Empleando un horno de microondas equipado con un aparato de reflujo en un reactor de rotor con bombas de presión, Nüchter et al. (2001) pudieron lograr un rendimiento del 100 % de α- y β-D-glucósidos. Este método se puede realizar en una escala de varios kilogramos.
- Método de Vishal Y Joshi
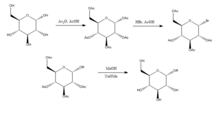
Joshi et al. (2006) proponen el método de Koenigs-Knorr en la síntesis estereoselectiva de alquil D-glucopiranósidos vía glicosilación, con la excepción de utilizar carbonato de litio que es menos costoso y tóxico que el método convencional de utilizando sales de plata o mercurio. La D-glucosa se protege primero formando el peracetato mediante la adición de anhídrido acético en ácido acético y luego la adición de bromuro de hidrógeno que se broma en la posición 5. Al agregar el alcohol ROH y el carbonato de litio, el OR reemplaza al bromo y al desproteger los hidroxilos acetilados, el producto se sintetiza con una pureza relativamente alta. Joshi et al. (2001) sugirió que el litio actúa como el nucleófilo que ataca al carbono en la posición 5 y, a través de un estado de transición, el alcohol sustituye al grupo bromo. Las ventajas de este método, así como su estereoselectividad y el bajo costo de la sal de litio incluyen que se puede realizar a temperatura ambiente y su rendimiento se compara relativamente bien con el método convencional de Koenigs-Knorr.
Glucósido hidrolasas
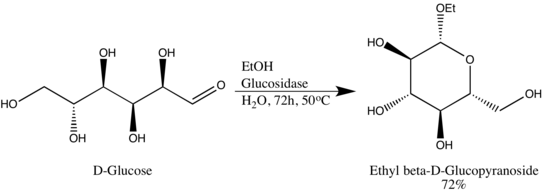
Las glucósido hidrolasas (o glucosidasas) son enzimas que rompen los enlaces glucosídicos. Las hidrolasas de glucósido normalmente pueden actuar sobre enlaces glucosídicos α o β, pero no sobre ambos. Esta especificidad permite a los investigadores obtener glucósidos en un alto exceso epimérico, un ejemplo es la conversión de Wen-Ya Lu de D-glucosa en etil β-D-glucopiranósido utilizando glucosidasa de origen natural. Vale la pena señalar que Wen-Ya Lu utilizó la glucosidasa de manera opuesta a la funcionalidad biológica de la enzima:
Glicosiltransferasas
Antes de que las unidades de monosacáridos se incorporen a las glicoproteínas, los polisacáridos o los lípidos en los organismos vivos, por lo general, primero se "activan" uniéndose mediante un enlace glucosídico al grupo fosfato de un nucleótido como el difosfato de uridina (UDP), el difosfato de guanosina (GDP), el difosfato de timidina (TDP) o el monofosfato de citidina (CMP). Estos intermedios bioquímicos activados se conocen como nucleótidos de azúcar o donantes de azúcar. Muchas vías biosintéticas utilizan monosacáridos u oligosacáridos activados por un enlace difosfato a lípidos, como el dolicol. Estos donantes activados son luego sustratos para enzimas conocidas como glicosiltransferasas, que transfieren la unidad de azúcar del donante activado a un nucleófilo aceptor (el sustrato aceptor).
Disacárido fosforilasas
En las últimas décadas se han desarrollado diferentes enfoques biocatalíticos para la síntesis de glucósidos, que utilizan "glucosiltransferasas" y "glucósido hidrolasas" entre las catálisis más comunes. El primero a menudo necesita materiales costosos y el segundo a menudo muestra bajos rendimientos, De Winter et al. investigó el uso de celobiosa fosforilasa (CP) para la síntesis de alfa-glucósidos en líquidos iónicos. Se encontró que la mejor condición para el uso de CP estaba en presencia de IL AMMOENG 101 y acetato de etilo.
Glicosilaciones dirigidas
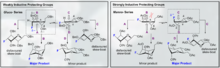
Existen múltiples enfoques químicos para fomentar la selectividad de los enlaces α- y β-glucosídicos. La naturaleza altamente específica del sustrato de la selectividad y la actividad general del piranósido pueden proporcionar grandes dificultades sintéticas. La especificidad global de la glicosilación se puede mejorar utilizando enfoques que tengan en cuenta los estados de transición relativos que puede experimentar el carbono anomérico durante una glicosilación típica. En particular, el reconocimiento y la incorporación de los modelos de Felkin-Ahn-Eisenstein en el diseño químico racional generalmente pueden proporcionar resultados confiables siempre que la transformación pueda sufrir este tipo de control conformacional en el estado de transición.
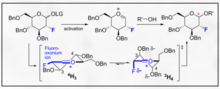
Las glicosilaciones dirigidas por flúor representan un manejo alentador tanto para la selectividad B como para la introducción de una funcionalidad C2 biomimética no natural en el carbohidrato. Un ejemplo innovador proporcionado por Bucher et al. proporciona una forma de utilizar un ion de fluorooxonio y el tricloroacetimidato para fomentar la estereoselectividad B a través del efecto gauche. Esta estereoselectividad razonable es clara a través de la visualización de los modelos Felkin-Ahn de las posibles formas de sillas.
Este método representa una forma alentadora de incorporar selectivamente B-etilo, isopropilo y otros glucósidos con la química típica del tricloroacetimidato.
Glucopéptidos unidos a O; Usos farmacéuticos de los péptidos O-glicosilados
Recientemente, se ha demostrado que los glicopéptidos ligados a O exhiben una excelente permeabilidad y eficacia del SNC en múltiples modelos animales con estados patológicos. Además, uno de los aspectos más intrigantes del mismo es la capacidad de la O-glicosilación para extender la vida media, disminuir el aclaramiento y mejorar la PK/PD del péptido activo más allá de aumentar la penetración en el SNC. La utilización innata de azúcares como fracciones solubilizantes en el metabolismo de Fase II y III (ácidos glucurónicos) ha permitido notablemente una ventaja evolutiva en la que las enzimas de los mamíferos no evolucionan directamente para degradar productos glicosilados con O en fracciones más grandes.
La naturaleza peculiar de los glucopéptidos ligados a O es que existen numerosos ejemplos que penetran en el SNC. Se cree que la base fundamental de este efecto implica el "salto de membrana" o "difusión de lúpulo". La "difusión de lúpulo" impulsada por el movimiento no browniano Se cree que el proceso ocurre debido a la discontinuidad de la membrana plasmática. "Difusión de lúpulo" combina notablemente la difusión libre y las transiciones intercomparamentales. Los ejemplos recientes incluyen notablemente la alta permeabilidad de los análogos de met-encefalina entre otros péptidos. El pentapéptido agonista de mOR completo DAMGO también penetra en el SNC tras la introducción de la glicosilación.
Enlaces N-glucosídicos en el ADN
Las moléculas de ADN contienen anillos de carbono de 5 miembros llamados ribosas que están unidos directamente a dos grupos fosfato y una nucleobase que contiene grupos amino. Los átomos de nitrógeno del grupo amino en los nucleótidos están unidos covalentemente al carbono anomérico de la estructura del azúcar ribosa a través de un enlace N-glucosídico. Ocasionalmente, las nucleobases unidas a la ribosa sufren desaminación, alquilación u oxidación, lo que da como resultado lesiones citotóxicas a lo largo del esqueleto del ADN. Estas modificaciones amenazan gravemente la cohesión de la molécula de ADN, lo que lleva al desarrollo de enfermedades como el cáncer. Las ADN glucosilasas son enzimas que catalizan la hidrólisis del enlace N-glicosídico para liberar la nucleobase dañada o modificada del ADN, al escindir el enlace glucosídico carbono-nitrógeno en el extremo 2' carbono, iniciando posteriormente la vía de reparación por escisión de base (BER).
Las glucosilasas monofuncionales catalizan la hidrólisis del enlace N-glucosídico mediante un mecanismo escalonado similar a SN1 o un mecanismo similar a SN2 concertado. La función paso a paso, la nucleobase actúa como un grupo saliente antes de que el carbono anomérico sea atacado por la molécula de agua, produciendo un ion intermedio inestable de oxacarbenio de corta duración. Este intermedio reacciona rápidamente con la molécula de agua cercana para sustituir el enlace N-glucosídico de la ribosa y la base nitrogenada por un enlace O-glucosídico con un grupo hidroxi. El mecanismo concertado, el agua actúa como un nucleófilo y ataca al carbono anomérico antes de que la nucelobase actúe como un grupo saliente. El intermedio producido es un ion oxacarbenio similar en el que tanto los grupos hidroxi como la nucleobase todavía están unidos al carbono anomérico. Ambos mecanismos dan teóricamente el mismo producto. La mayoría de los ribonucleótidos se hidrolizan a través del mecanismo concertado similar a SN2, mientras que la mayoría de los desoxirribonucleótidos proceden a través del mecanismo similar a pasos.
Estas reacciones son prácticamente irreversibles. Debido al hecho de que la escisión del enlace N-glucosídico del esqueleto del ADN puede dar lugar a respuestas mutagénicas y citotóxicas perjudiciales en un organismo, tienen la capacidad de catalizar también la síntesis de enlaces N-glucosídicos a través de un sitio de ADN abásico y una nucleobase específica.
Contenido relacionado
Treonina
Cromatografía de exclusión por tamaño
Célula electroquímica