Nobelio
El nobelio es un elemento químico sintético con el símbolo No y el número atómico 102. Recibe su nombre en honor a Alfred Nobel, el inventor de la... (leer más)
Un enlace covalente es un enlace químico que implica el intercambio de pares de electrones entre átomos. Estos pares de electrones se conocen como pares compartidos o pares enlazantes, y el equilibrio estable de fuerzas de atracción y repulsión entre átomos, cuando comparten electrones, se conoce como enlace covalente. Para muchas moléculas, compartir electrones permite que cada átomo alcance el equivalente de una capa de valencia completa, lo que corresponde a una configuración electrónica estable. En química orgánica, los enlaces covalentes son mucho más comunes que los enlaces iónicos.
El enlace covalente también incluye muchos tipos de interacciones, incluidos enlaces σ, enlaces π, enlaces de metal a metal, interacciones agósticas, enlaces doblados, enlaces de dos electrones de tres centros y enlaces de cuatro electrones de tres centros. El término enlace covalente data de 1939. El prefijo co- significa conjuntamente, asociado en acción, asociado en menor grado, etc.; por lo tanto, un "enlace covalente", en esencia, significa que los átomos comparten "valencia", como se analiza en la teoría del enlace de valencia.
En la molécula H
2, los átomos de hidrógeno comparten los dos electrones a través de un enlace covalente. La covalencia es mayor entre átomos de electronegatividades similares. Por lo tanto, el enlace covalente no requiere necesariamente que los dos átomos sean del mismo elemento, solo que tengan una electronegatividad comparable. Se dice que el enlace covalente que implica compartir electrones entre más de dos átomos está deslocalizado.
El término covalencia con respecto a la unión fue utilizado por primera vez en 1919 por Irving Langmuir en un artículo de Journal of the American Chemical Society titulado "La disposición de electrones en átomos y moléculas". Langmuir escribió que "denotaremos con el término covalencia el número de pares de electrones que un átomo dado comparte con sus vecinos".
La idea del enlace covalente se remonta varios años antes de 1919 a Gilbert N. Lewis, quien en 1916 describió el intercambio de pares de electrones entre átomos. Introdujo la notación de Lewis o la notación de puntos de electrones o la estructura de puntos de Lewis, en la que los electrones de valencia (aquellos en la capa exterior) se representan como puntos alrededor de los símbolos atómicos. Los pares de electrones ubicados entre los átomos representan enlaces covalentes. Los pares múltiples representan enlaces múltiples, como enlaces dobles y enlaces triples. Una forma alternativa de representación, que no se muestra aquí, tiene pares de electrones formadores de enlaces representados como líneas continuas.
Lewis propuso que un átomo forma suficientes enlaces covalentes para formar una capa externa de electrones completa (o cerrada). En el diagrama del metano que se muestra aquí, el átomo de carbono tiene una valencia de cuatro y, por lo tanto, está rodeado por ocho electrones (la regla del octeto), cuatro del propio carbono y cuatro de los hidrógenos unidos a él. Cada hidrógeno tiene una valencia de uno y está rodeado por dos electrones (una regla de dúo): su propio electrón más uno del carbono. El número de electrones corresponde a capas completas en la teoría cuántica del átomo; la capa externa de un átomo de carbono es la capa n = 2, que puede contener ocho electrones, mientras que la capa externa (y única) de un átomo de hidrógeno es la capa n = 1, que puede contener solo dos.
Si bien la idea de los pares de electrones compartidos brinda una imagen cualitativa efectiva de los enlaces covalentes, se necesita la mecánica cuántica para comprender la naturaleza de estos enlaces y predecir las estructuras y propiedades de las moléculas simples. A Walter Heitler y Fritz London se les atribuye la primera explicación exitosa de la mecánica cuántica de un enlace químico (hidrógeno molecular) en 1927. Su trabajo se basó en el modelo de enlace de valencia, que asume que un enlace químico se forma cuando hay una buena superposición entre los orbitales atómicos de los átomos participantes.
Los orbitales atómicos (excepto los orbitales s) tienen propiedades direccionales específicas que conducen a diferentes tipos de enlaces covalentes. Los enlaces Sigma (σ) son los enlaces covalentes más fuertes y se deben a la superposición frontal de orbitales en dos átomos diferentes. Un enlace sencillo suele ser un enlace σ. Los enlaces pi (π) son más débiles y se deben a la superposición lateral entre los orbitales p (o d). Un enlace doble entre dos átomos dados consiste en un enlace σ y uno π, y un enlace triple es un enlace σ y dos enlaces π.
Los enlaces covalentes también se ven afectados por la electronegatividad de los átomos conectados, lo que determina la polaridad química del enlace. Dos átomos con igual electronegatividad formarán enlaces covalentes no polares como H–H. Una relación desigual crea un enlace covalente polar como con H−Cl. Sin embargo, la polaridad también requiere asimetría geométrica, o de lo contrario los dipolos pueden cancelarse, dando como resultado una molécula no polar.
Existen varios tipos de estructuras para sustancias covalentes, incluidas moléculas individuales, estructuras moleculares, estructuras macromoleculares y estructuras covalentes gigantes. Las moléculas individuales tienen enlaces fuertes que mantienen unidos a los átomos, pero en general, hay fuerzas de atracción insignificantes entre las moléculas. Estas sustancias covalentes suelen ser gases, por ejemplo, HCl, SO 2, CO 2 y CH 4. En las estructuras moleculares, existen fuerzas de atracción débiles. Estas sustancias covalentes son líquidos de baja temperatura de ebullición (como el etanol) y sólidos de baja temperatura de fusión (como el yodo y el CO2 sólido) .). Las estructuras macromoleculares tienen un gran número de átomos unidos por enlaces covalentes en cadenas, incluidos polímeros sintéticos como el polietileno y el nailon, y biopolímeros como las proteínas y el almidón. Las estructuras covalentes en red (o estructuras covalentes gigantes) contienen una gran cantidad de átomos unidos en láminas (como el grafito) o estructuras tridimensionales (como el diamante y el cuarzo). Estas sustancias tienen puntos de fusión y ebullición elevados, suelen ser quebradizas y tienden a tener una resistividad eléctrica elevada. Los elementos que tienen alta electronegatividad y la capacidad de formar enlaces de tres o cuatro pares de electrones, a menudo forman estructuras macromoleculares tan grandes.
Los enlaces con uno o tres electrones se pueden encontrar en especies radicales, que tienen un número impar de electrones. El ejemplo más simple de un enlace de 1 electrón se encuentra en el catión dihidrógeno, H
2. Los enlaces de un electrón a menudo tienen aproximadamente la mitad de la energía de enlace de un enlace de 2 electrones y, por lo tanto, se denominan "medios enlaces". Sin embargo, hay excepciones: en el caso del dilitio, el enlace es en realidad más fuerte para el Li de 1 electrón.
2que para el Li 2 de 2 electrones. Esta excepción se puede explicar en términos de hibridación y efectos de capa interna.
El ejemplo más simple de enlace de tres electrones se puede encontrar en el catión dímero de helio, He
2. Se considera un "medio enlace" porque consta de un solo electrón compartido (en lugar de dos); en términos de orbitales moleculares, el tercer electrón está en un orbital de antienlace que anula la mitad del enlace formado por los otros dos electrones. Otro ejemplo de una molécula que contiene un enlace de 3 electrones, además de dos enlaces de 2 electrones, es el óxido nítrico, NO. También se puede considerar que la molécula de oxígeno, O 2, tiene dos enlaces de 3 electrones y un enlace de 2 electrones, lo que explica su paramagnetismo y su orden de enlace formal de 2. El dióxido de cloro y sus análogos más pesados, el dióxido de bromo y el dióxido de yodo, también contienen enlaces de tres electrones.
Las moléculas con enlaces de electrones impares suelen ser muy reactivas. Estos tipos de enlaces solo son estables entre átomos con electronegatividades similares.Estructuras de Lewis modificadas con enlaces 3e

Óxido nítrico
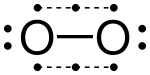
dioxígeno
Hay situaciones en las que una sola estructura de Lewis es insuficiente para explicar la configuración electrónica en una molécula y sus propiedades determinadas experimentalmente, por lo que se necesita una superposición de estructuras. Los mismos dos átomos en tales moléculas se pueden unir de manera diferente en diferentes estructuras de Lewis (un enlace simple en una, un enlace doble en otra, o incluso ninguno), lo que da como resultado un orden de enlace no entero. El ion nitrato es uno de esos ejemplos con tres estructuras equivalentes. El enlace entre el nitrógeno y cada oxígeno es un enlace doble en una estructura y un enlace simple en las otras dos, de modo que el orden de enlace promedio para cada interacción N-O es2 + 1 + 1/3=4/3.

En química orgánica, cuando una molécula con un anillo plano obedece la regla de Hückel, donde el número de electrones π se ajusta a la fórmula 4 n + 2 (donde n es un número entero), obtiene estabilidad y simetría adicionales. En el benceno, el compuesto aromático prototípico, hay 6 electrones de enlace π (n = 1, 4 n + 2 = 6). Estos ocupan tres orbitales moleculares π deslocalizados (teoría de orbitales moleculares) o forman enlaces π conjugados en dos estructuras de resonancia que se combinan linealmente (teoría del enlace de valencia), creando un hexágono regular que exhibe una mayor estabilización que el hipotético 1,3,5-ciclohexatrieno.
En el caso de los aromáticos heterocíclicos y los bencenos sustituidos, las diferencias de electronegatividad entre las diferentes partes del anillo pueden dominar el comportamiento químico de los enlaces aromáticos del anillo, que por lo demás son equivalentes.
Ciertas moléculas, como el difluoruro de xenón y el hexafluoruro de azufre, tienen números de coordinación más altos de lo que sería posible debido a un enlace estrictamente covalente de acuerdo con la regla del octeto. Esto se explica por el modelo de enlace de cuatro electrones de tres centros ("3c-4e") que interpreta la función de onda molecular en términos de orbitales moleculares ocupados más altos que no se unen en la teoría de orbitales moleculares y la resonancia de los enlaces sigma en la teoría del enlace de valencia.
En los enlaces de dos electrones de tres centros ("3c-2e"), tres átomos comparten dos electrones en el enlace. Este tipo de enlace ocurre en los hidruros de boro como el diborano (B 2 H 6), que a menudo se describen como deficientes en electrones porque no hay suficientes electrones de valencia para formar enlaces localizados (2 centros, 2 electrones) que unen todos los átomos. Sin embargo, la descripción más moderna que usa enlaces 3c–2e proporciona suficientes orbitales de enlace para conectar todos los átomos, de modo que las moléculas pueden clasificarse como electrones precisas.
Cada enlace (2 por molécula en diborano) contiene un par de electrones que conectan los átomos de boro entre sí en forma de plátano, con un protón (el núcleo de un átomo de hidrógeno) en el medio del enlace, compartiendo electrones con ambos. átomos de boro. En ciertos compuestos de grupos, también se han postulado los llamados enlaces de dos electrones de cuatro centros.
Después del desarrollo de la mecánica cuántica, se propusieron dos teorías básicas para proporcionar una descripción cuántica del enlace químico: la teoría del enlace de valencia (VB) y la teoría del orbital molecular (MO). Se da una descripción cuántica más reciente en términos de contribuciones atómicas a la densidad electrónica de estados.
Las dos teorías representan dos formas de construir la configuración electrónica de la molécula. Para la teoría del enlace de valencia, los orbitales híbridos atómicos se llenan primero con electrones para producir una configuración de valencia completamente enlazada, y luego se realiza una combinación lineal de estructuras contribuyentes (resonancia) si hay varias de ellas. Por el contrario, para la teoría de orbitales moleculares, primero se realiza una combinación lineal de orbitales atómicos, seguida del llenado de los orbitales moleculares resultantes con electrones.
Los dos enfoques se consideran complementarios y cada uno proporciona sus propios conocimientos sobre el problema de los enlaces químicos. Dado que la teoría del enlace de valencia construye la función de onda molecular a partir de enlaces localizados, es más adecuada para el cálculo de las energías de enlace y la comprensión de los mecanismos de reacción. Dado que la teoría de orbitales moleculares construye la función de onda molecular a partir de orbitales deslocalizados, es más adecuada para el cálculo de las energías de ionización y la comprensión de las bandas de absorción espectral.
A nivel cualitativo, ambas teorías contienen predicciones incorrectas. La teoría simple del enlace de valencia (Heitler-London) predice correctamente la disociación de moléculas diatómicas homonucleares en átomos separados, mientras que la teoría simple de orbitales moleculares (Hartree-Fock) predice incorrectamente la disociación en una mezcla de átomos e iones. Por otro lado, la teoría de orbitales moleculares simples predice correctamente la regla de aromaticidad de Hückel, mientras que la teoría del enlace de valencia simple predice incorrectamente que el ciclobutadieno tiene una energía de resonancia mayor que el benceno.
Aunque las funciones de onda generadas por ambas teorías a nivel cualitativo no concuerdan y no igualan la energía de estabilización por experimento, pueden ser corregidas por interacción de configuración. Esto se hace combinando la función covalente del enlace de valencia con las funciones que describen todas las estructuras iónicas posibles o combinando la función del estado fundamental del orbital molecular con las funciones que describen todos los estados excitados posibles usando orbitales desocupados. Entonces se puede ver que el enfoque de orbitales moleculares simples sobreestima el peso de las estructuras iónicas, mientras que el enfoque de enlace de valencia simple las desprecia. Esto también se puede describir como diciendo que el enfoque de orbitales moleculares simples descuida la correlación de electrones, mientras que el enfoque de enlace de valencia simple la sobreestima.
Los cálculos modernos en química cuántica generalmente comienzan (pero en última instancia van mucho más allá) desde un orbital molecular en lugar de un enfoque de enlace de valencia, no debido a una superioridad intrínseca en el primero, sino porque el enfoque MO se adapta más fácilmente a los cálculos numéricos. Los orbitales moleculares son ortogonales, lo que aumenta significativamente la viabilidad y la velocidad de los cálculos informáticos en comparación con los orbitales de enlace de valencia no ortogonales.
En COOP, COHP y BCOOP, la evaluación de la covalencia del enlace depende de la base establecida. Para superar este problema, se puede proporcionar de esta forma una formulación alternativa de la covalencia del enlace.
La masa central cm (n, l, m l, m s) de un orbital atómico | n, l, m l, m s ⟩, con números cuánticos n, l, m l, m s, para el átomo A se define como
donde g
| norte, l, metro l, metro ⟩ _(E) es la contribución del orbital atómico | n, l, m l, m s ⟩ del átomo A a la densidad electrónica total de estados g (E) del sólido
donde la suma exterior corre sobre todos los átomos A de la celda unitaria. La ventana de energía [ E 0, E 1 ] se elige de tal manera que abarque todas las bandas relevantes que participan en el enlace. Si el rango a seleccionar no está claro, se puede identificar en la práctica examinando los orbitales moleculares que describen la densidad de electrones junto con el enlace considerado.
La posición relativa C n A l A, n B l B del centro de masa de | n A, l A ⟩ niveles del átomo A con respecto al centro de masa de | n B, l B ⟩ niveles del átomo B se da como
donde se suman las contribuciones de los números cuánticos magnéticos y de espín. Según esta definición, la posición relativa de los niveles A con respecto a los niveles B es
donde, por simplicidad, podemos omitir la dependencia del número cuántico principal n en la notación que se refiere a C n A l A, n B l B.
En este formalismo, cuanto mayor sea el valor de CA ,B, mayor será la superposición de las bandas atómicas seleccionadas y, por lo tanto, la densidad electrónica descrita por esos orbitales da un enlace A-B más covalente. La cantidad C A,B se denota como la covalencia del enlace A–B, que se especifica en las mismas unidades de la energía E.
El nobelio es un elemento químico sintético con el símbolo No y el número atómico 102. Recibe su nombre en honor a Alfred Nobel, el inventor de la... (leer más)
La composición química se refiere a la identidad y el número de elementos químicos que forman un compuesto en... (leer más)
(leer más)