Enlace carbono-carbono
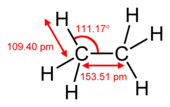
Un enlace carbono-carbono es un enlace covalente entre dos átomos de carbono. La forma más común es el enlace simple: un enlace compuesto por dos electrones, uno de cada uno de los dos átomos. El enlace simple carbono-carbono es un enlace sigma y se forma entre un orbital hibridado de cada uno de los átomos de carbono. En el etano, los orbitales son orbitales con hibridación sp3, pero se forman enlaces simples entre átomos de carbono con otras hibridaciones (por ejemplo, sp2 a sp2). De hecho, no es necesario que los átomos de carbono del enlace simple tengan la misma hibridación. Los átomos de carbono también pueden formar dobles enlaces en compuestos llamados alquenos o triples enlaces en compuestos llamados alquinos. Se forma un doble enlace con un orbital hibridado sp2 y un orbital p que no participa en la hibridación. Se forma un triple enlace con un orbital sp-hibridado y dos orbitales p de cada átomo. El uso de orbitales p forma un enlace pi.
Cadenas y ramificaciones
El carbono es uno de los pocos elementos que puede formar largas cadenas de sus propios átomos, una propiedad llamada catenación. Esto, sumado a la fuerza del enlace carbono-carbono, da lugar a una enorme cantidad de formas moleculares, muchas de las cuales son importantes elementos estructurales de la vida, por lo que los compuestos de carbono tienen su propio campo de estudio: la química orgánica.
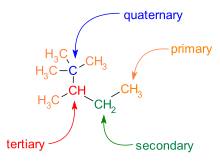
La ramificación también es común en los esqueletos C-C. Los átomos de carbono en una molécula se clasifican según la cantidad de carbonos vecinos que tienen:
- Un carbono primario tiene un vecino de carbono.
- Un carbono secundario tiene dos vecinos de carbono.
- Un carbono terciario tiene tres vecinos de carbono.
- Un carbono cuaternario tiene cuatro vecinos de carbono.
En las "moléculas orgánicas estructuralmente complejas", es la orientación tridimensional de los enlaces carbono-carbono en los lugares cuaternarios la que dicta la forma de la molécula. Además, los loci cuaternarios se encuentran en muchas moléculas pequeñas biológicamente activas, como la cortisona y la morfina.
Síntesis
Lasreacciones de formación de enlaces carbono-carbono son reacciones orgánicas en las que se forma un nuevo enlace carbono-carbono. Son importantes en la producción de muchas sustancias químicas artificiales, como productos farmacéuticos y plásticos. La reacción inversa, en la que se rompe un enlace carbono-carbono, se conoce como activación del enlace carbono-carbono.
Algunos ejemplos de reacciones que forman enlaces carbono-carbono son la reacción aldólica, la reacción de Diels-Alder, la reacción de Grignard, las reacciones de acoplamiento cruzado, la reacción de Michael y la reacción de Wittig.
La síntesis dirigida de estructuras tridimensionales deseadas para los carbonos terciarios se resolvió en gran medida a finales del siglo XX, pero la misma capacidad para dirigir la síntesis de carbono cuaternario no comenzó a surgir hasta la primera década del siglo XXI.
Fuerzas y longitudes de unión
El enlace simple carbono-carbono es más débil que C-H, O-H, N-H, H-H, H-Cl, C-F y muchos enlaces dobles o triples, y comparable en fuerza a los enlaces C-O, Si-O, P-O y S-H. pero comúnmente se considera fuerte.
| C-C bond | Molecule | Energía de disociación ósea (kcal/mol) |
|---|---|---|
| CH3Č3 | etano | 90 |
| C6H5Č3 | tolueno | 102 |
| C6H5−C6H5 | bifenilo | 114 |
| CH3C(O)−CH3 | acetone | 84 |
| CH3−CN | acetonitrile | 136 |
| CH3Č2Oh. | etanol | 88 |
Los valores dados anteriormente representan energías de disociación de enlaces C-C que comúnmente se encuentran; Ocasionalmente, los valores atípicos pueden desviarse drásticamente de este rango.
Casos extremos
Enlaces simples C-C largos y débiles
Se han identificado varios casos extremos en los que el enlace C-C se alarga. En el dímero de Gomberg, un enlace C-C es bastante largo, de 159,7 picómetros. Es este enlace el que se rompe de manera reversible y fácil a temperatura ambiente en solución:
En la molécula aún más congestionada de hexakis(3,5-di-terc-butilfenil)etano, la energía de disociación del enlace para formar el radical triarilmetilo estabilizado es de sólo 8 kcal/mol. También como consecuencia de su severa congestión estérica, el hexakis(3,5-di-terc-butilfenil)etano tiene un enlace central muy alargado con una longitud de 167 pm.
Dobles enlaces C-C débiles y retorcidos
La estructura del tetrakis(dimetilamino)etileno (TDAE) está muy distorsionada. El ángulo diédrico para los dos extremos N2C es 28º aunque la distancia C=C es normal 135 pm. El tetraisopropiletano casi isoestructural también tiene una distancia C=C de 135 pm, pero su núcleo C6 es plano.
Triples enlaces C-C cortos y fuertes
En el extremo opuesto, el enlace simple central carbono-carbono del diacetileno es muy fuerte a 160 kcal/mol, ya que el enlace simple une dos carbonos de hibridación sp. Los enlaces múltiples carbono-carbono son generalmente más fuertes; Se ha determinado que el doble enlace del etileno y el triple enlace del acetileno tienen energías de disociación del enlace de 174 y 230 kcal/mol, respectivamente. Se ha observado un triple enlace muy corto de 115 pm para la especie de yodonio [HC≡C–I+Ph][CF3SO3 –], debido a la fracción de yodonio, fuertemente aceptora de electrones.
Contenido relacionado
Sulfito
Óxido de potasio
Cargo parcial