Enfermedad celíaca
enfermedad celíaca (inglés británico) o enfermedad celíaca (inglés americano) es un trastorno autoinmune a largo plazo que afecta principalmente al intestino delgado, donde las personas desarrollan intolerancia al gluten., presente en alimentos como el trigo, el centeno y la cebada. Los síntomas clásicos incluyen problemas gastrointestinales como diarrea crónica, distensión abdominal, malabsorción, pérdida de apetito y, entre los niños, falta de crecimiento normal. Esto a menudo comienza entre los seis meses y los dos años de edad. Los síntomas no clásicos son más comunes, especialmente en personas mayores de dos años. Puede haber síntomas gastrointestinales leves o ausentes, una gran cantidad de síntomas que involucran cualquier parte del cuerpo o ningún síntoma evidente. La enfermedad celíaca se describió por primera vez en la infancia; sin embargo, puede desarrollarse a cualquier edad. Se asocia a otras enfermedades autoinmunes, como la diabetes mellitus tipo 1 y la tiroiditis de Hashimoto, entre otras.
La enfermedad celíaca es causada por una reacción al gluten, un grupo de varias proteínas que se encuentran en el trigo y en otros granos como la cebada y el centeno. Por lo general, se toleran cantidades moderadas de avena, sin contaminación con otros cereales que contengan gluten. La aparición de problemas puede depender de la variedad de avena. Ocurre con mayor frecuencia en personas que están genéticamente predispuestas. Tras la exposición al gluten, una respuesta inmunitaria anormal puede conducir a la producción de varios autoanticuerpos diferentes que pueden afectar a varios órganos diferentes. En el intestino delgado, esto provoca una reacción inflamatoria y puede producir un acortamiento de las vellosidades que recubren el intestino delgado (atrofia de las vellosidades). Esto afecta la absorción de nutrientes, lo que con frecuencia conduce a la anemia.
El diagnóstico generalmente se realiza mediante una combinación de pruebas de anticuerpos en sangre y biopsias intestinales, con la ayuda de pruebas genéticas específicas. Hacer el diagnóstico no siempre es sencillo. Alrededor del 10% de las veces, los autoanticuerpos en la sangre son negativos y muchas personas solo tienen cambios intestinales menores con vellosidades normales. Las personas pueden tener síntomas graves y pueden ser investigados durante años antes de que se logre un diagnóstico. Como resultado de la detección, el diagnóstico se realiza cada vez más en personas que no presentan síntomas. Sin embargo, la evidencia sobre los efectos de la detección no es suficiente para determinar su utilidad. Si bien la enfermedad es causada por una intolerancia permanente a las proteínas del gluten, es distinta de la alergia al trigo, que es mucho más rara.
El único tratamiento eficaz conocido es una dieta estricta sin gluten durante toda la vida, que conduce a la recuperación del revestimiento intestinal (membrana mucosa), mejora los síntomas y reduce el riesgo de desarrollar complicaciones en la mayoría de las personas. Si no se trata, puede provocar cánceres como el linfoma intestinal y un riesgo ligeramente mayor de muerte prematura. Las tasas varían entre las diferentes regiones del mundo, desde tan solo 1 en 300 hasta 1 en 40, con un promedio de entre 1 en 100 y 1 en 170 personas. Se estima que el 80% de los casos permanecen sin diagnosticar, generalmente debido a molestias gastrointestinales mínimas o inexistentes y falta de conocimiento de los síntomas y criterios de diagnóstico. La enfermedad celíaca es ligeramente más común en mujeres que en hombres.
Signos y síntomas
Los síntomas clásicos de la enfermedad celíaca no tratada incluyen heces pálidas, blandas o grasosas (esteatorrea) y pérdida de peso o falta de aumento de peso. Otros síntomas comunes pueden ser sutiles o presentarse principalmente en órganos distintos del intestino mismo. También es posible tener la enfermedad celíaca sin ninguno de los síntomas clásicos. Se ha demostrado que esto comprende al menos el 43% de las presentaciones en niños. Además, muchos adultos con enfermedad sutil pueden presentar solo fatiga, anemia o masa ósea baja. Muchas personas no diagnosticadas que se consideran asintomáticas en realidad no lo son, sino que se han acostumbrado a vivir en un estado de salud crónicamente comprometido. De hecho, después de comenzar una dieta sin gluten y la mejora posterior se hace evidente, estas personas a menudo pueden recordar y reconocer retrospectivamente los síntomas anteriores de su enfermedad no tratada que habían ignorado por error.
Aparato digestivo
La diarrea característica de la enfermedad celíaca es crónica, a veces pálida, de gran volumen y con un olor anormalmente fétido. Puede haber dolor abdominal, calambres, hinchazón con distensión abdominal (que se cree que es el resultado de la producción fermentativa de gases intestinales) y úlceras en la boca. A medida que el intestino se daña más, se puede desarrollar un grado de intolerancia a la lactosa. Con frecuencia, los síntomas se atribuyen al síndrome del intestino irritable (IBS), solo para luego reconocerse como enfermedad celíaca. En poblaciones de personas con síntomas de SII, se puede realizar un diagnóstico de enfermedad celíaca en alrededor del 3,3 % de los casos, o cuatro veces más probable que en general. El Instituto Nacional para la Salud y la Excelencia Clínica (NICE), la Sociedad Británica de Gastroenterología y el Colegio Estadounidense de Gastroenterología recomiendan hacerles pruebas de detección de la enfermedad celíaca, pero su beneficio no está claro en América del Norte.
La enfermedad celíaca conduce a un mayor riesgo tanto de adenocarcinoma como de linfoma del intestino delgado (linfoma de células T asociado a enteropatía [EATL] u otros linfomas no Hodgkin). Este riesgo también es mayor en familiares de primer grado como hermanos, padres e hijos. No está claro si una dieta sin gluten devuelve este riesgo a la línea de base. La enfermedad prolongada y no tratada puede dar lugar a otras complicaciones, como yeyunitis ulcerosa (formación de una úlcera en el intestino delgado) y estenosis (estrechamiento como resultado de la cicatrización con obstrucción del intestino).
Relacionado con malabsorción
Los cambios en el intestino reducen su capacidad para absorber nutrientes, minerales y las vitaminas liposolubles A, D, E y K.
- La malabsorción de los carbohidratos y las grasas puede causar pérdida de peso (o falta de crecimiento acelerado o aturdido en los niños) y fatiga o falta de energía.
- La anemia puede desarrollarse de varias maneras: la malabsorción de hierro puede causar anemia por deficiencia de hierro, y el ácido fólico y la malabsorción de vitamina B12 pueden dar lugar a anemia megaloblástica.
- La malabsorción del calcio y la vitamina D (y el hiperparatiroidismo secundario compensatorio) pueden causar osteopenia (contenido mineral reducido del hueso) o osteoporosis (debilitación ósea y riesgo de fracturas de fragilidad).
- La malabsorción de selenio en la enfermedad celíaca, combinada con bajo contenido de selenio en muchos alimentos sin gluten, confiere un riesgo de deficiencia de selenio.
- Las deficiencias de cobre y zinc también se han asociado con la enfermedad celíaca.
- Una pequeña proporción tiene coagulación anormal debido a la deficiencia de vitamina K y corren un ligero riesgo de sangrado anormal.
Varios
La enfermedad celíaca se ha relacionado con muchas afecciones. En muchos casos, no está claro si la enfermedad intestinal inducida por el gluten es un factor causal o si estas condiciones comparten una predisposición común.
- La deficiencia de IgA está presente en el 2,3% de las personas con enfermedad celíaca, y se asocia con un riesgo diez veces mayor de enfermedad celíaca. Otras características de esta afección son un mayor riesgo de infecciones y enfermedades autoinmunes.
- Dermatitis herpetiformis, una afección cutánea picante que se ha vinculado a una enzima transglutaminasa en la piel, presenta cambios de pequeño codo idénticos a los de la enfermedad celíaca y puede responder a la retirada de gluten incluso si no hay síntomas gastrointestinales presentes.
- El fracaso del crecimiento y/o retraso pubertal en la infancia posterior puede ocurrir incluso sin síntomas de intestino obvios o malnutrición grave. La evaluación del fracaso del crecimiento a menudo incluye la detección celíaca.
- Las complicaciones del embarazo pueden ocurrir si la enfermedad celíaca es preexistente o adquirida posteriormente, con resultados significativos como el aborto, la restricción del crecimiento intrauterino, el bajo peso al nacer y el parto prematuro.
- El hipoposplenismo (un bazo pequeño y subactivo) ocurre en aproximadamente un tercio de los casos y puede predisponerse a la infección debido al papel del bazo en la protección contra las bacterias dañinas.
- Se pueden ver exámenes anormales de la función hepática (a menudo detectados en análisis de sangre).
La enfermedad celíaca está asociada con varias otras afecciones médicas, muchas de las cuales son trastornos autoinmunes: diabetes mellitus tipo 1, hipotiroidismo, colangitis biliar primaria, colitis microscópica, ataxia por gluten, psoriasis, vitíligo, hepatitis autoinmune, colangitis esclerosante primaria y más.
Causa
La enfermedad celíaca es causada por una reacción inflamatoria a las gliadinas y gluteninas (proteínas del gluten) que se encuentran en el trigo y a proteínas similares que se encuentran en los cultivos de la tribu Triticeae (que incluye otros cereales comunes como la cebada y el centeno) y a la tribu Aveneae (avena). Las subespecies de trigo (como la espelta, el trigo duro y el Kamut) y los híbridos de trigo (como el triticale) también provocan síntomas de la enfermedad celíaca.
Un pequeño número de personas con enfermedad celíaca reaccionan a la avena. La toxicidad de la avena en las personas celíacas depende del cultivar de avena consumido porque los genes de prolamina, las secuencias de aminoácidos de las proteínas y las inmunorreactividades de las prolaminas tóxicas son diferentes en las diferentes variedades de avena. Además, la avena se contamina con frecuencia con otros cereales que contienen gluten. El término "avena pura" se refiere a la avena no contaminada con otros cereales que contienen gluten. Los efectos a largo plazo del consumo de avena pura aún no están claros, y se necesitan más estudios que identifiquen los cultivares utilizados antes de hacer recomendaciones finales sobre su inclusión en una dieta sin gluten. Las personas celíacas que eligen consumir avena necesitan un seguimiento más riguroso de por vida, que posiblemente incluya biopsias intestinales periódicas.
Otros cereales
Otros cereales como el maíz, el mijo, el sorgo, el teff, el arroz y el arroz salvaje son seguros para que los consuman las personas con enfermedad celíaca, así como los que no son cereales como el amaranto, la quinua y el trigo sarraceno. Los alimentos ricos en carbohidratos no cereales, como las papas y los plátanos, no contienen gluten y no desencadenan síntomas.
Modificadores de riesgo
Existen varias teorías sobre lo que determina si un individuo genéticamente susceptible desarrollará la enfermedad celíaca. Las principales teorías incluyen cirugía, embarazo, infección y estrés emocional.
El consumo de gluten en una etapa temprana de la vida de un bebé no parece aumentar el riesgo de enfermedad celíaca, pero la introducción posterior después de los 6 meses puede aumentarlo. Existe incertidumbre sobre si ser amamantado reduce el riesgo. Prolongar la lactancia materna hasta la introducción de cereales que contienen gluten en la dieta parece estar asociado con un 50% menos de riesgo de desarrollar enfermedad celíaca en la infancia; si esto persiste en la edad adulta no está claro. Estos factores pueden influir en el momento del inicio.
Fisiopatología
La enfermedad celíaca parece ser multifactorial, tanto en que más de un factor genético puede causar la enfermedad como en que más de un factor es necesario para que la enfermedad se manifieste en una persona.
Casi todas las personas (95 %) con enfermedad celíaca tienen la variante del alelo HLA-DQ2 o (con menos frecuencia) el alelo HLA-DQ8. Sin embargo, alrededor del 20 al 30 % de las personas sin enfermedad celíaca también han heredado alguno de estos alelos. Esto sugiere que se necesitan factores adicionales para que se desarrolle la enfermedad celíaca; es decir, el alelo de riesgo HLA predisponente es necesario pero no suficiente para desarrollar la enfermedad celíaca. Además, alrededor del 5% de las personas que desarrollan la enfermedad celíaca no tienen los alelos HLA-DQ2 o HLA-DQ8 típicos (ver más abajo).
Genética
La gran mayoría de las personas celíacas tienen uno de los dos tipos (de siete) de la proteína HLA-DQ. HLA-DQ es parte del MHC receptor presentador de antígeno de clase II (también llamado antígeno leucocitario humano) y distingue las células entre propias y no propias para los fines del sistema inmunitario. Las dos subunidades de la proteína HLA-DQ están codificadas por los genes HLA-DQA1 y HLA-DQB1, ubicados en el brazo corto del cromosoma 6.
Hay siete variantes HLA-DQ (DQ2 y DQ4–DQ9). Más del 95% de las personas celíacas tienen la isoforma DQ2 o DQ8, que se hereda en las familias. La razón por la que estos genes producen un aumento en el riesgo de enfermedad celíaca es que los receptores formados por estos genes se unen a los péptidos de gliadina con más fuerza que otras formas del receptor presentador de antígenos. Por lo tanto, es más probable que estas formas del receptor activen los linfocitos T e inicien el proceso autoinmune.
La mayoría de las personas celíacas tienen un haplotipo HLA-DQ2 de dos genes denominado haplotipo DQ2.5. Este haplotipo está compuesto por dos alelos de genes adyacentes, DQA1*0501 y DQB1*0201, que codifican las dos subunidades, DQ α5 y DQ β2. En la mayoría de los individuos, esta isoforma DQ2.5 está codificada por uno de los dos cromosomas 6 heredados de los padres (DQ2.5cis). La mayoría de los celíacos heredan solo una copia de este haplotipo DQ2.5, mientras que algunos lo heredan de ambos padres; estos últimos tienen un riesgo especial de enfermedad celíaca, además de ser más susceptibles a complicaciones graves.
Algunas personas heredan DQ2.5 de uno de los padres y una porción adicional del haplotipo (ya sea DQB1*02 o DQA1*05) del otro padre, lo que aumenta el riesgo. Con menos frecuencia, algunas personas heredan el alelo DQA1*05 de uno de los padres y el DQB1*02 del otro padre (DQ2.5trans) (lo que se denomina asociación trans-haplotípica), y estas personas tienen un riesgo similar de enfermedad celíaca que las personas con un solo cromosoma 6 portador de DQ2.5, pero en este caso, la enfermedad tiende a no ser familiar. Del 6% de celíacos europeos que no tienen DQ2.5 (cis o trans) ni DQ8 (codificado por el haplotipo DQA1*03:DQB1*0302), el 4% tiene la isoforma DQ2.2 y el 2% restante carece DQ2 o DQ8.
La frecuencia de estos genes varía geográficamente. DQ2.5 tiene una alta frecuencia en pueblos del norte y oeste de Europa (País Vasco e Irlanda con las frecuencias más altas) y partes de África y está asociado con enfermedades en India, pero no se encuentra a lo largo de partes del borde del Pacífico occidental. DQ8 tiene una distribución global más amplia que DQ2.5 y es particularmente común en América del Sur y Central; hasta el 90% de los individuos en ciertas poblaciones amerindias portan DQ8 y, por lo tanto, pueden mostrar el fenotipo celíaco.
Se han informado repetidamente otros factores genéticos en la enfermedad celíaca; sin embargo, la participación en la enfermedad tiene un reconocimiento geográfico variable. Solo los loci HLA-DQ muestran una implicación constante sobre la población mundial. Muchos de los loci detectados se han encontrado en asociación con otras enfermedades autoinmunes. Un locus, el LPP o gen asociado preferido por lipoma, está involucrado en la adhesión de la matriz extracelular a la superficie celular, y una variante menor (SNP=rs1464510) aumenta el riesgo de enfermedad en aproximadamente un 30 %. Este gen se asocia fuertemente con la enfermedad celíaca (p < 10−39) en muestras tomadas de una amplia zona de Europa y EE. UU.
La prevalencia de los genotipos de la enfermedad celíaca en la población moderna no se comprende por completo. Dadas las características de la enfermedad y su aparente fuerte heredabilidad, normalmente se esperaría que los genotipos sufrieran una selección negativa y que estuvieran ausentes en sociedades donde la agricultura se ha practicado durante más tiempo (comparar con una condición similar, la intolerancia a la lactosa, que ha sido seleccionado negativamente con tanta fuerza que su prevalencia pasó de ~100% en poblaciones ancestrales a menos del 5% en algunos países europeos). Esta expectativa fue propuesta por primera vez por Simoons (1981). A estas alturas, sin embargo, es evidente que este no es el caso; por el contrario, existe evidencia de selección positiva en genotipos de enfermedad celíaca. Se sospecha que algunos de ellos pueden haber sido beneficiosos al brindar protección contra infecciones bacterianas.
Prolaminas
La mayoría de las proteínas de los alimentos responsables de la reacción inmunitaria en la enfermedad celíaca son las prolaminas. Se trata de proteínas de almacenamiento ricas en prolina (prol-) y glutamina (-amina) que se disuelven en alcoholes y son resistentes a las proteasas y peptidasas del intestino. Las prolaminas se encuentran en los granos de cereales con diferentes granos que tienen prolaminas diferentes pero relacionadas: trigo (gliadina), cebada (hordeína), centeno (secalina) y avena (avenina). Una región de α-gliadina estimula las células de la membrana, los enterocitos, del intestino para permitir que moléculas más grandes rodeen el sellador entre las células. La interrupción de las uniones estrechas permite que los péptidos de más de tres aminoácidos ingresen al revestimiento intestinal.
La fuga de la membrana permite la formación de péptidos de gliadina que estimulan dos niveles de la respuesta inmunitaria: la respuesta innata y la respuesta adaptativa (mediada por células T colaboradoras). Un péptido resistente a la proteasa de α-gliadina contiene una región que estimula los linfocitos y da como resultado la liberación de interleucina-15. Esta respuesta innata a la gliadina da como resultado una señalización del sistema inmunitario que atrae a las células inflamatorias y aumenta la liberación de sustancias químicas inflamatorias. La respuesta adaptativa más fuerte y común a la gliadina se dirige hacia un fragmento de gliadina α2 de 33 aminoácidos de longitud.
La respuesta al 33mer ocurre en la mayoría de los celíacos que tienen una isoforma DQ2. Este péptido, cuando es alterado por la transglutaminasa intestinal, tiene una alta densidad de epítopos de células T superpuestos. Esto aumenta la probabilidad de que la isoforma DQ2 se una y permanezca unida al péptido cuando sea reconocida por las células T. La gliadina del trigo es el miembro mejor comprendido de esta familia, pero existen otras prolaminas, y la hordeína (de la cebada), la secalina (del centeno) y la avenina (de la avena) pueden contribuir a la enfermedad celíaca. La toxicidad de la avenina en personas con enfermedad celíaca depende de la variedad de avena consumida, ya que los genes de prolamina, las secuencias de aminoácidos de las proteínas y las inmunorreactividades de las prolaminas tóxicas varían entre las variedades de avena.
Transglutaminasa tisular
Los anticuerpos antitransglutaminasa de la enzima transglutaminasa tisular (tTG) se encuentran en la sangre de la mayoría de las personas con síntomas clásicos y atrofia vellositaria completa, pero solo en el 70 % de los casos con atrofia vellositaria parcial y el 30 % de los casos con lesiones mucosas menores. La transglutaminasa tisular modifica los péptidos del gluten en una forma que puede estimular el sistema inmunitario con mayor eficacia. Estos péptidos son modificados por tTG de dos maneras, desamidación o transamidación.
La desamidación es la reacción mediante la cual se forma un residuo de glutamato mediante la escisión del grupo épsilon-amino de una cadena lateral de glutamina. La transamidación, que ocurre tres veces más a menudo que la desamidación, es el entrecruzamiento de un residuo de glutamina del péptido de gliadina a un residuo de lisina de tTg en una reacción catalizada por la transglutaminasa. El entrecruzamiento puede ocurrir dentro o fuera del sitio activo de la enzima. El último caso produce un complejo permanentemente unido covalentemente entre la gliadina y la tTg. Esto da como resultado la formación de nuevos epítopos que se cree desencadenan la respuesta inmunitaria primaria mediante la cual se desarrollan los autoanticuerpos contra la tTg.
Las biopsias almacenadas de personas con sospecha de enfermedad celíaca han revelado que los depósitos de autoanticuerpos en los celíacos subclínicos se detectan antes de la enfermedad clínica. Estos depósitos también se encuentran en personas que presentan otras enfermedades autoinmunes, anemia o fenómenos de malabsorción a un ritmo mucho mayor que el de la población normal. Se cree que los componentes del endomisio de los anticuerpos (EMA) contra la tTG se dirigen hacia la transglutaminasa de la superficie celular, y estos anticuerpos aún se usan para confirmar el diagnóstico de enfermedad celíaca. Sin embargo, un estudio de 2006 mostró que las personas celíacas con EMA negativo tienden a ser hombres mayores con síntomas abdominales más graves y una menor frecuencia de síntomas "atípicos" síntomas, incluida la enfermedad autoinmune. En este estudio, los depósitos de anticuerpos anti-tTG no se correlacionaron con la gravedad de la destrucción de las vellosidades. Estos hallazgos, junto con un trabajo reciente que muestra que la gliadina tiene un componente de respuesta innato, sugieren que la gliadina puede ser más responsable de las manifestaciones primarias de la enfermedad celíaca, mientras que la tTG es un factor más importante en los efectos secundarios, como las respuestas alérgicas y las enfermedades autoinmunes secundarias. En un gran porcentaje de personas celíacas, los anticuerpos anti-tTG también reconocen una proteína de rotavirus llamada VP7. Estos anticuerpos estimulan la proliferación de monocitos, y la infección por rotavirus podría explicar algunos de los primeros pasos en la cascada de proliferación de células inmunitarias.
De hecho, estudios anteriores sobre el daño por rotavirus en el intestino mostraron que esto causa atrofia de las vellosidades. Esto sugiere que las proteínas virales pueden participar en el aplanamiento inicial y estimular la producción de anti-VP7 con reacción cruzada. Los anticuerpos contra VP7 también pueden retrasar la cicatrización hasta que la presentación de tTG mediada por gliadina proporcione una segunda fuente de anticuerpos de reacción cruzada.
Otros trastornos intestinales pueden tener una biopsia que se parece a la enfermedad celíaca, incluidas las lesiones causadas por Candida.
Atrofia de las vellosidades y malabsorción
El proceso inflamatorio, mediado por las células T, conduce a la alteración de la estructura y la función del revestimiento de la mucosa del intestino delgado y causa malabsorción, ya que afecta la capacidad del cuerpo para absorber nutrientes, minerales y vitaminas liposolubles A, D, E y K de los alimentos. La intolerancia a la lactosa puede estar presente debido a la disminución de la superficie intestinal y la reducción de la producción de lactasa, pero generalmente se resuelve una vez que se trata la afección.
Se han propuesto causas alternativas de este daño tisular e implican la liberación de interleucina 15 y la activación del sistema inmunitario innato por un péptido de gluten más corto (p31–43/49). Esto provocaría la muerte de los enterocitos por parte de los linfocitos en el epitelio. La atrofia de las vellosidades que se observa en la biopsia también puede deberse a causas no relacionadas, como esprúe tropical, giardiasis y enteritis por radiación. Si bien la serología positiva y la biopsia típica son altamente sugestivas de enfermedad celíaca, la falta de respuesta a la dieta puede requerir que se consideren estos diagnósticos alternativos.
Diagnóstico
El diagnóstico suele ser difícil y, a partir de 2019, sigue habiendo una falta de conciencia entre los médicos sobre la variabilidad de las presentaciones de la enfermedad celíaca y los criterios de diagnóstico, por lo que la mayoría de los casos se diagnostican con gran retraso. Puede tomar hasta 12 años recibir un diagnóstico desde el inicio de los síntomas y la mayoría de los afectados en la mayoría de los países nunca lo reciben.
Se pueden utilizar varias pruebas. El nivel de los síntomas puede determinar el orden de las pruebas, pero todas las pruebas pierden su utilidad si la persona ya lleva una dieta sin gluten. El daño intestinal comienza a sanar a las pocas semanas de eliminar el gluten de la dieta y los niveles de anticuerpos disminuyen durante meses. Para aquellos que ya han comenzado con una dieta sin gluten, puede ser necesario realizar una nueva provocación con algún alimento que contenga gluten en una comida al día durante 6 semanas antes de repetir las investigaciones.
Análisis de sangre
Los análisis de sangre serológicos son la investigación de primera línea requerida para hacer un diagnóstico de la enfermedad celíaca. Su sensibilidad se correlaciona con el grado de lesiones histológicas. Las personas que presentan daños menores en el intestino delgado pueden tener resultados seronegativos, por lo que a menudo se pasan por alto muchos pacientes con enfermedad celíaca. En pacientes con atrofia de las vellosidades, los anticuerpos antiendomisio (EMA) del tipo inmunoglobulina A (IgA) pueden detectar la enfermedad celíaca con una sensibilidad y especificidad del 90% y 99%, respectivamente. Se informó inicialmente que la serología para anticuerpos anti-transglutaminasa (anti-tTG) tenía una mayor sensibilidad (99%) y especificidad (>90%). Sin embargo, ahora se cree que tiene características similares a los anticuerpos antiendomisio. Tanto los anticuerpos antitransglutaminasa como antiendomisio tienen una alta sensibilidad para diagnosticar a las personas con síntomas clásicos y atrofia de las vellosidades completa, pero solo se encuentran en el 30-89% de los casos con atrofia de las vellosidades parcial y en menos del 50% de las personas con atrofia de las vellosidades. tienen lesiones mucosas menores (linfocitosis duodenal) con vellosidades normales.
La transglutaminasa tisular modifica los péptidos del gluten en una forma que puede estimular el sistema inmunitario con mayor eficacia. Estos péptidos son modificados por tTG de dos maneras, desamidación o transamidación. Los ensayos anti-tTG modernos se basan en una proteína recombinante humana como antígeno. La prueba de tTG debe realizarse primero, ya que es una prueba más fácil de realizar. Un resultado equívoco en la prueba de tTG debe ir seguido de anticuerpos antiendomisio.
Las pautas recomiendan que se verifique un nivel sérico total de IgA en paralelo, ya que las personas con celiaquía con deficiencia de IgA pueden ser incapaces de producir los anticuerpos de los que dependen estas pruebas ("falso negativo"). En esas personas, los anticuerpos IgG contra la transglutaminasa (IgG-tTG) pueden ser diagnósticos.
Si todos estos anticuerpos son negativos, se deben determinar los anticuerpos anti-DGP (anticuerpos contra los péptidos de gliadina desamidados). Los anticuerpos anti-DGP de clase IgG pueden ser útiles en personas con deficiencia de IgA. En niños menores de dos años, los anticuerpos anti-DGP funcionan mejor que las pruebas de anticuerpos antiendomisio y antitransglutaminasa.
Debido a las importantes implicaciones de un diagnóstico de enfermedad celíaca, las pautas profesionales recomiendan que un análisis de sangre positivo sea seguido de una endoscopia/gastroscopia y una biopsia. Una prueba de serología negativa aún puede ser seguida por una recomendación de endoscopia y biopsia duodenal si la sospecha clínica sigue siendo alta.
Históricamente, se midieron otros tres anticuerpos: anticuerpos antirreticulina (ARA), antigliadina (AGA) y antiendomisio (EMA). Sin embargo, las pruebas de ARA no son lo suficientemente precisas para el uso de diagnóstico de rutina. La serología puede no ser confiable en niños pequeños, ya que la antigliadina tiene un desempeño algo mejor que otras pruebas en niños menores de cinco años. Las pruebas serológicas se basan en inmunofluorescencia indirecta (reticulina, gliadina y endomisio) o ELISA (gliadina o transglutaminasa tisular, tTG).
Otros anticuerpos, como los anticuerpos anti-Saccharomyces cerevisiae, se presentan en algunas personas con enfermedad celíaca, pero también se presentan en otros trastornos autoinmunitarios y en alrededor del 5 % de quienes donan sangre.
Las pruebas de anticuerpos se pueden combinar con las pruebas de HLA si el diagnóstico no está claro. Las pruebas TGA y EMA son las pruebas de anticuerpos séricos más sensibles, pero como un tipo HLA-DQ negativo excluye el diagnóstico de enfermedad celíaca, las pruebas también para HLA-DQ2 o DQ8 maximizan la sensibilidad y los valores predictivos negativos. En el Reino Unido, el Instituto Nacional para la Salud y la Excelencia Clínica (NICE) no recomienda (a partir de 2015) el uso de la tipificación HLA para descartar la enfermedad celíaca fuera de un entorno especializado, por ejemplo, en niños que no tienen un biopsia, o en pacientes que ya tienen una ingesta limitada de gluten y optan por no tener un desafío con gluten.
Endoscopia
Se realiza una endoscopia superior con biopsia del duodeno (más allá del bulbo duodenal) o del yeyuno para obtener múltiples muestras (de cuatro a ocho) del duodeno. No todas las áreas pueden verse igualmente afectadas; si se toman biopsias de tejido intestinal sano, el resultado sería un falso negativo. Incluso en el mismo fragmento bióptico, diferentes grados de el daño puede estar presente.
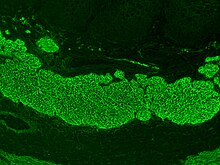
La mayoría de las personas con enfermedad celíaca tienen un intestino delgado que parece normal en la endoscopia antes de que se examinen las biopsias. Sin embargo, cinco hallazgos se han asociado con una alta especificidad para la enfermedad celíaca: festoneado de los pliegues del intestino delgado (en la imagen), escasez en los pliegues, un patrón de mosaico en la mucosa (descrito como " apariencia de lodo agrietado), prominencia de los vasos sanguíneos de la submucosa y un patrón nodular en la mucosa.
Las guías europeas sugieren que en niños y adolescentes con síntomas compatibles con la enfermedad celíaca, el diagnóstico se puede realizar sin necesidad de biopsia intestinal si los títulos de anticuerpos anti-tTG son muy elevados (10 veces el límite superior de la normalidad).
Hasta la década de 1970, las biopsias se obtenían utilizando cápsulas de metal unidas a un dispositivo de succión. La cápsula se tragó y se dejó pasar al intestino delgado. Después de verificar con rayos X su posición, se aplicó succión para recoger parte de la pared intestinal dentro de la cápsula. Los sistemas de cápsulas más utilizados fueron la cápsula de Watson y la cápsula de Crosby-Kugler. Este método ahora ha sido reemplazado en gran medida por la endoscopia de fibra óptica, que tiene una mayor sensibilidad y una menor frecuencia de errores.
La endoscopia con cápsula (CE) permite la identificación de los cambios típicos de la mucosa observados en la enfermedad celíaca, pero tiene una menor sensibilidad en comparación con la endoscopia y la histología regulares. Por lo tanto, la CE no es la principal herramienta de diagnóstico para la enfermedad celíaca. Sin embargo, la CE se puede utilizar para diagnosticar linfoma de células T, yeyunoileítis ulcerativa y adenocarcinoma en la enfermedad celíaca refractaria o complicada.
Patología
Los cambios patológicos clásicos de la enfermedad celíaca en el intestino delgado se clasifican según la 'clasificación de Marsh':
- Marsh etapa 0: mucosa normal
- Etapa 1: aumento del número de linfocitos intraepiteliales (IEL), por lo general superiores a 20 por 100 enterocitos
- Etapa 2: una proliferación de las criptas de Lieberkühn
- Marsh etapa 3: atrofia parcial o completa y hipertrofia cripta
- Etapa 4: hipoplasia de la pequeña arquitectura intestina
La clasificación de Marsh, introducida en 1992, se modificó posteriormente en 1999 a seis etapas, donde la etapa 3 anterior se dividió en tres subetapas. Estudios posteriores demostraron que este sistema no siempre era fiable y que los cambios observados en la enfermedad celíaca podían describirse en una de tres etapas:
- Una infiltración linfocítica representativa con apariencia viliosa normal;
- B1 describiendo la atrofia parcial villosa; y
- B2 describiendo completa atrofia villosa.
Los cambios suelen mejorar o revertirse después de eliminar el gluten de la dieta. Sin embargo, la mayoría de las guías no recomiendan repetir la biopsia a menos que no mejoren los síntomas con la dieta. En algunos casos, se puede realizar una provocación deliberada con gluten, seguida de una biopsia, para confirmar o refutar el diagnóstico. Una biopsia normal y una serología normal después de la provocación indican que el diagnóstico puede haber sido incorrecto.
En la enfermedad celíaca no tratada, la atrofia de las vellosidades es más común en niños menores de tres años, pero en niños mayores y adultos, es común encontrar lesiones intestinales menores (linfocitosis duodenal) con vellosidades intestinales normales.
Otras pruebas diagnósticas
En el momento del diagnóstico, se pueden realizar más investigaciones para identificar complicaciones, como la deficiencia de hierro (mediante un hemograma completo y estudios de hierro), deficiencia de ácido fólico y vitamina B12 e hipocalcemia (niveles bajos de calcio, a menudo debido a la disminución de la vitamina B12). niveles D). Se pueden solicitar pruebas de función tiroidea durante los análisis de sangre para identificar el hipotiroidismo, que es más común en personas con enfermedad celíaca.
La osteopenia y la osteoporosis, densidad mineral ósea leve o severamente reducida, a menudo están presentes en personas con enfermedad celíaca, y se pueden realizar investigaciones para medir la densidad ósea en el momento del diagnóstico, como la exploración de absorciometría de rayos X de energía dual (DXA), para identificar el riesgo de fractura y la necesidad de medicación de protección ósea.
Retirada del gluten
Aunque las pruebas de anticuerpos en sangre, las biopsias y las pruebas genéticas suelen proporcionar un diagnóstico claro, en ocasiones se necesita la respuesta a la abstinencia de gluten en una dieta sin gluten para respaldar el diagnóstico. Actualmente, la provocación con gluten ya no es necesaria para confirmar el diagnóstico en pacientes con lesiones intestinales compatibles con enfermedad celíaca y respuesta positiva a una dieta sin gluten. No obstante, en algunos casos, una provocación con gluten con biopsia posterior puede ser útil para apoyar el diagnóstico, por ejemplo en personas con alta sospecha de enfermedad celíaca, sin confirmación por biopsia, que tienen anticuerpos en sangre negativos y ya están en tratamiento con gluten. dieta libre. Se desaconseja la provocación con gluten antes de los 5 años y durante el crecimiento puberal. El diagnóstico alternativo de sensibilidad al gluten no celíaca se puede realizar cuando solo hay evidencia sintomática de sensibilidad al gluten. Los síntomas gastrointestinales y extraintestinales de las personas con sensibilidad al gluten no celíaca pueden ser similares a los de la enfermedad celíaca y mejorar cuando se elimina el gluten de la dieta, después de descartar razonablemente la enfermedad celíaca y la alergia al trigo.
Hasta el 30 % de las personas suelen seguir teniendo o volviendo a desarrollar síntomas después de comenzar una dieta sin gluten. Se necesita una interpretación cuidadosa de la respuesta sintomática, ya que la falta de respuesta en una persona con enfermedad celíaca puede deberse a la ingestión continua de pequeñas cantidades de gluten, ya sea voluntaria o inadvertidamente, o a otras afecciones comúnmente asociadas, como trastornos del intestino delgado. sobrecrecimiento bacteriano (SIBO), intolerancia a la lactosa, malabsorción de fructosa, sacarosa y sorbitol, insuficiencia pancreática exocrina y colitis microscópica, entre otros. En la enfermedad celíaca no tratada, estas son a menudo condiciones transitorias derivadas del daño intestinal. Normalmente revierten o mejoran varios meses después de iniciar una dieta sin gluten, pero pueden necesitar intervenciones temporales como la suplementación con enzimas pancreáticas, restricciones dietéticas de alimentos que contengan lactosa, fructosa, sacarosa o sorbitol, o tratamiento con antibióticos orales en el caso de enfermedades asociadas. sobrecrecimiento bacteriano. Además de la abstinencia del gluten, algunas personas deben seguir una dieta baja en FODMAP o evitar el consumo de productos comerciales sin gluten, que suelen ser ricos en conservantes y aditivos (como sulfitos, glutamatos, nitratos y benzoatos) y podrían tener un papel en el desencadenamiento de síntomas gastrointestinales funcionales.
Proyección
Existe un debate sobre los beneficios de la detección. A partir de 2017, el Grupo de Trabajo de Servicios Preventivos de los Estados Unidos encontró evidencia insuficiente para hacer una recomendación entre aquellos sin síntomas. En el Reino Unido, el Instituto Nacional para la Salud y la Excelencia Clínica (NICE) recomienda realizar pruebas para la enfermedad celíaca en familiares de primer grado de personas con la enfermedad ya confirmada, en personas con fatiga persistente, síntomas abdominales o gastrointestinales, retraso en el crecimiento, peso inexplicable. pérdida de hierro, vitamina B12 o deficiencia de folato, úlceras bucales graves y diagnósticos de diabetes tipo 1, enfermedad tiroidea autoinmune y síndrome de fatiga crónica y síndrome del intestino irritable recién diagnosticados. La dermatitis herpetiforme está incluida en otras recomendaciones. El NICE también recomienda ofrecer pruebas serológicas para la enfermedad celíaca en personas con enfermedad ósea metabólica (densidad mineral ósea reducida u osteomalacia), trastornos neurológicos inexplicables (como neuropatía periférica y ataxia), problemas de fertilidad o aborto espontáneo recurrente, enzimas hepáticas persistentemente elevadas sin causa desconocida, defectos del esmalte dental y con diagnóstico de síndrome de Down o síndrome de Turner.
Alguna evidencia ha encontrado que la detección temprana puede disminuir el riesgo de desarrollar complicaciones de salud, como osteoporosis, anemia y ciertos tipos de cáncer, trastornos neurológicos, enfermedades cardiovasculares y problemas reproductivos. Por ello, recomiendan el cribado en personas con determinados problemas de salud.
Se ha propuesto la serología como medida de cribado, ya que la presencia de anticuerpos permitiría detectar algunos casos de enfermedad celíaca no diagnosticados previamente y prevenir sus complicaciones en esas personas. Sin embargo, las pruebas serológicas tienen una alta sensibilidad solo en personas con atrofia total de las vellosidades y tienen una capacidad muy baja para detectar casos con atrofia parcial de las vellosidades o lesiones intestinales menores. Se pueden ofrecer pruebas para la enfermedad celíaca a aquellos con condiciones comúnmente asociadas.
Tratamiento
Dieta
En la actualidad, el único tratamiento eficaz es una dieta sin gluten de por vida. No existe ningún medicamento que prevenga el daño o evite que el cuerpo ataque el intestino cuando el gluten está presente. El cumplimiento estricto de la dieta ayuda a sanar los intestinos, lo que lleva a la resolución de todos los síntomas en la mayoría de los casos y, dependiendo de qué tan pronto se comience la dieta, también puede eliminar el mayor riesgo de osteoporosis y cáncer intestinal y, en algunos casos, esterilidad. La dieta puede ser engorrosa; el incumplimiento de la dieta puede provocar una recaída.
Por lo general, se solicita la opinión de un dietista para asegurarse de que la persona sepa qué alimentos contienen gluten, qué alimentos son seguros y cómo tener una dieta equilibrada a pesar de las limitaciones. En muchos países, los productos sin gluten están disponibles con receta médica y pueden ser reembolsados por los planes de seguro médico. Los productos sin gluten suelen ser más caros y más difíciles de encontrar que los alimentos comunes que contienen gluten. Dado que los productos preparados a menudo contienen trazas de gluten, algunos celíacos pueden necesitar cocinar desde cero.
El término "sin gluten" se usa generalmente para indicar un supuesto nivel inofensivo de gluten en lugar de una ausencia total. El nivel exacto en el que el gluten es inofensivo es incierto y controvertido. Una revisión sistemática reciente concluyó tentativamente que es poco probable que el consumo de menos de 10 mg de gluten por día cause anomalías histológicas, aunque señaló que se han realizado pocos estudios confiables. Regulación de la etiqueta "sin gluten" varía En la Unión Europea, la Comisión Europea emitió regulaciones en 2009 que limitan el uso de alimentos "sin gluten" etiquetas de productos alimenticios a aquellos con menos de 20 mg/kg de gluten, y "muy bajo contenido de gluten" etiquetas para aquellos con menos de 100 mg/kg. En los Estados Unidos, la FDA emitió regulaciones en 2013 que limitan el uso de alimentos "sin gluten" etiquetas de productos alimenticios a aquellos con menos de 20 ppm de gluten. El estándar internacional actual del Codex Alimentarius permite 20 ppm de gluten en los alimentos denominados "sin gluten" alimentos
La dieta sin gluten mejora la calidad de vida relacionada con la atención de la salud, y el cumplimiento estricto de la dieta brinda más beneficios que el cumplimiento incompleto. Sin embargo, la dieta sin gluten no normaliza completamente la calidad de vida.
Vacunación
Aunque no está claro si los pacientes celíacos tienen un mayor riesgo general de contraer enfermedades infecciosas, en general se les debe recomendar que reciban todas las vacunas comunes contra las enfermedades prevenibles por vacunación (EPV) como la población general. Además, algunos patógenos podrían ser perjudiciales para los pacientes celíacos. Según la Sociedad Europea para el Estudio de la Enfermedad Celíaca (ESsCD), la enfermedad celíaca puede estar asociada con hipoesplenismo o asplenia funcional, lo que podría resultar en una inmunidad deteriorada a las bacterias encapsuladas, con un mayor riesgo de tales infecciones. Por esta razón, a los pacientes que se sabe que tienen hipoesplenia se les debe administrar al menos la vacuna antineumocócica. Sin embargo, la ESsCD establece que no está claro si la vacunación con la vacuna conjugada es preferible en este entorno y si se debe considerar la vacunación adicional contra Haemophilus, meningococo e influenza si no se administró previamente. Sin embargo, Mårild et al. sugirió considerar la vacunación adicional contra la influenza debido a un mayor riesgo observado de ingreso hospitalario por esta infección en pacientes celíacos.
Enfermedad refractaria
Entre el 0,3 % y el 10 % de las personas afectadas tienen enfermedad refractaria, lo que significa que tienen atrofia de las vellosidades persistente con una dieta sin gluten a pesar de la falta de exposición al gluten durante más de 12 meses. Sin embargo, la exposición inadvertida al gluten es la causa principal de la atrofia persistente de las vellosidades y debe descartarse antes de realizar un diagnóstico de enfermedad refractaria. Las personas con poca educación básica y comprensión de la dieta sin gluten a menudo creen que están siguiendo estrictamente la dieta, pero cometen errores regulares. Además, la falta de síntomas no es un indicador fiable de la recuperación intestinal.
Si se han eliminado las causas alternativas de la atrofia de las vellosidades, se pueden considerar esteroides o inmunosupresores (como la azatioprina) en este escenario.
La enfermedad celíaca refractaria no debe confundirse con la persistencia de los síntomas a pesar de la abstinencia del gluten causada por condiciones transitorias derivadas del daño intestinal, que generalmente revierten o mejoran varios meses después de iniciar una dieta sin gluten, como el sobrecrecimiento bacteriano en el intestino delgado, intolerancia a la lactosa, malabsorción de fructosa, sacarosa y sorbitol, insuficiencia pancreática exocrina y colitis microscópica, entre otros.
Epidemiología
A nivel mundial, la enfermedad celíaca afecta a entre 1 de cada 100 y 1 de cada 170 personas. Sin embargo, las tasas varían entre las diferentes regiones del mundo desde tan solo 1 en 300 hasta 1 en 40. En los Estados Unidos se cree que afecta a 1 en 1750 (definida como una enfermedad clínica que incluye dermatitis herpetiforme con trastornos digestivos limitados). síntomas del tracto) a 1 en 105 (definido por la presencia de IgA TG en donantes de sangre). Debido a los signos y síntomas variables, se cree que alrededor del 85 % de las personas afectadas no están diagnosticadas. El porcentaje de personas con enfermedad clínicamente diagnosticada (síntomas que requieren pruebas de diagnóstico) es del 0,05 al 0,27 % en varios estudios. Sin embargo, estudios de población de partes de Europa, India, América del Sur, Australasia y EE. UU. (usando serología y biopsia) indican que el porcentaje de personas con la enfermedad puede estar entre 0,33 y 1,06 % en niños (pero 5,66 % en un estudio de hijos de saharauis predispuestos) y 0,18-1,2% en adultos. Entre aquellos en poblaciones de atención primaria que informan síntomas gastrointestinales, la tasa de enfermedad celíaca es de alrededor del 3%. En Australia, aproximadamente 1 de cada 70 personas tiene la enfermedad. La tasa entre los donantes de sangre adultos en Irán, Israel, Siria y Turquía es del 0,60 %, 0,64 %, 1,61 % y 1,15 %, respectivamente.
Las personas de ascendencia africana, japonesa y china rara vez son diagnosticadas; esto refleja una prevalencia mucho más baja de los factores de riesgo genéticos, como HLA-B8. Las personas de ascendencia india parecen tener un riesgo similar al de las personas de ascendencia caucásica occidental. Los estudios de población también indican que una gran proporción de celíacos permanecen sin diagnosticar; esto se debe, en parte, a que muchos médicos no están familiarizados con la afección y también al hecho de que puede ser asintomática. La enfermedad celíaca es ligeramente más común en mujeres que en hombres. Un gran estudio multicéntrico en los EE. UU. encontró una prevalencia del 0,75 % en grupos sin riesgo, aumentando al 1,8 % en personas sintomáticas, al 2,6 % en familiares de segundo grado (como abuelos, tía o tío, nietos, etc.) de una persona con enfermedad celíaca y un 4,5% en familiares de primer grado (hermanos, padres o hijos). Este perfil es similar a la prevalencia en Europa. Otras poblaciones con mayor riesgo de enfermedad celíaca, con tasas de prevalencia que oscilan entre el 5 % y el 10 %, incluyen personas con síndromes de Down y Turner, diabetes tipo 1 y enfermedad tiroidea autoinmune, incluidos hipertiroidismo (tiroides hiperactiva) e hipotiroidismo (tiroides poco activa).
Históricamente, se pensaba que la enfermedad celíaca era rara, con una prevalencia de alrededor del 0,02 %. La razón de los recientes aumentos en el número de casos notificados no está clara. Puede deberse, al menos en parte, a cambios en la práctica diagnóstica. También parece haber un aumento real de aproximadamente 4,5 veces que puede deberse a una menor exposición a bacterias y otros patógenos en entornos occidentales. En los Estados Unidos, la mediana de edad en el momento del diagnóstico es de 38 años. Aproximadamente el 20 por ciento de las personas con enfermedad celíaca son diagnosticadas después de los 60 años de edad.
Historia
El término "celíaco" proviene del griego κοιλιακός (koiliakós, "abdominal") y se introdujo en el siglo XIX en una traducción de lo que generalmente se considera una descripción griega antigua de la enfermedad por Areteo de Capadocia.
Los humanos comenzaron a cultivar granos en el Neolítico (a partir del año 9500 a. C.) en el Creciente Fértil de Asia occidental y, probablemente, la enfermedad celíaca no se presentó antes de esta época. Areteo de Capadocia, que vivía en el siglo II en la misma zona, registró un síndrome de malabsorción con diarrea crónica, que provocaba un debilitamiento de todo el cuerpo. Su "afecto celíaco" llamó la atención de la medicina occidental cuando Francis Adams presentó una traducción del trabajo de Aretaeus en la Sydenham Society en 1856. El paciente descrito en Aretaeus' trabajo tenía dolor de estómago y estaba atrofiado, pálido, débil e incapaz de trabajar. La diarrea se manifestaba como heces sueltas que eran blancas, malolientes y flatulentas, y la enfermedad era intratable y propensa a reaparecer periódicamente. El problema, creía Areteo, era la falta de calor en el estómago necesario para digerir la comida y una capacidad reducida para distribuir los productos digestivos por todo el cuerpo, esta digestión incompleta resultaba en diarrea. Consideró esto como una aflicción de los ancianos y que afectaba más comúnmente a las mujeres, excluyendo explícitamente a los niños. La causa, según Areteo, a veces era otra enfermedad crónica o incluso consumir "un copioso trago de agua fría".
El pediatra Samuel Gee dio la primera descripción moderna de la afección en niños en una conferencia en el Hospital for Sick Children, Great Ormond Street, Londres, en 1887. Gee reconoció descripciones y términos anteriores para la enfermedad y adoptó los mismos término como Aretaeus (enfermedad celíaca). Declaró perspicazmente: "Si el paciente puede curarse del todo, debe ser por medio de la dieta". Gee reconoció que la intolerancia a la leche es un problema con los niños celíacos y que se deben evitar los alimentos con alto contenido de almidón. Sin embargo, prohibió el arroz, el sagú, las frutas y las verduras, que habrían sido seguras para comer, y recomendó carne cruda y finas rebanadas de pan tostado. Gee destacó el éxito particular con un niño "que fue alimentado diariamente con un litro de los mejores mejillones holandeses". Sin embargo, el niño no pudo soportar esta dieta por más de una temporada.
Christian Archibald Herter, un médico estadounidense, escribió un libro en 1908 sobre niños con enfermedad celíaca, al que llamó "infantilismo intestinal". Observó que su crecimiento estaba retrasado y que la grasa se toleraba mejor que los carbohidratos. El epónimo enfermedad de Gee-Herter se utilizó a veces para reconocer ambas contribuciones. Sidney V. Haas, un pediatra estadounidense, informó sobre los efectos positivos de una dieta a base de plátanos en 1924. Esta dieta permaneció en boga hasta que se determinó la causa real de la enfermedad celíaca.
Aunque se sospechaba un papel de los carbohidratos, el vínculo con el trigo no se estableció hasta la década de 1940 por el pediatra holandés Dr. Willem Karel Dicke. Es probable que la mejora clínica de sus pacientes durante la hambruna holandesa de 1944 (durante la cual escaseaba la harina) haya contribuido a su descubrimiento. Dicke notó que la escasez de pan condujo a una caída significativa en la tasa de mortalidad entre los niños afectados por la enfermedad celíaca de más del 35 % a prácticamente cero. También informó que una vez que el trigo volvió a estar disponible después del conflicto, la tasa de mortalidad se disparó a los niveles anteriores. El vínculo con el componente de gluten del trigo fue realizado en 1952 por un equipo de Birmingham, Inglaterra. La atrofia de las vellosidades fue descrita por el médico británico John W. Paulley en 1954 en muestras tomadas en una cirugía. Esto allanó el camino para las muestras de biopsia tomadas por endoscopia.
A lo largo de la década de 1960, se dilucidaron otras características de la enfermedad celíaca. Su carácter hereditario fue reconocido en 1965. En 1966, la dermatitis herpetiforme se relacionó con la sensibilidad al gluten.
Social y cultural
Mayo ha sido designado como el "Mes de Concientización sobre la Celíaca" por varias organizaciones de celíacos.
Las iglesias cristianas y la Eucaristía
Hablando en general, las diversas denominaciones de cristianos celebran una Eucaristía en la que se bendice una hostia o un pequeño trozo de pan sacramental de pan de trigo y luego se come. Una oblea típica pesa alrededor de medio gramo. La harina de trigo contiene alrededor del 10 al 13 % gluten, por lo que una sola oblea de comunión puede tener más de 50 mg de gluten, una cantidad que daña a muchas personas celíacas, especialmente si se consume todos los días (ver Dieta más arriba).
Muchas iglesias cristianas ofrecen a sus comulgantes alternativas sin gluten, generalmente en forma de galleta a base de arroz o pan sin gluten. Estos incluyen a los metodistas unidos, los cristianos reformados, los episcopales, la iglesia anglicana (Iglesia de Inglaterra, Reino Unido) y la luterana. Los católicos pueden recibir solo del cáliz o pedir hostias reducidas en gluten; sin embargo, los que no contienen gluten no se consideran pan de trigo y, por lo tanto, no son válidos.
Posición católica romana
La doctrina católica romana establece que para una Eucaristía válida, el pan que se usará en la Misa debe estar hecho de trigo. Las hostias bajas en gluten cumplen con todos los requisitos de la Iglesia Católica, pero no son completamente libres de gluten. Se han denegado las solicitudes para utilizar obleas de arroz.
El tema es más complejo para los sacerdotes. Como celebrante, un sacerdote es, para la plenitud del sacrificio de la Misa, absolutamente requerido para recibir bajo ambas especies. El 24 de julio de 2003, la Congregación para la Doctrina de la Fe declaró: "Dada la centralidad de la celebración de la Eucaristía en la vida de un sacerdote, se debe proceder con gran cautela antes de admitir a las Órdenes Sagradas a aquellos candidatos incapaces de ingerir gluten o alcohol sin daño grave."
Para enero de 2004, las hostias aprobadas por la Iglesia y extremadamente bajas en gluten estaban disponibles en los Estados Unidos, Italia y Australia. A partir de julio de 2017, el Vaticano todavía prohibió el uso de pan sin gluten para la Sagrada Comunión.
Pascua
La fiesta judía de Pesaj (Pascua) puede presentar problemas con su obligación de comer matzá, que es pan sin levadura elaborado de manera estrictamente controlada con trigo, cebada, espelta, avena o centeno. Esto descarta muchos otros cereales que normalmente se utilizan como sustitutos para las personas con sensibilidad al gluten, especialmente para los judíos asquenazíes, que también evitan el arroz. Muchos productos kosher para Pesaj evitan los granos por completo y, por lo tanto, no contienen gluten. La fécula de patata es el almidón principal que se utiliza para reemplazar los cereales.
Ortografía
La enfermedad celíaca es la ortografía preferida en inglés británico, mientras que la enfermedad celíaca se usa normalmente en inglés norteamericano.
Buscar direcciones
La búsqueda de factores ambientales que podrían ser responsables de que las personas genéticamente susceptibles se vuelvan intolerantes al gluten ha resultado en un aumento de la actividad de investigación que analiza las infecciones gastrointestinales. La investigación publicada en abril de 2017 sugiere que una infección a menudo asintomática por una cepa común de reovirus puede aumentar la sensibilidad a alimentos como el gluten.
Se están estudiando varios enfoques de tratamiento, incluidos algunos que reducirían la necesidad de hacer dieta. Todos están todavía en desarrollo y no se espera que estén disponibles para el público en general por un tiempo.
Se han propuesto tres enfoques principales como nuevas modalidades terapéuticas para la enfermedad celíaca: desintoxicación del gluten, modulación de la permeabilidad intestinal y modulación de la respuesta inmunitaria.
El uso de especies de trigo modificadas genéticamente, o especies de trigo que han sido criadas selectivamente para ser mínimamente inmunogénicas, puede permitir el consumo de trigo. Esto, sin embargo, podría interferir con los efectos que tiene la gliadina en la calidad de la masa. Alternativamente, la exposición al gluten se puede minimizar mediante la ingestión de una combinación de enzimas (prolil endopeptidasa y una cisteína endopeptidasa específica de glutamina de cebada (EP-B2)) que degradan el supuesto péptido 33-mer en el duodeno.
Los tratamientos alternativos que se están investigando incluyen la inhibición de la zonulina, una proteína de señalización endógena relacionada con una mayor permeabilidad de la pared intestinal y, por lo tanto, una mayor presentación de gliadina al sistema inmunitario. Un inhibidor de esta vía es el acetato de larazotida, que actualmente está programado para ensayos clínicos de fase 3. Otros modificadores de otros pasos bien conocidos en la patogenia de la enfermedad celíaca, como la acción de HLA-DQ2 o transglutaminasa tisular y la interacción MICA/NKG2D que puede estar involucrada en la destrucción de enterocitos.
La mayoría de los intentos de modular la respuesta inmunitaria relacionada con la enfermedad celíaca aún se encuentran en la fase I de pruebas clínicas; un agente (CCX282-B) ha sido evaluado en un ensayo clínico de fase II basado en biopsias del intestino delgado tomadas de personas con enfermedad celíaca antes y después de la exposición al gluten.
Aunque se usa popularmente como un tratamiento alternativo para las personas con autismo, no hay buena evidencia de que una dieta sin gluten sea beneficiosa en el tratamiento del autismo. En el subgrupo de personas que tienen sensibilidad al gluten, existe evidencia limitada que sugiere que una dieta libre de gluten puede mejorar algunos comportamientos autistas.
Contenido relacionado
Lista de enfermedades (Y)
Cronobiología
Neurofibromatosis