Embolia pulmonar
Embolismo pulmonar (PE) es un bloqueo de una arteria en los pulmones por una sustancia que se ha movido desde otra parte del cuerpo a través del torrente sanguíneo (embolia). Los síntomas de una EP pueden incluir dificultad para respirar, dolor en el pecho, especialmente al inhalar y tos con sangre. Los síntomas de un coágulo de sangre en la pierna también pueden estar presentes, como una pierna roja, caliente, hinchada y adolorida. Los signos de una EP incluyen niveles bajos de oxígeno en la sangre, respiración rápida, frecuencia cardíaca rápida y, a veces, fiebre leve. Los casos graves pueden provocar desmayos, presión arterial anormalmente baja, shock obstructivo y muerte súbita.
La PE generalmente es el resultado de un coágulo de sangre en la pierna que viaja al pulmón. El riesgo de coágulos de sangre aumenta con la edad avanzada, el cáncer, el reposo prolongado en cama y la inmovilización, el tabaquismo, los accidentes cerebrovasculares, los viajes de larga distancia de más de 4 horas, ciertas afecciones genéticas, los medicamentos a base de estrógenos, el embarazo, la obesidad, los traumatismos o las fracturas óseas y después de algunos tipos de cirugía. Una pequeña proporción de los casos se debe a la embolización de aire, grasa o líquido amniótico. El diagnóstico se basa en los signos y síntomas en combinación con los resultados de las pruebas. Si el riesgo es bajo, un análisis de sangre conocido como dímero D puede descartar la afección. De lo contrario, una angiografía pulmonar por TC, una exploración de ventilación/perfusión pulmonar o una ecografía de las piernas pueden confirmar el diagnóstico. En conjunto, la trombosis venosa profunda y la EP se conocen como tromboembolismo venoso (TEV).
Los esfuerzos para prevenir la embolia pulmonar incluyen comenzar a moverse lo antes posible después de la cirugía, ejercicios de la parte inferior de las piernas durante los períodos en que se está sentado y el uso de anticoagulantes después de algunos tipos de cirugía. El tratamiento es con anticoagulantes como heparina, warfarina o uno de los anticoagulantes orales de acción directa (DOAC). Estos se recomiendan durante al menos tres meses. Los casos graves pueden requerir trombólisis con medicamentos como el activador tisular del plasminógeno (tPA) administrado por vía intravenosa o a través de un catéter, y algunos pueden requerir cirugía (trombectomía pulmonar). Si los anticoagulantes no son apropiados, se puede usar un filtro de vena cava temporal.
Las embolias pulmonares afectan a unas 430.000 personas cada año en Europa. En los Estados Unidos ocurren entre 300.000 y 600.000 casos cada año, que contribuyen a por lo menos 40.000 muertes. Las tasas son similares en hombres y mujeres. Se vuelven más comunes a medida que las personas envejecen.
Signos y síntomas
Los síntomas de la embolia pulmonar suelen tener un inicio repentino y pueden incluir uno o varios de los siguientes: disnea (dificultad para respirar), taquipnea (respiración acelerada), dolor torácico de tipo "pleurítico" naturaleza (empeorada por la respiración), tos y hemoptisis (tos con sangre). Los casos más graves pueden incluir signos como cianosis (decoloración azul, generalmente de los labios y los dedos), colapso e inestabilidad circulatoria debido a la disminución del flujo sanguíneo a través de los pulmones y hacia el lado izquierdo del corazón. Alrededor del 15% de todos los casos de muerte súbita son atribuibles a la EP. Si bien la EP puede presentarse con síncope, menos del 1 % de los casos de síncope se deben a la EP.
En el examen físico, los pulmones suelen ser normales. Ocasionalmente, puede escucharse un roce pleural sobre el área afectada del pulmón (principalmente en TEP con infarto). A veces se presenta un derrame pleural que es exudativo, detectable por la disminución de la nota de percusión, los sonidos respiratorios audibles y la resonancia vocal. La tensión en el ventrículo derecho puede detectarse como un tirón paraesternal izquierdo, un componente pulmonar fuerte del segundo ruido cardíaco y/o presión venosa yugular elevada. Puede haber febrícula, sobre todo si hay hemorragia pulmonar o infarto asociados.
Como los émbolos pulmonares más pequeños tienden a alojarse en áreas más periféricas sin circulación colateral, es más probable que causen infarto de pulmón y pequeños derrames (ambos dolorosos), pero no hipoxia, disnea o inestabilidad hemodinámica como taquicardia. Los EP más grandes, que tienden a alojarse en el centro, generalmente causan disnea, hipoxia, presión arterial baja, frecuencia cardíaca rápida y desmayos, pero a menudo son indoloros porque no hay infarto de pulmón debido a la circulación colateral. La presentación clásica de la EP con dolor pleurítico, disnea y taquicardia probablemente se deba a una embolia grande fragmentada que causa EP tanto grandes como pequeñas. Por lo tanto, los EP pequeños a menudo se pasan por alto porque causan dolor pleurítico solo sin ningún otro hallazgo y los EP grandes a menudo se pasan por alto porque son indoloros e imitan otras afecciones que a menudo causan cambios en el ECG y pequeños aumentos en los niveles de troponina y péptido natriurético cerebral.
Los EP a veces se describen como masivos, submasivos y no masivos según los signos y síntomas clínicos. Aunque las definiciones exactas de estos no están claras, una definición aceptada de EP masiva es aquella en la que hay inestabilidad hemodinámica. Esta es una causa de shock obstructivo, que se presenta como presión arterial baja sostenida, frecuencia cardíaca más lenta o falta de pulso.
Factores de riesgo
Alrededor del 90 % de los émbolos provienen de una trombosis venosa profunda ubicada por encima de la rodilla denominada TVP proximal, que incluye una TVP iliofemoral. El raro síndrome de salida torácica venosa también puede ser una causa de TVP, especialmente en hombres jóvenes sin factores de riesgo significativos. Las TVP corren el riesgo de desprenderse y migrar a la circulación pulmonar. Las condiciones generalmente se consideran como un continuo conocido como tromboembolismo venoso (TEV).
El TEV es mucho más común en personas inmunocomprometidas, así como en personas con comorbilidades que incluyen:
- Aquellos que sufren cirugía ortopédica en o debajo de la cadera sin profilaxis.
- Esto se debe a la inmovilidad durante o después de la cirugía, así como al daño venoso durante la cirugía.
- Pacientes de cáncer de páncreas y colones (otros tipos de cáncer también pueden ser factores, pero estos son los más comunes)
- Esto se debe a la liberación de los procoagulantes.
- El riesgo de VTE es mayor durante el diagnóstico y el tratamiento, pero disminuye en la remisión.
- Esto se debe a la liberación de los procoagulantes.
- Pacientes con tumores de grado alto
- Personas embarazadas
- Como el cuerpo se pone en lo que se conoce como un "Estado hipercoagulable" el riesgo de una hemorragia durante el parto se disminuye y se regula por una mayor expresión de los factores VII, VIII, X, Von Willebrand y fibrinógeno.
- Aquellos en medicamentos de estrógeno
Clásicamente, el desarrollo de la trombosis se debe a un grupo de causas denominadas tríada de Virchow (alteraciones en el flujo sanguíneo, factores en la pared del vaso y factores que afectan las propiedades de la sangre). A menudo, más de un factor de riesgo está presente.
- Alteraciones en flujo sanguíneo: inmovilización (después de cirugía, vuelo de larga duración), lesión, embarazo (también procoagulante), obesidad (también procoagulante), cáncer (también procoagulante)
- Factores en la pared del vaso: cirugía, cateterizaciones que causan lesión directa (" lesión endotelial")
- Factores que afectan las propiedades de la sangre (Estado procoagulante):
- Medicamento que contiene estrógeno (terapia hormonal transgénero, terapia hormonal menopausal y anticonceptivos hormonales)
- Trombofilia genética (factor V Leiden, mutación protrombina G20210A, proteína Deficiencia C, deficiencia de proteína S, deficiencia de antitrombino, hiperhomocisteinemia y trastornos de plasminogen/fibrinolisis)
- Trombofilia adquirida (síndrome de antifosfolípido, síndrome nefrótico, hemoglobinuria nocturna paroxismal)
- Cáncer (debido a la secreción de pro-coagulantes)
Aunque la mayoría de las embolias pulmonares son el resultado de TVP proximales, aún existen muchos otros factores de riesgo que también pueden provocar una embolia pulmonar.
- Los factores de riesgo son:
- Varicosas causadas por daño vascular
- Hipertensión pulmonar
- Diabetes
- Fracturas traumáticas de cadera que inmovilizan al paciente
- Fijación conjunta (principalmente en las piernas)
Causas subyacentes
Después de un primer EP, la búsqueda de causas secundarias suele ser breve. Solo cuando ocurre una segunda EP, y especialmente cuando esto sucede mientras aún se encuentra bajo tratamiento anticoagulante, se emprende una búsqueda adicional de condiciones subyacentes. Esto incluirá pruebas ("detección de trombofilia") para la mutación del factor V Leiden, anticuerpos antifosfolípidos, proteína C y S y niveles de antitrombina, y más tarde mutación de protrombina, mutación MTHFR, concentración de factor VIII y anormalidades de coagulación hereditarias más raras.
Diagnóstico
Para diagnosticar una embolia pulmonar, se recomienda una revisión de los criterios clínicos para determinar la necesidad de realizar pruebas. En aquellos que tienen bajo riesgo, edad menor de 50 años, frecuencia cardíaca inferior a 100 latidos por minuto, nivel de oxígeno superior al 94 % con aire ambiente y sin hinchazón de piernas, tos con sangre, cirugía o traumatismo en las últimas cuatro semanas, coágulos de sangre previos o uso de estrógenos, por lo general no se necesitan más pruebas.
En situaciones con más personas de alto riesgo, se necesitan más pruebas. Un angiograma pulmonar por TC (CTPA) es el método preferido para el diagnóstico de una embolia pulmonar debido a su fácil administración y precisión. Aunque se prefiere una CTPA, también se pueden realizar otras pruebas. Por ejemplo, se puede utilizar una ecografía de compresión del miembro inferior proximal (CUS). Esta es una prueba que se utiliza principalmente como prueba de confirmación, lo que significa que confirma un análisis previo que muestra la presencia o sospecha de presencia de una embolia pulmonar. Según un estudio transversal, las pruebas CUS tienen una sensibilidad del 41% y una especificidad del 96%.
Si hay dudas, a continuación se realizan pruebas para determinar la probabilidad de poder confirmar un diagnóstico mediante imágenes, seguidas de imágenes si otras pruebas han demostrado que existe la probabilidad de un diagnóstico de EP.
El diagnóstico de EP se basa principalmente en criterios clínicos validados combinados con pruebas selectivas porque la presentación clínica típica (dificultad para respirar, dolor en el pecho) no se puede diferenciar definitivamente de otras causas de dolor en el pecho y dificultad para respirar. La decisión de realizar imágenes médicas se basa en el razonamiento clínico, es decir, la historia clínica, los síntomas y los hallazgos del examen físico, seguidos de una evaluación de la probabilidad clínica.
Pruebas de probabilidad
El método más utilizado para predecir la probabilidad clínica, la puntuación de Wells, es una regla de predicción clínica, cuyo uso se complica debido a la disponibilidad de múltiples versiones. En 1995, Philip Steven Wells desarrolló inicialmente una regla de predicción (basada en una búsqueda bibliográfica) para predecir la probabilidad de TVP, basándose en criterios clínicos. En 1998 se creó una nueva puntuación de predicción para EP Esta regla de predicción fue revisada por Wells et al. en 2000. En la publicación de 2000, Wells propuso dos sistemas de puntuación diferentes utilizando puntos de corte de 2 o 4 con la misma regla de predicción, y también incluyó la prueba del dímero D en el descarte de TEP en pacientes de baja probabilidad. En 2001, Wells publicó los resultados utilizando el límite más conservador de 2 para crear tres categorías. Se propuso una versión adicional, la "versión extendida modificada", que utiliza el corte más reciente de 2 pero incluye los hallazgos de los estudios iniciales de Wells. Más recientemente, otro estudio volvió al uso anterior de Wells de un límite de 4 puntos para crear solo dos categorías.
Existen reglas de predicción adicionales para PE, como la regla de Ginebra. Más importante aún, el uso de cualquier regla se asocia con una reducción del tromboembolismo recurrente.
La puntuación de Wells:
- sospecha clínicamente DVT – 3.0 puntos
- el diagnóstico alternativo es menos probable que PE – 3.0 puntos
- taquicardia (valor de corazón) – 1,5 puntos
- inmovilización (≥ 3d)/cirugía en cuatro semanas anteriores – 1,5 puntos
- historia de DVT o PE – 1,5 puntos
- hemoptysis – 1.0 puntos
- Malignidad (con tratamiento dentro de seis meses) o paliativo – 1.0 puntos
Interpretación tradicional
- Puntuación √6.0 – Alta (probabilidad 59% basada en datos agrupados)
- Puntuación 2.0 a 6.0 – Moderado (probabilidad 29% basado en datos combinados)
- Puntuación 0 – Bajo (probabilidad 15% basado en datos agrupados)
Interpretación alternativa
- Partituras 4 – PE probable. Considere la imagen diagnóstica.
- Puntuación 4 o menos – PE poco probable. Considere D-dimer para descartar PE.
Los investigadores del PIOPED publicaron recomendaciones para un algoritmo de diagnóstico; sin embargo, estas recomendaciones no reflejan la investigación que utiliza MDCT de 64 cortes. Estos investigadores recomendaron:
- Baja probabilidad clínica. Si D-dimer negativo, PE está excluido. Si el D-dimer positivo, obtener MDCT y tratamiento base en los resultados.
- Probabilidad clínica moderada. Si D-dimer negativo, PE está excluido. Sin embargo, a los autores no les preocupaba que un MDCT negativo con D-dimer negativo en este entorno tenga una probabilidad del 5% de ser falso. Presumiblemente, la tasa de error del 5% caerá como 64 rebanadas MDCT es más comúnmente utilizada. Si el D-dimer positivo, obtener MDCT y tratamiento base en los resultados.
- Alta probabilidad clínica. Procedido a MDCT. Si es positivo, tratar, si es negativo, se necesitan más pruebas para excluir PE. Un D-dimer de menos de 750 ug/L no descarta PE en aquellos que están en alto riesgo.
Criterios de descarte de embolia pulmonar
Los criterios para descartar la embolia pulmonar (PERC, por sus siglas en inglés) ayudan a evaluar a las personas en las que se sospecha una embolia pulmonar, pero es poco probable. A diferencia de la puntuación de Wells y la puntuación de Ginebra, que son reglas de predicción clínica destinadas a estratificar el riesgo de personas con sospecha de EP, la regla PERC está diseñada para descartar el riesgo de EP en personas cuando el médico ya las ha estratificado en una categoría de bajo riesgo.
Las personas en esta categoría de bajo riesgo sin ninguno de estos criterios no pueden someterse a más pruebas para EP: saturaciones bajas de oxígeno: SaO2 <95 %, hinchazón unilateral de la pierna, tos con sangre, TVP o EP anteriores, cirugía o traumatismo reciente, edad >50, uso de hormonas, frecuencia cardíaca rápida. La razón detrás de esta decisión es que las pruebas adicionales (específicamente, la angiografía por TC del tórax) pueden causar más daño (debido a la exposición a la radiación y al medio de contraste) que el riesgo de EP. La regla PERC tiene una sensibilidad del 97,4 % y una especificidad del 21,9 % con una tasa de falsos negativos del 1,0 % (16/1666).
Análisis de sangre
En personas con una sospecha baja o moderada de TEP, un nivel normal de dímero D (que se muestra en un análisis de sangre) es suficiente para excluir la posibilidad de TEP trombótica, con un riesgo de eventos tromboembólicos a los tres meses del 0,14 %. El dímero D es altamente sensible pero no específico (especificidad alrededor del 50%). En otras palabras, un dímero D positivo no es sinónimo de PE, pero un dímero D negativo es, con un buen grado de certeza, una indicación de ausencia de PE. Una baja probabilidad previa a la prueba también es valiosa para descartar EP. El límite típico es de 500 μg/L, aunque esto varía según el ensayo. Sin embargo, en las personas mayores de 50 años, se recomienda cambiar el valor de corte a la edad de la persona multiplicada por 10 μg/L (teniendo en cuenta el análisis que se ha utilizado), ya que disminuye la cantidad de pruebas falsamente positivas. sin perder ningún caso adicional de EP.
Cuando se sospecha una EP, se realizan varios análisis de sangre para excluir causas secundarias importantes de la EP. Esto incluye un conteo sanguíneo completo, estado de coagulación (PT, aPTT, TT) y algunas pruebas de detección (tasa de sedimentación de eritrocitos, función renal, enzimas hepáticas, electrolitos). Si uno de estos es anormal, es posible que se justifiquen más investigaciones sobre el problema.
Los niveles de troponina aumentan entre un 16 y un 47 % con la embolia pulmonar.
Imágenes
En las personas típicas que no se sabe que tienen un alto riesgo de PE, las imágenes son útiles para confirmar o excluir un diagnóstico de PE después de usar pruebas de primera línea más simples. Las sociedades médicas recomiendan pruebas como el dímero D para proporcionar primero evidencia que respalde la necesidad de imágenes, y las imágenes se realizarían si otras pruebas confirmaran una probabilidad moderada o alta de encontrar evidencia para respaldar un diagnóstico de EP.
La angiografía pulmonar por TC es la prueba de diagnóstico por imágenes de primera línea recomendada en la mayoría de las personas.
La ecografía de las piernas puede confirmar la presencia de una EP pero no puede descartarla.
Angiografía pulmonar por TC
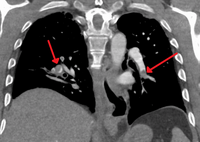
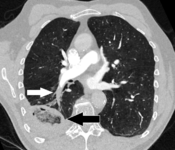
La angiografía pulmonar por TC (CTPA, por sus siglas en inglés) es un angiograma pulmonar obtenido mediante una tomografía computarizada (TC, por sus siglas en inglés) con radiocontraste en lugar de un cateterismo del corazón derecho. Sus ventajas son que es preciso, no es invasivo, está disponible con mayor frecuencia y puede identificar otros trastornos pulmonares en caso de que no haya una embolia pulmonar. La precisión y la naturaleza no invasiva de la CTPA también la hacen ventajosa para las personas embarazadas.
La evaluación de la precisión de la angiografía pulmonar por TC se ve obstaculizada por los rápidos cambios en el número de filas de detectores disponibles en las máquinas de TC multidetector (MDCT). Según un estudio de cohortes, la TC espiral de un solo corte puede ayudar a diagnosticar la detección entre personas con sospecha de embolia pulmonar. En este estudio, la sensibilidad fue del 69% y la especificidad del 84%. En este estudio el que tuvo una prevalencia de detección fue del 32%, el valor predictivo positivo del 67,0% y el valor predictivo negativo del 85,2%. Sin embargo, los resultados de este estudio pueden estar sesgados debido a un posible sesgo de incorporación, ya que la tomografía computarizada fue la herramienta de diagnóstico final en personas con embolia pulmonar. Los autores señalaron que una tomografía computarizada de corte único negativa es insuficiente para descartar una embolia pulmonar por sí sola. Un estudio separado con una combinación de escáneres de 4 y 16 cortes informó una sensibilidad del 83 % y una especificidad del 96 %, lo que significa que es una buena prueba para descartar una embolia pulmonar si no se ve en las imágenes y que es muy bueno para confirmar la presencia de una embolia pulmonar si se ve. Este estudio señaló que se necesitan pruebas adicionales cuando la probabilidad clínica no es consistente con los resultados de las imágenes. CTPA no es inferior a la exploración VQ e identifica más émbolos (sin mejorar necesariamente el resultado) en comparación con la exploración VQ.
Exploración de ventilación/perfusión

(A) Después de la inhalación de 20 mCi de gas Xenon-133, se obtuvieron imágenes cintigráficas en la proyección posterior, mostrando ventilación uniforme a los pulmones.
(B) Después de la inyección intravenosa de 4 mCi de la albúmina de Technetium-99m, se muestran imágenes cintigráficas aquí en la proyección posterior. Esta y otras opiniones mostraron una disminución de la actividad en múltiples regiones.
Una exploración de ventilación/perfusión (o exploración V/Q o gammagrafía pulmonar) muestra que algunas áreas del pulmón están siendo ventiladas pero no perfundidas con sangre (debido a la obstrucción por un coágulo). Este tipo de examen es tan preciso como la TC multicorte, pero se usa menos debido a la mayor disponibilidad de la tecnología de TC. Es particularmente útil en personas que tienen alergia al contraste yodado, insuficiencia renal o están embarazadas (debido a su menor exposición a la radiación en comparación con la TC). La prueba se puede realizar con imágenes bidimensionales planas o tomografía computarizada por emisión de fotón único (SPECT) que permite obtener imágenes tridimensionales. Los dispositivos híbridos que combinan SPECT y CT (SPECT/CT) permiten aún más la caracterización anatómica de cualquier anomalía.
Pruebas diagnósticas de baja probabilidad/pruebas no diagnósticas
Exámenes que se realizan con frecuencia y que no son sensibles para EP, pero pueden ser diagnósticos.
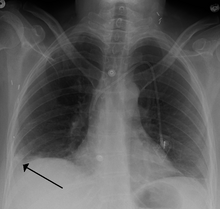
- Las radiografías de tórax se hacen a menudo en personas con falta de aliento para ayudar a descartar otras causas, como insuficiencia cardíaca congestiva y fractura de costilla. Las radiografías de tórax en PE son raramente normales, pero generalmente carecen de signos que sugieren el diagnóstico de PE (por ejemplo, signo de Westermark, hump de Hampton).
- Ultrasonografía de las piernas, también conocida como doppler de la pierna, en busca de trombosis venosa profunda (DVT). La presencia de DVT, como se muestra en la ultrasonografía de las piernas, es en sí misma suficiente para justificar la anticoagulación, sin requerir el V/Q o TC espiral (por la fuerte asociación entre DVT y PE). This may be a valid approach in pregnancy, in which the other modalities would increase the risk of birth defects in the unborn child. Sin embargo, un escaneo negativo no descarta el PE, y la dosis de baja radiación puede ser necesaria si se considera que la madre tiene un alto riesgo de tener una embolia pulmonar. El uso principal de la ultrasonografía de las piernas es por lo tanto en aquellos con síntomas clínicos sugestivos de trombosis venosa profunda.
Angiografía pulmonar fluoroscópica
Históricamente, el estándar de oro para el diagnóstico era la angiografía pulmonar por fluoroscopia, pero ha caído en desuso con la mayor disponibilidad de técnicas no invasivas que ofrecen una precisión diagnóstica similar.
Electrocardiograma
El uso principal del ECG es descartar otras causas de dolor torácico. Un electrocardiograma (ECG) se realiza de forma rutinaria en personas con dolor en el pecho para diagnosticar rápidamente infartos de miocardio (ataques cardíacos), un diagnóstico diferencial importante en una persona con dolor en el pecho. Si bien pueden ocurrir ciertos cambios en el ECG con la EP, ninguno es lo suficientemente específico para confirmar o lo suficientemente sensible para descartar el diagnóstico. Un ECG puede mostrar signos de tensión cardíaca derecha o cor pulmonale agudo en casos de EP grandes; los signos clásicos son una onda S grande en la derivación I, una onda Q grande en la derivación III y una onda T invertida en la derivación III (S1Q3T3), que ocurre en el 12-50 % de las personas con el diagnóstico, pero también ocurre en el 12 % sin el diagnóstico.
Esto está presente ocasionalmente (ocurre en hasta el 20 % de las personas), pero también puede ocurrir en otras afecciones pulmonares agudas y, por lo tanto, tiene un valor diagnóstico limitado. Los signos más frecuentes en el ECG son taquicardia sinusal, desviación del eje a la derecha y bloqueo de rama derecha. Sin embargo, la taquicardia sinusal solo se encuentra en el 8-69 % de las personas con EP.
Los hallazgos del ECG asociados con la embolia pulmonar pueden sugerir un peor pronóstico ya que los seis hallazgos identificados con tensión del VD en el ECG (frecuencia cardíaca > 100 latidos por minuto, S1Q3T3, ondas T invertidas en las derivaciones V1-V4, elevación del ST en aVR, completa bloqueo de rama derecha del haz de His y fibrilación auricular) se asocian con un mayor riesgo de shock circulatorio y muerte.
Los casos con T invertida en las derivaciones V1-3 se sospechan de TEP o infarto de miocardio inferior. Los casos de EP muestran ondas T invertidas en las derivaciones II y aVF, pero los casos de infarto de miocardio inferior no muestran ondas T invertidas en II y aVF.
Ecocardiografía
En la EP masiva y submasiva, la disfunción del lado derecho del corazón puede verse en la ecocardiografía, una indicación de que la arteria pulmonar está gravemente obstruida y el ventrículo derecho, una bomba de baja presión, no puede igualar la presión. Algunos estudios (ver más abajo) sugieren que este hallazgo puede ser una indicación para la trombólisis. No todas las personas con (sospecha de) embolia pulmonar requieren un ecocardiograma, pero las elevaciones de las troponinas cardíacas o del péptido natriurético cerebral pueden indicar tensión cardíaca y justificar un ecocardiograma, y ser importantes en el pronóstico.
La apariencia específica del ventrículo derecho en la ecocardiografía se denomina signo de McConnell. Este es el hallazgo de acinesia de la pared media libre pero un movimiento normal del vértice. Este fenómeno tiene una sensibilidad del 77% y una especificidad del 94% para el diagnóstico de embolia pulmonar aguda en el contexto de disfunción ventricular derecha.

Ultrasonido del corazón mostrando signos de PE
Ultrasonido del corazón mostrando signos de PE
Prevención
La embolia pulmonar puede prevenirse en personas con factores de riesgo. Las personas ingresadas en el hospital pueden recibir medicación preventiva, incluida heparina no fraccionada, heparina de bajo peso molecular (HBPM) o fondaparinux, y medias antitrombosis para reducir el riesgo de una TVP en la pierna que podría desprenderse y migrar a los pulmones.
Después de completar la anticoagulación en aquellos con EP anterior, la aspirina a largo plazo es útil para prevenir la recurrencia.
Tratamiento
La terapia anticoagulante es el pilar del tratamiento. Es posible que se requieran tratamientos de apoyo agudos, como oxígeno o analgesia. Las personas a menudo ingresan en el hospital en las primeras etapas del tratamiento y tienden a permanecer hospitalizadas hasta que el INR alcanza niveles terapéuticos (si se usa warfarina). Sin embargo, cada vez más, los casos de bajo riesgo se manejan en el hogar de una manera que ya es común en el tratamiento de la TVP. La evidencia para apoyar un enfoque versus el otro es débil.
Anticoagulación
La terapia anticoagulante es el pilar del tratamiento. Durante muchos años, los antagonistas de la vitamina K (warfarina o, con menos frecuencia, acenocumarol o fenprocumon) han sido la piedra angular. Como los antagonistas de la vitamina K no actúan de inmediato, el tratamiento inicial es con anticoagulantes inyectables de acción rápida: heparina no fraccionada (HNF), heparina de bajo peso molecular (HBPM) o fondaparinux, mientras que los antagonistas de la vitamina K orales se inician y ajustan la dosis (normalmente como parte del tratamiento hospitalario). atención hospitalaria) a la razón internacional normalizada, prueba que determina la dosis. En términos de tratamientos inyectables, la HBPM puede reducir el sangrado entre las personas con embolia pulmonar en comparación con la HNF. Según la misma revisión, la HBPM redujo la incidencia de complicaciones trombóticas recurrentes y redujo el tamaño del trombo en comparación con la heparina. No hubo diferencia en la mortalidad general entre los participantes tratados con HBPM y los tratados con heparina no fraccionada. Los antagonistas de la vitamina K requieren un ajuste frecuente de la dosis y el control de la razón normalizada internacional (INR). En PE, los INR entre 2,0 y 3,0 generalmente se consideran ideales. Si ocurre otro episodio de EP bajo el tratamiento con warfarina, la ventana de INR se puede aumentar a, p. 2.5–3.5 (a menos que haya contraindicaciones) o la anticoagulación puede cambiarse a un anticoagulante diferente, p. HBPM.
En los últimos años, se han introducido muchos anticoagulantes que ofrecen una oferta similar a la warfarina pero sin necesidad de titulación al INR. Conocidos como los anticoagulantes orales de acción directa, estos tratamientos ahora se prefieren a los antagonistas de la vitamina K según las pautas profesionales estadounidenses. Dos de ellos (rivaroxabán y apixabán) no requieren tratamiento inicial con heparina o fondaparinux, mientras que dabigatrán y edoxabán sí. Una revisión Cochrane encontró que no hay evidencia de una diferencia entre los DTI orales (dabigatrán, rivaroxabán, edoxabán, apixabán) y la anticoagulación estándar en la prevención de la embolia pulmonar recurrente.
En las personas con cáncer que desarrollan embolia pulmonar, se prefiere la terapia con un ciclo de HBPM a la warfarina u otros anticoagulantes orales. De manera similar, las mujeres embarazadas reciben tratamiento con heparina de bajo peso molecular hasta después del parto para evitar los efectos teratogénicos conocidos de la warfarina, especialmente en las primeras etapas del embarazo, pero se puede usar durante la lactancia.
La terapia anticoagulante generalmente se continúa durante 3 a 6 meses, o "de por vida" si ha habido TVP o embolia pulmonar previas, o no está presente ninguno de los factores de riesgo transitorios habituales. En aquellos sin una causa conocida que pueda revertirse, 2 años de tratamiento pueden ser mejores que 6 meses. Para aquellos con EP pequeñas (conocidas como EP subsegmentarias), se desconocen los efectos de la anticoagulación, ya que no se ha estudiado adecuadamente a partir de 2020.
Trombólisis
EP masiva que causa inestabilidad hemodinámica (choque y/o presión arterial baja, definida como una presión arterial sistólica <90 mmHg o una caída de presión de 40 mmHg durante >15 min si no es causada por arritmia de nueva aparición, hipovolemia o sepsis) es una indicación para la trombólisis, la destrucción enzimática del coágulo con medicación. En esta situación, es el mejor tratamiento disponible en aquellos sin contraindicaciones y está avalado por guías clínicas. También se recomienda en aquellos en paro cardíaco con EP conocido. La trombólisis dirigida por catéter (CDT) es una nueva técnica que se ha encontrado relativamente segura y efectiva para las EP masivas. Esto implica acceder al sistema venoso colocando un catéter en una vena de la ingle y guiándolo a través de las venas mediante el uso de imágenes fluoroscópicas hasta ubicarlo junto a la PE en la circulación pulmonar. El medicamento que disuelve los coágulos de sangre se libera a través del catéter para que su concentración más alta esté directamente al lado del émbolo pulmonar. La CDT es realizada por radiólogos intervencionistas o cirujanos vasculares, y en los centros médicos que ofrecen CDT, se puede ofrecer como tratamiento de primera línea. Se está investigando la trombólisis asistida por ultrasonido basada en catéter.
Todavía se debate el uso de la trombólisis en los EP no masivos. Algunos han descubierto que el tratamiento reduce el riesgo de muerte y aumenta el riesgo de hemorragia, incluida la hemorragia intracraneal. Otros no han encontrado disminución en el riesgo de muerte.
Filtro de vena cava inferior
Hay dos situaciones en las que se considera ventajoso un filtro de vena cava inferior: si la terapia anticoagulante está contraindicada (p. ej., poco después de una operación importante) o si una persona tiene una embolia pulmonar a pesar de estar anticoagulada. En estos casos, se puede implantar para evitar que las TVP nuevas o existentes entren en la arteria pulmonar y se combinen con una obstrucción existente. A pesar de la ventaja teórica del dispositivo de prevenir la embolia pulmonar, faltan pruebas que respalden su eficacia.
Los filtros de la vena cava inferior deben retirarse tan pronto como sea seguro comenzar a usar anticoagulantes. Aunque los filtros modernos están destinados a ser recuperables, las complicaciones pueden impedir que se eliminen algunos. Se desconoce el perfil de seguridad a largo plazo de dejar permanentemente un filtro dentro del cuerpo.
Cirugía
El tratamiento quirúrgico de la embolia pulmonar aguda (trombectomía pulmonar) es poco frecuente y se ha abandonado en gran medida debido a los malos resultados a largo plazo. Sin embargo, recientemente ha tenido un resurgimiento con la revisión de la técnica quirúrgica y se piensa que beneficia a ciertas personas. La embolia pulmonar crónica que conduce a hipertensión pulmonar (conocida como hipertensión tromboembólica crónica) se trata con un procedimiento quirúrgico conocido como tromboendarterectomía pulmonar.
Epidemiología
Hay aproximadamente 10 millones de casos de embolia pulmonar por año. En los Estados Unidos, las embolias pulmonares son la causa principal de al menos 10 000 a 12 000 muertes al año y una causa contribuyente de al menos 30 000 a 40 000 muertes al año. Se desconoce la verdadera incidencia de las embolias pulmonares porque a menudo pasan desapercibidas o no se diagnostican hasta la autopsia. De 1993 a 2012, ha habido un aumento en el número de admisiones en hospitales debido a embolias pulmonares, pasando de 23 casos por cada 100 000 personas a 65 casos por cada 100 000 personas. A pesar de este aumento, ha habido una disminución de la mortalidad durante ese mismo período de tiempo debido a los avances médicos que se han producido.
El tromboembolismo venoso (TEV), un factor de riesgo común, está presente en tasas mucho más altas en las personas mayores de 70 años (tres veces más en comparación con las personas de 45 a 69 años). Esto probablemente se deba a que, en general, hay un nivel más bajo de actividad entre los ancianos, lo que resulta en tasas más altas de inmovilidad y obesidad. TEV tiene una tasa de letalidad grande y en continuo aumento. Esta tasa es aproximadamente del 10 % después de 30 días, del 15 % después de tres meses y hasta del 20 % después de un año. Las embolias pulmonares por sí solas (cuando resultan en hospitalizaciones) tienen una tasa de letalidad de alrededor del 5 % al 10 %, por lo que el TEV puede desempeñar un factor importante en la gravedad de las embolias.
Al observar todos los casos, la tasa de embolia pulmonar mortal ha disminuido del 6 % al 2 % en los últimos 25 años en los Estados Unidos. En Europa, entre 2013 y 2015 se informó un promedio de aproximadamente 40 000 muertes por año con embolia pulmonar como causa principal, una estimación conservadora debido a la posibilidad de infradiagnóstico.
Pronóstico
Menos del 5 al 10 % de los EP sintomáticos son fatales dentro de la primera hora de los síntomas.
Se utilizan varios marcadores para la estratificación del riesgo y estos también son predictores independientes de resultados adversos. Estos incluyen hipotensión, shock cardiogénico, síncope, evidencia de disfunción del corazón derecho y enzimas cardíacas elevadas. Algunos cambios en el ECG, incluido S1Q3T3, también se correlacionan con un peor pronóstico a corto plazo. Ha habido otros factores relacionados con el paciente, como la EPOC y la insuficiencia cardíaca crónica, que también se cree que desempeñan un papel en el pronóstico.
El pronóstico depende de la cantidad de pulmón afectado y de la coexistencia de otras afecciones médicas; la embolización crónica al pulmón puede conducir a hipertensión pulmonar. Después de una EP masiva, el émbolo debe resolverse de alguna manera para que el paciente sobreviva. En la EP trombótica, el coágulo de sangre se puede descomponer mediante fibrinólisis, o se puede organizar y recanalizar para que se forme un nuevo canal a través del coágulo. El flujo sanguíneo se restablece más rápidamente en el primer o segundo día después de una embolia pulmonar. La mejora se ralentiza a partir de entonces y algunos déficits pueden ser permanentes. Existe controversia sobre si las EP subsegmentarias pequeñas necesitan tratamiento y existe cierta evidencia de que los pacientes con EP subsegmentarias pueden evolucionar bien sin tratamiento.
Una vez que se suspende la anticoagulación, el riesgo de una embolia pulmonar mortal es del 0,5 % por año.
Se dijo que la mortalidad por EP no tratada era del 26 %. Esta cifra proviene de un ensayo publicado en 1960 por Barrit y Jordan, que comparaba la anticoagulación con el placebo para el manejo de la EP. Barritt y Jordan realizaron su estudio en el Bristol Royal Infirmary en 1957. Este estudio es el único ensayo controlado con placebo que ha examinado el lugar de los anticoagulantes en el tratamiento de la EP, cuyos resultados fueron tan convincentes que el ensayo nunca se ha repetido. ya que hacerlo sería considerado poco ético. Dicho esto, la tasa de mortalidad informada del 26 % en el grupo de placebo es probablemente una exageración, dado que la tecnología de la época puede haber detectado solo EP graves.
Predicción de la mortalidad
Las herramientas de puntuación PESI y sPESI (= índice de gravedad de la embolia pulmonar simplificada) pueden estimar la mortalidad de los pacientes. Las reglas de predicción de Ginebra y los criterios de Wells se utilizan para calcular una probabilidad previa a la prueba de los pacientes para predecir quién tiene una embolia pulmonar. Estos puntajes son herramientas que se deben usar con criterio clínico para decidir las pruebas de diagnóstico y los tipos de terapia. El algoritmo PESI comprende 11 variables clínicas disponibles de forma rutinaria. Pone a los sujetos en una de cinco clases (I-V), con una mortalidad a los 30 días que oscila entre el 1,1 % y el 24,5 %. Los de las clases I y II son de bajo riesgo y los de las clases III-V son de alto riesgo.
Contenido relacionado
ADN complementario
Carbamazepina
Bacilo turingiensico