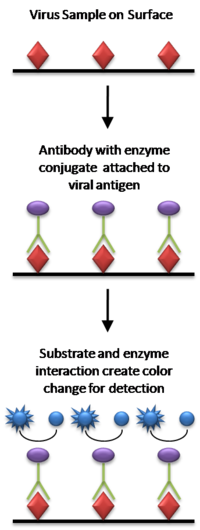
ELISA
El ensayo inmunoabsorbente ligado a enzimas (ELISA) (,) es un ensayo bioquímico analítico de uso común, descrito por primera vez por Eva Engvall y Peter Perlmann en 1971. El ensayo utiliza un tipo de inmunoensayo enzimático (EIA) de fase sólida para detectar la presencia de un ligando (comúnmente una proteína) en una muestra líquida utilizando anticuerpos dirigidos contra la proteína que se va a medir. ELISA se ha utilizado como herramienta de diagnóstico en medicina, patología vegetal y biotecnología, así como también como control de calidad en diversas industrias.
En la forma más simple de ELISA, los antígenos de la muestra que se va a analizar se adhieren a una superficie. Luego, se aplica un anticuerpo coincidente sobre la superficie para que pueda unirse al antígeno. Este anticuerpo se une a una enzima y luego se eliminan los anticuerpos no unidos. En el paso final, se agrega una sustancia que contiene el sustrato de la enzima. Si hubo unión, la reacción posterior produce una señal detectable, más comúnmente un cambio de color.
La realización de un ELISA involucra al menos un anticuerpo con especificidad para un antígeno en particular. La muestra con una cantidad desconocida de antígeno se inmoviliza en un soporte sólido (normalmente una placa de microtitulación de poliestireno) de forma no específica (mediante adsorción en la superficie) o específica (mediante captura por otro anticuerpo específico del mismo antígeno, en un &# 34;ELISA tipo sándwich). Después de inmovilizar el antígeno, se agrega el anticuerpo de detección, formando un complejo con el antígeno. El anticuerpo de detección se puede unir covalentemente a una enzima o se puede detectar por sí mismo mediante un anticuerpo secundario que se une a una enzima mediante bioconjugación. Entre cada paso, la placa generalmente se lava con una solución de detergente suave para eliminar cualquier proteína o anticuerpo que no esté unido específicamente. Después del último paso de lavado, la placa se revela agregando un sustrato enzimático para producir una señal visible que indica la cantidad de antígeno en la muestra.
Cabe destacar que ELISA puede realizar otras formas de ensayos de unión de ligandos en lugar de estrictamente "inmuno" ensayos, aunque el nombre llevaba el original "inmuno" debido al uso común y la historia de desarrollo de este método. La técnica requiere esencialmente cualquier reactivo de ligadura que pueda inmovilizarse en la fase sólida junto con un reactivo de detección que se una específicamente y use una enzima para generar una señal que pueda cuantificarse correctamente. Entre los lavados, solo el ligando y sus contrapartes de unión específica permanecen específicamente unidos o "inmunoabsorbidos" por interacciones antígeno-anticuerpo a la fase sólida, mientras que los componentes no específicos o no unidos se eliminan por lavado. A diferencia de otros formatos de ensayo de laboratorio húmedo espectrofotométrico en los que el mismo pocillo de reacción (p. ej., una cubeta) se puede reutilizar después del lavado, las placas ELISA tienen los productos de reacción inmunoabsorbidos en la fase sólida, que forma parte de la placa, por lo que no se pueden reutilizar fácilmente..
Principio
Como ensayo de bioquímica analítica y "laboratorio húmedo" ELISA implica la detección de un analito (es decir, la sustancia específica cuya presencia se analiza cuantitativa o cualitativamente) en una muestra líquida mediante un método que sigue utilizando reactivos líquidos durante el análisis (es decir, secuencia controlada de reacciones bioquímicas que generarán una señal que se puede cuantificar fácilmente e interpretar como una medida de la cantidad de analito en la muestra) que permanece líquido y permanece dentro de una cámara de reacción o se necesita para mantener los reactivos contenidos. Esto contrasta con el "laboratorio seco" técnicas que utilizan tiras secas. Incluso si la muestra es líquida (p. ej., una pequeña gota medida), el paso de detección final en "seco" el análisis implica la lectura de una tira seca mediante métodos como la reflectometría y no necesita una cámara de contención de reacción para evitar el derrame o la mezcla entre muestras.
Como ensayo heterogéneo, ELISA separa algunos componentes de la mezcla de reacción analítica adsorbiendo ciertos componentes en una fase sólida que está físicamente inmovilizada. En ELISA, una muestra líquida se agrega a una fase sólida estacionaria con propiedades de unión especiales y es seguida por múltiples reactivos líquidos que se agregan, incuban y lavan secuencialmente, seguidos de algún cambio óptico (p. ej., desarrollo de color por el producto de una reacción enzimática). reacción) en el líquido final en el pocillo del que se mide la cantidad del analito. La "lectura" cuantitativa generalmente se basa en la detección de la intensidad de la luz transmitida por espectrofotometría, que implica la cuantificación de la transmisión de alguna longitud de onda de luz específica a través del líquido (así como el fondo transparente del pozo en el formato de placa de múltiples pozos). La sensibilidad de detección depende de la amplificación de la señal durante las reacciones analíticas. Dado que las reacciones enzimáticas son procesos de amplificación muy conocidos, la señal es generada por enzimas que están unidas a los reactivos de detección en proporciones fijas para permitir una cuantificación precisa, y de ahí el nombre "enzima enlazada".
El analito también se denomina ligando porque se unirá o se ligará específicamente a un reactivo de detección, por lo que ELISA pertenece a la categoría más grande de ensayos de unión de ligandos. El reactivo de unión específico del ligando se "inmoviliza," es decir, generalmente recubierto y secado sobre el fondo transparente y, a veces, también sobre la pared lateral de un pozo (la "fase sólida"/"sustrato sólido" estacionaria aquí en oposición a las micropartículas/perlas sólidas que pueden lavarse), que generalmente se construye como una placa de pocillos múltiples conocida como "placa ELISA." Convencionalmente, como otras formas de inmunoensayos, la especificidad de la reacción de tipo antígeno-anticuerpo se usa porque es fácil generar un anticuerpo específicamente contra un antígeno a granel como reactivo. Alternativamente, si el propio analito es un anticuerpo, su antígeno diana se puede utilizar como reactivo de unión.
Historia
Antes del desarrollo de ELISA, la única opción para realizar un inmunoensayo era el radioinmunoensayo, una técnica que utiliza antígenos o anticuerpos marcados radiactivamente. En el radioinmunoensayo, la radiactividad proporciona la señal que indica si un antígeno o anticuerpo específico está presente en la muestra. El radioinmunoensayo se describió por primera vez en un artículo científico de Rosalyn Sussman Yalow y Solomon Berson publicado en 1960.
Como la radiactividad representa una amenaza potencial para la salud, se buscó una alternativa más segura. Una alternativa adecuada al radioinmunoensayo sustituiría a la señal radiactiva por una señal no radiactiva. Cuando las enzimas (como la peroxidasa de rábano picante) reaccionan con sustratos apropiados (como ABTS o TMB), se produce un cambio de color, que se utiliza como señal. Sin embargo, la señal debe estar asociada con la presencia de un anticuerpo o antígeno, por lo que la enzima debe estar unida a un anticuerpo apropiado. Este proceso de vinculación fue desarrollado de forma independiente por Stratis Avrameas y G. B. Pierce. Dado que es necesario eliminar cualquier anticuerpo o antígeno no unido mediante lavado, el anticuerpo o antígeno debe fijarse a la superficie del recipiente; es decir, se debe preparar el inmunoabsorbente. Wide y Jerker Porath publicaron una técnica para lograr esto en 1966.
En 1971, Peter Perlmann y Eva Engvall de la Universidad de Estocolmo en Suecia, y Anton Schuurs y Bauke van Weemen en los Países Bajos publicaron de forma independiente artículos que sintetizaban este conocimiento en métodos para realizar EIA/ELISA.
El ELISA tradicional generalmente involucra indicadores y sustratos cromogénicos que producen algún tipo de cambio de color observable para indicar la presencia de antígeno o analito. Las técnicas más nuevas similares a ELISA utilizan indicadores de PCR fluorogénicos, electroquimioluminiscentes y de oposición cuantitativa para crear señales cuantificables. Estos nuevos reporteros pueden tener varias ventajas, incluidas sensibilidades más altas y multiplexación. En términos técnicos, los ensayos más nuevos de este tipo no son estrictamente ELISA, ya que no están "vinculados a enzimas", sino que están vinculados a algún indicador no enzimático. Sin embargo, dado que los principios generales de estos ensayos son muy similares, a menudo se agrupan en la misma categoría que los ELISA.
En 2012, una prueba ELISA ultrasensible basada en enzimas que usaba nanopartículas como indicador cromogénico pudo dar una señal de color a simple vista, a partir de la detección de meros atogramas de analito. Aparece un color azul para los resultados positivos y un color rojo para los negativos. Tenga en cuenta que esta detección solo puede confirmar la presencia o ausencia de analito, no la concentración real.
Tipos
Hay muchas pruebas ELISA para moléculas particulares que usan los anticuerpos coincidentes. Las pruebas ELISA se dividen en varios tipos de pruebas en función de cómo se unen y utilizan los analitos y los anticuerpos. Los principales tipos se describen aquí.
ELISA directo
Los pasos de ELISA directo siguen el siguiente mecanismo:
- Una solución amortiguada del antígeno para ser probado se añade a cada pozo (generalmente placas de 96 pozos) de una placa microtitular, donde se le da tiempo para adherirse al plástico a través de interacciones de carga.
- Una solución de proteínas no reaccionantes, como la bovina srumbina o caseína, se añade a cada pozo para cubrir cualquier superficie de plástico en el pozo que permanece sin revestimiento por el antígeno.
- Se añade el anticuerpo primario con una enzima adjunta (conjugada), que se une específicamente al antígeno de prueba recubriendo el pozo.
- Luego se añade un sustrato para esta enzima. A menudo, este sustrato cambia de color sobre la reacción con la enzima.
- Cuanto mayor sea la concentración del anticuerpo primario presente en el suero, mayor será el cambio de color. A menudo, un espectrómetro se utiliza para dar valores cuantitativos para la fuerza de color.
La enzima actúa como amplificador; incluso si solo quedan unidos unos pocos anticuerpos ligados a enzimas, las moléculas de enzimas producirán muchas moléculas de señal. Dentro de las limitaciones del sentido común, la enzima puede continuar produciendo color indefinidamente, pero cuanto más anticuerpo se une, más rápido se desarrollará el color. Una desventaja importante del ELISA directo es que el método de inmovilización del antígeno no es específico; cuando se utiliza suero como fuente del antígeno de prueba, todas las proteínas de la muestra pueden adherirse bien a la placa de microtitulación, por lo que las pequeñas concentraciones de analito en el suero deben competir con otras proteínas séricas cuando se unen a la superficie del pocillo. El sándwich o ELISA indirecto proporciona una solución a este problema, mediante el uso de una "captura" anticuerpo específico para el antígeno de prueba para sacarlo de la mezcla molecular del suero.
El ELISA se puede ejecutar en formato cualitativo o cuantitativo. Los resultados cualitativos proporcionan un simple resultado positivo o negativo (sí o no) para una muestra. El límite entre positivo y negativo lo determina el analista y puede ser estadístico. A menudo se utiliza dos o tres veces la desviación estándar (error inherente a una prueba) para distinguir las muestras positivas de las negativas. En ELISA cuantitativo, la densidad óptica (OD) de la muestra se compara con una curva estándar, que suele ser una dilución en serie de una solución de concentración conocida de la molécula objetivo. Por ejemplo, si una muestra de prueba arroja una DO de 1,0, el punto de la curva estándar que dio una DO = 1,0 debe tener la misma concentración de analito que la muestra.
El uso y significado de los nombres "ELISA indirecto" y "ELISA directo" difiere en la literatura y en los sitios web dependiendo del contexto del experimento. Cuando se analiza la presencia de un antígeno, el nombre "ELISA directo" se refiere a un ELISA en el que solo se usa un anticuerpo primario marcado, y el término "ELISA indirecto" se refiere a un ELISA en el que el antígeno se une al anticuerpo primario que luego es detectado por un anticuerpo secundario marcado. En este último caso, un ELISA sándwich es claramente distinto de un ELISA indirecto. Cuando el "primario" el anticuerpo es de interés, p. en el caso de análisis de inmunización, este anticuerpo es detectado directamente por el anticuerpo secundario y el término "ELISA indirecto" se aplica a un entorno con dos anticuerpos.
ELISA sándwich

Un "sándwich" ELISA se utiliza para detectar el antígeno de la muestra. Los pasos son:
- Una superficie está preparada con una cantidad conocida de anticuerpo de captura.
- Cualquier sitio de unión no específico en la superficie está bloqueado.
- La muestra que contiene antígeno se aplica a la placa y se captura por anticuerpo.
- La placa se lava para eliminar el antígeno sin límites.
- Se añade un anticuerpo específico, y se une al antígeno (de ahí el 'sandwich': el antígeno está atrapado entre dos anticuerpos). Este anticuerpo primario podría estar en el suero de un donante, para ser probado para la reactividad hacia el antígeno.
- Los anticuerpos secundarios vinculados a la enzima se aplican como anticuerpos de detección, que se unen específicamente a la región Fc del anticuerpo (no específica).
- La placa se lava para eliminar los conjugados anticuerpo-enzima sin límites.
- Se agrega un químico para ser convertido por la enzima en un color, fluorescente o señal electroquímica.
- La absorción, fluorescencia o señal electroquímica (por ejemplo, corriente) de los pozos de la placa se mide para determinar la presencia y cantidad del antígeno.
La imagen de la derecha incluye el uso de un anticuerpo secundario conjugado con una enzima, aunque, en el sentido técnico, esto no es necesario si el anticuerpo primario está conjugado con una enzima (que sería ELISA directo). Sin embargo, el uso de un conjugado de anticuerpo secundario evita el costoso proceso de crear anticuerpos ligados a enzimas para cada antígeno que se desee detectar. Mediante el uso de un anticuerpo ligado a enzimas que se une a la región Fc de otros anticuerpos, este mismo anticuerpo ligado a enzimas se puede usar en una variedad de situaciones. Sin la primera capa de "captura" anticuerpo, cualquier proteína en la muestra (incluidas las proteínas séricas) puede adsorberse competitivamente en la superficie de la placa, lo que reduce la cantidad de antígeno inmovilizado. El uso del anticuerpo específico purificado para unir el antígeno al plástico elimina la necesidad de purificar el antígeno de mezclas complicadas antes de la medición, lo que simplifica el ensayo y aumenta la especificidad y la sensibilidad del ensayo. Por lo tanto, un ELISA sándwich utilizado para la investigación a menudo necesita validación para reducir el riesgo de resultados falsos positivos.
ELISA competitivo
Un tercer uso de ELISA es a través de la unión competitiva. Los pasos para este ELISA son algo diferentes de los primeros dos ejemplos:
El anticuerpo sin marcar se incuba en presencia de su antígeno (muestra).
- Estos complejos de anticuerpo/antigeno atados se añaden a un pozo antígeno.
- El plato está lavado, así que los anticuerpos no abundan se eliminan. (Más antígeno en la muestra, más complejos Ag-Ab se forman y por lo tanto hay menos anticuerpos sin límites disponibles para unirse al antígeno en el pozo, por lo tanto "competición".)
- Se añade el anticuerpo secundario, específico del anticuerpo primario. Este segundo anticuerpo se une a la enzima.
- Se añade un sustrato, y las enzimas restantes provocan una señal cromogénica o fluorescente.
- La reacción se detiene para evitar la saturación eventual de la señal.
Algunos kits de ELISA de la competencia incluyen antígenos ligados a enzimas en lugar de anticuerpos ligados a enzimas. El antígeno marcado compite por los sitios de unión del anticuerpo primario con el antígeno de muestra (sin marcar). Cuanto menos antígeno hay en la muestra, más antígeno marcado se retiene en el pozo y más fuerte es la señal.
Por lo general, el antígeno no se coloca primero en el pocillo.
Para la detección de anticuerpos contra el VIH, los pocillos de la placa de microtitulación se recubren con el antígeno del VIH. Se utilizan dos anticuerpos específicos, uno conjugado con enzima y otro presente en suero (si el suero es positivo para el anticuerpo). Se produce una competencia acumulativa entre los dos anticuerpos por el mismo antígeno, lo que hace que se vea una señal más fuerte. Los sueros que se analizarán se agregan a estos pocillos, se incuban a 37 °C y luego se lavan. Si hay anticuerpos, se produce la reacción antígeno-anticuerpo. No queda ningún antígeno para los anticuerpos específicos del VIH marcados con enzimas. Estos anticuerpos permanecen libres tras la adición y se eliminan durante el lavado. Se agrega sustrato, pero no hay enzima que actúe sobre él, por lo que un resultado positivo no muestra cambio de color.
ELISA inversa (ELISA indirecta)
Una cuarta prueba ELISA no utiliza los pocillos tradicionales. Esta prueba deja los antígenos suspendidos en el líquido de prueba.
- El anticuerpo sin etiqueta está incubado en presencia de su antígeno (muestra)
- Se proporciona un período suficiente de incubación para permitir que los anticuerpos se unen a los antígenos.
- La muestra se pasa a través del contenedor Scavenger. Esto puede ser un tubo de prueba o un flujo diseñado específicamente a través del canal. La superficie del contenedor o canal de Scavenger tiene “Antígenos de Hambre” ligados a él. Estos pueden ser idénticos o suficientemente similares a los antígenos primarios que los anticuerpos libres se unen.
- El contenedor Scavenger debe tener suficiente superficie y tiempo suficiente para permitir que los antígenos Scavenger se unen a todo el exceso de anticuerpos introducido en la muestra.
- La muestra, que ahora contiene los anticuerpos marcados y ligados, se pasa a través de un detector. Este dispositivo puede ser un citometro de flujo u otro dispositivo que ilumina las etiquetas y registra la respuesta.
Esta prueba permite marcar y contar múltiples antígenos al mismo tiempo. Esto permite identificar cepas específicas de bacterias mediante dos (o más) etiquetas de colores diferentes. Si ambas etiquetas están presentes en una celda, entonces la celda es esa cepa específica. Si solo uno está presente, no lo está.
Esta prueba se realiza, por lo general, una prueba a la vez y no se puede realizar con la placa de microtitulación. El equipo necesario suele ser menos complicado y se puede utilizar en el campo.
Marcadores enzimáticos de uso común
La siguiente tabla enumera los marcadores enzimáticos comúnmente utilizados en los ensayos ELISA, que permiten medir los resultados del ensayo una vez finalizado.
- OPDo-dihidrocloruro defenilendiamina) se convierte en ámbar para detectar HRP (Peroxidasa Horseradish), que a menudo se utiliza como proteína conjugada.
- TMB (3,3',5,5'-tetrametilbenzidina) se vuelve azul al detectar HRP y se vuelve amarillo después de la adición de ácido sulfúrico o fósforo.
- ABTS (2,2'-Azinobis [3-ethylbenzothiazoline-6-sulfonic acid]-diammonium salt) se vuelve verde al detectar HRP.
- PNPPp-Nitrophenyl Phosphate, Disodium Salt) se vuelve amarillo al detectar la fosfatasa alcalina.
Aplicaciones
Debido a que el ELISA se puede realizar para evaluar la presencia de antígenos o la presencia de anticuerpos en una muestra, es una herramienta útil para determinar las concentraciones de anticuerpos séricos (como con la prueba del VIH o el virus del Nilo Occidental). También ha encontrado aplicaciones en la industria alimentaria para detectar posibles alérgenos alimentarios, como leche, maní, nueces, almendras y huevos, y como análisis de sangre serológico para la enfermedad celíaca. ELISA también se puede utilizar en toxicología como una prueba de detección rápida para ciertas clases de fármacos.
El ELISA fue la primera prueba de detección ampliamente utilizada para el VIH debido a su alta sensibilidad. En un ELISA, el suero de una persona se diluye 400 veces y se aplica a una placa a la que se unen los antígenos del VIH. Si los anticuerpos contra el VIH están presentes en el suero, pueden unirse a estos antígenos del VIH. A continuación, se lava la placa para eliminar todos los demás componentes del suero. A continuación, se aplica a la placa un "anticuerpo secundario" especialmente preparado, un anticuerpo que se une a otros anticuerpos, seguido de otro lavado. Este anticuerpo secundario se une químicamente de antemano a una enzima.
Por lo tanto, la placa contendrá enzima en proporción a la cantidad de anticuerpo secundario unido a la placa. Se aplica un sustrato para la enzima y la catálisis de la enzima conduce a un cambio de color o fluorescencia. Los resultados de ELISA se informan como un número; el aspecto más controvertido de esta prueba es determinar el "punto de corte" punto entre un resultado positivo y uno negativo.
Se puede determinar un punto de corte comparándolo con un estándar conocido. Si se utiliza una prueba ELISA para la detección de drogas en el lugar de trabajo, se establece una concentración de corte, por ejemplo, 50 ng/ml, y se preparará una muestra que contenga la concentración estándar de analito. Las incógnitas que generan una señal más fuerte que la muestra conocida son "positivas". Los que generan señal más débil son "negativos".
Existen pruebas ELISA para detectar varios tipos de enfermedades, como el dengue, la malaria, la enfermedad de Chagas, la enfermedad de Johne y otras. Las pruebas ELISA también se emplean ampliamente para diagnósticos in vitro en laboratorios médicos. Los otros usos de ELISA incluyen:
- detección de anticuerpos SARS-CoV-2 en muestras de sangre
Notas y referencias
- ^ Engvall, E (1972-11-22). "Enzima-enlazado inmunosorbent assay, Elisa". The Journal of Immunology. 109 (1): 129–135. doi:10.4049/jimmunol.109.129. ISSN 0022-1767. PMID 4113792.
- ^ a b c Msagati, T.A. (2017). Forenses Alimentarios y Toxicología. John Wiley ' Sons. p. PT229. ISBN 9781119101383.
- ^ a b Crowther, J.R. (1995). "Capítulo 2: Principios básicos del ELISA". ELISA: Teoría y práctica. Métodos en Biología Molecular. Vol. 42. Humana Press. pp. 35–62. doi:10.1385/0-89603-279-5:1. ISBN 0896032795. PMID 7655571.
- ^ Sonntag, O. (1993). "Capítulo 1: Introducción a la química seca". En van der Vliet, P.C. (ed.). Química Seca: Análisis con reactivos con límites de portador. Técnicas de Laboratorio en Bioquímica y Biología Molecular. Vol. 25. pp. 1–6. ISBN 9780080887364.
- ^ Hsieh, Y.-H.P.; Rao, Q. (2017). Nielsen, S.S. (ed.). Análisis de alimentos. Springer. pp. 491–98. ISBN 9783319457765.
- ^ Schasfoort, R.B.M. (2017). Handbook of Surface Plasmon Resonance (2a edición). Royal Society of Chemistry. p. 296. ISBN 9781782627302.
- ^ Elgert, K.D. (2009). Inmunología: Comprender el sistema inmunitario. John Wiley ' Sons. pp. 149–50. ISBN 9780470081570.
- ^ Yalow, Rosalyn S.; Berson, Solomon A. (1960). "Inmunoassay of endogenous plasma insulin in man". The Journal of Clinical Investigation. 39 (7): 1157–75. doi:10.1172/JCI104130. PMC441860. PMID 13846364.
- ^ Lequin, R. M. (2005). "Enzyme Immunoassay (EIA)/Enzyme-Linked Immunosorbent Assay (ELISA)". Química Clínica. 51 (12): 2415–8. doi:10.1373/clinchem.2005.051532. PMID 16179424.
- ^ Wide, Leif; Porath, Jerker (1966). "Radioinmunoassay de proteínas con el uso de anticuerpos de Sephadex". Biochimica et Biophysica Acta (BBA) - General Subjects. 130 (1): 257–60. doi:10.1016/0304-4165(66)90032-8.
- ^ Engvall, Eva; Perlmann, Peter (1971). "Ensayo inmunosorbent relacionado con el enzima (ELISA) ensayo cuantitativo de inmunoglobulina G". Inmunoquímica. 8 (9): 871–4. doi:10.1016/0019-2791(71)90454-X. PMID 5135623.
- ^ Van Weemen, B.K.; Schuurs, A.H.W.M. (1971). "Inmunoassay usando antígeno-enzima conjugados". Cartas FEBS. 15 (3): 232–236. doi:10.1016/0014-5793(71)80319-8. PMID 11945853. S2CID 37147723.
- ^ Leng, S. X.; McElhaney, J. E.; Walston, J. D.; Xie, D.; Fedarko, N. S.; Kuchel, G. A. (2008). "ELISA y Múltiples Tecnologías para la Medición de Citoquinas en Investigación de Inflamación y Envejecimiento". The Journals of Gerontology Series A: Biological Sciences and Medical Sciences. 63 (8): 879–84. doi:10.1093/gerona/63.879. PMC2562869. PMID 18772478.
- ^ Adler, Michael; Schulz, Sven; Spengler, Mark (2009). "Cytokine Quantification in Drug Development: A comparison of sensitive immunoassay platforms". Chimera Biotech.
- ^ de la Rica, Roberto; Stevens, Molly M. (2012). "Plasmonic ELISA para la detección ultrasensible de biomarcadores de enfermedades con el ojo desnudo". Nature Nanotechnology. 7 (12): 821–4. Código:2012NatNa...7..821D. doi:10.1038/nnano.2012.186 hdl:10044/1/21938. PMID 23103935.
- ^ R., Crowther, J. (1995). ELISA: teoría y práctica. Métodos en Biología Molecular. Vol. 42. Totowa, N.J.: Humana Press. pp. 1–218. doi:10.1385/0-89603-279-5:1. ISBN 978-0896032798. OCLC 32130600. PMID 7655571.
- ^ ROBERT., HNASKO (2016). ELISA (SOFTCOVER reprint OF ed.). [Place of publication not identified]: HUMANA. ISBN 978-1493953851. OCLC 960834982.
- ^ "¿Qué es un ELISA?". R.D Systems. Retrieved 31 de enero 2020.
- ^ Spence, Zachary (2018-10-18). "Biochemistry 8th ed - Jeremy M. Berg": 83.
{{cite journal}}: Cite journal requires|journal=(Ayuda) - ^ Schmidt, SD; Mazzella, MJ; Nixon, RA; Mathews, PM (2012). Medición de Aβ por ensayo inmunosorbeno relacionado con enzimas. Métodos en Biología Molecular. Vol. 849. pp. 507–27. doi:10.1007/978-1-61779-551-0_34. ISBN 978-1-61779-550-3. PMID 22528112.
- ^ Kragstrup, Tue W; Vorup-Jensen, Thomas; Deleuran, Bent; Hvid, Malene (2013). "Un simple conjunto de pasos de validación identifica y elimina falsos resultados en un ensayo inmunosorbeno relacionado con la enzima sándwich causado por anticuerpos antianimales de IgG en plasma de pacientes de artritis". SpringerPlus. 2 (1): 263. doi:10.1186/2193-1801-2-263. PMC3695686. PMID 23875127.
- ^ US 7767404, Charbonnet, Derrick, "Apparatus y método para el ensayo inmunosorbente de un solo paso para analitos individuales y múltiples", publicado el 3 de agosto de 2010
- ^ US 8735142, Charbonnet, Derrick & Evans, Norman Scott, "Systems and methods for immunosorbent assays for single and multiple analytes", publicado el 27 de mayo de 2014
- ^ Mahmoudi Gomari, Mohammad; Saraygord-Afshari, Neda; Farsimadan, Marziye; Rostami, Neda; Aghamiri, Shahin; Farajollahi, Mohammad M. (diciembre 2020). "Oportunidades y desafíos de las técnicas de purificación de proteínas asistidas por etiquetas: Aplicaciones en la industria farmacéutica". Avances en biotecnología. 45: 107653. doi:10.1016/j.biotechadv.2020.107653. ISSN 0734-9750. PMID 33157154. S2CID 226276355.
- ^ a b c d "Sustratos enzimáticos para ELISA". Thermo Fisher Scientific - US. Retrieved 2018-06-06.
- ^ MedlinePlus enciclopedia: ELISA / pruebas de trama occidental para el VIH
- ^ "Food Allergen Partnership" (Press release). FDA. Enero de 2001. Retrieved 20 de agosto, 2015.
- ^ Sblattero, D.; Berti, I.; Trevisiol, C.; Marzari, R.; Tommasini, A.; Bradbury, A.; Fasano, A.; Ventura, A.; No, T. (2000). "El tejido recombinante humano transglutaminase ELISA: un ensayo diagnóstico innovador para la enfermedad celíaca". El American Journal of Gastroenterology. 95 (5): 1253–7. doi:10.1111/j.1572-0241.2000.02018.x. PMID 10811336. S2CID 11018740.
- ^ Porcelli, Brunetta; Ferretti, Fabio; Vindigni, Carla; Terzuoli, Lucia (2014). "Evaluación de un examen para la detección y el diagnóstico de la enfermedad celíaca". Journal of Clinical Laboratory Analysis. 30 (1): 65–70. doi:10.1002/jcla.21816. PMC6807240. PMID 25385391.
- ^ Del-Rei, Rodrigo Pimenta; Leony, Leonardo Maia; Celedon, Paola Alejandra Fiorani; Zanchin, Nilson Ivo Tonin; Reis, Mitermayer Galvão dos; Gomes, Yara de Miranda; Schijman, Alejandro Gabriel; Longhi, Silvia Andrea; Santos, Fred Luciano Neves (2019-04-18). "Detección de anticuerpos anti-Trypanosoma cruzi por antígenos quiméricos en enfermedades crónicas Chagas-individuales de países endémicos sudamericanos". PLOS ONE. 14 (4): e0215623. Código:2019PLoSO..1415623D. doi:10.1371/journal.pone.0215623. ISSN 1932-6203. PMC6472793. PMID 30998741.
- ^ Griffin, J. F. T.; Spittle, E.; Rodgers, C. R.; Liggett, S.; Cooper, M.; Bakker, D.; Bannantine, J. P. (2005). "Inmunoglobulina G1 Ensayo Inmunosorbente enzimático para el diagnóstico de la enfermedad de Johne en el ciervo rojo (Cervus elaphus)". Inmunología Clínica y Vacuna. 12 (12): 1401–9. doi:10.1128/CDLI.12.1401-1409.2005. PMC1317074. PMID 16339063.
- ^ Dhamad, AE; Abdal Rhida, MA (2020). "COVID-19: métodos de detección molecular y serológica". PeerJ. 8: e10180. doi:10.7717/peerj.10180. PMC7547594. PMID 33083156.
Contenido relacionado
Ninfas
Proboscidea
Pythonidae