Elemento del grupo 7
Grupo 7, numerado según la nomenclatura IUPAC, es un grupo de elementos de la tabla periódica. Contiene manganeso (Mn), tecnecio (Tc), renio (Re) y bohrio (Bh). Este grupo se encuentra en el bloque d de la tabla periódica y, por tanto, son metales de transición. Este grupo a veces se denomina grupo del manganeso o familia del manganeso en honor a su miembro más ligero; Sin embargo, el grupo en sí no ha adquirido un nombre trivial porque pertenece al grupo más amplio de los metales de transición.
Los elementos del grupo 7 tienden a tener un estado de oxidación de grupo mayor (+7), aunque esta tendencia es notablemente menos coherente que los grupos anteriores. Al igual que otros grupos, los miembros de esta familia muestran patrones en sus configuraciones electrónicas, especialmente en las capas más externas, lo que resulta en tendencias en el comportamiento químico. En la naturaleza, el manganeso es un elemento bastante común, mientras que el renio es raro, el tecnecio sólo se encuentra en pequeñas cantidades y el bohrio es completamente sintético.
Propiedades físicas
Las tendencias en el grupo 7 siguen, aunque menos notablemente, las de los otros grupos tempranos del bloque d y reflejan la adición de una capa f llena al núcleo al pasar del quinto al sexto período. Todos los elementos del grupo 7 cristalizan en la estructura hexagonal compacta (hcp), excepto el manganeso, que cristaliza en la estructura cúbica centrada en el cuerpo (bcc). También se espera que el bohrio cristalice en la estructura hcp.
La siguiente tabla es un resumen de las propiedades físicas clave de los elementos del grupo 7. Se predice el valor con signo de interrogación.
| Nombre | Mn, manganeso | Tc, technetium | Re, rhenium | Bh, bohrium |
|---|---|---|---|---|
| Punto de fusión | 1519 K (1246 °C) | 2430 K (2157 °C) | 3459 K (3186 °C) | No conocido |
| Punto de encuentro | 2334 K (2061 °C) | 4538 K (4265 °C) | 5903 K (5630 °C) | No conocido |
| Densidad | 7.21 g·cm−3 | 11 g·cm−3 | 21.02 g·cm−3 | 26-27 g·c m−3? |
| Apariencia | metálico plateado | plateado | plateado | No conocido |
| Radius atómico | 127 pm | 136 horas | 137 pm | 128 pm? |
Propiedades químicas
Al igual que otros grupos, los miembros de esta familia muestran patrones en su configuración electrónica, especialmente en las capas más externas:
| Z | Elemento | No. de electrones/shell |
|---|---|---|
| 25 | manganeso | 2, 8, 13, 2 |
| 43 | technetium | 2, 8, 18, 13, 2 |
| 75 | rhenium | 2, 8, 18, 32, 13, 2 |
| 107 | Bohrium | 2, 8, 18, 32, 32, 13, 2 |
Todos los miembros del grupo representan fácilmente su estado de oxidación grupal de +7 y el estado se vuelve más estable a medida que el grupo desciende. El tecnecio también muestra un estado estable +4, mientras que el renio exhibe estados estables +4 y +3.
Por lo tanto, Bohrium también puede mostrar estos estados inferiores. Es más probable que exista el estado de oxidación +7 superior en oxianiones, como el perbohrato, BhO4-, análogo al permanganato, pertecnetato y perrenato, más ligeros. Sin embargo, es probable que el bohrio (VII) sea inestable en solución acuosa y probablemente se reduzca fácilmente al bohrio (IV), más estable.
Compuestos
Óxidos
Manganeso

El manganeso forma una variedad de óxidos: MnO, Mn3O4, Mn2O3, MnO2, MnO3 y Mn2O7. El óxido de manganeso (II) es un compuesto inorgánico que forma cristales verdes. Como muchos monóxidos, el MnO adopta la estructura de la sal gema, donde los cationes y los aniones están coordinados octaédricamente. Además, como muchos óxidos, el óxido de manganeso (II) suele ser no estequiométrico: su composición puede variar de MnO a MnO1,045. El óxido de manganeso (II, III) se forma cuando cualquier óxido de manganeso se calienta en aire por encima de 1000 °C. Se han centrado considerables investigaciones en la producción de Mn3O4 nanocristalino y diversas síntesis que implican la oxidación de MnII o la reducción de MnVI<. /sup>. El óxido de manganeso (III) se diferencia de muchos otros óxidos de metales de transición en que no adopta la estructura de corindón (Al2O3). Generalmente se reconocen dos formas, α-Mn2O3 y γ-Mn2O3, aunque una También se ha informado de forma de alta presión con la estructura CaIrO3. El óxido de manganeso (IV) es un sólido negruzco o marrón que se encuentra naturalmente como mineral pirolusita, que es el principal mineral de manganeso y un componente de los nódulos de manganeso. El uso principal del MnO2 es para baterías de celda seca, como la batería alcalina y la batería de zinc-carbono. El óxido de manganeso (VII) es de color verde oscuro en su forma cristalina. El líquido es verde por la luz reflejada y rojo por la luz transmitida. Es soluble en tetracloruro de carbono y se descompone en contacto con el agua.
Tecnecio

Los principales óxidos del tecnecio son el óxido de tecnecio (IV) y el óxido de tecnecio (VII). El óxido de tecnecio (IV) se produjo por primera vez en 1949 electrolizando una solución de pertecnetato de amonio bajo hidróxido de amonio. A menudo se ha utilizado para separar el tecnecio del molibdeno y el renio. Métodos más eficaces son la reducción del pertecnetato de amonio mediante zinc metálico y ácido clorhídrico, cloruro estannoso, hidrazina, hidroxilamina, ácido ascórbico, mediante la hidrólisis del hexaclorotecnetato de potasio o mediante la descomposición del pertecnetato de amonio a 700 °C en atmósfera inerte. Reacciona con el oxígeno para producir óxido de tecnecio (VII) a 450 °C.
El óxido de tecnecio (VII) se puede preparar directamente mediante la oxidación del tecnecio a 450-500 °C. Es un raro ejemplo de óxido metálico binario molecular. Otros ejemplos son el óxido de rutenio (VIII) y el óxido de osmio (VIII). Adopta una estructura bittetraédrica centrosimétrica de esquinas compartidas en la que los enlaces Tc-O terminales y puente son 167 pm y 184 pm respectivamente y el ángulo Tc-O-Tc es 180 °.
Renio
Los principales óxidos del renio son el óxido de renio (IV) y el óxido de renio (VII). El óxido de renio (IV) es un sólido cristalino de color gris a negro que puede formarse por comparación. A altas temperaturas sufre una desproporción. Es un reactivo de laboratorio que se puede utilizar como catalizador. Adopta la estructura rutilo. Forma perrenatos con peróxido de hidrógeno alcalino y ácidos oxidantes. En el hidróxido de sodio fundido se forma renato de sodio:
- 2NaOH + ReO2 → Na2ReO3 + H2O
El óxido de renio (VII) se puede formar cuando el renio o sus óxidos o sulfuros se oxidan a 500-700 °C en el aire. Se disuelve en agua para dar ácido perrénico. Al calentar Re2O7 se obtiene óxido de renio (IV), lo que se manifiesta por la aparición de una coloración azul oscuro. En su forma sólida, Re2O7 consta de centros Re octaédricos y tetraédricos alternos. Es la materia prima de todos los compuestos de renio, siendo la fracción volátil que se obtiene al tostar el mineral huésped.
El renio, además de los estados de oxidación +4 y +7, también forma un trióxido. Se puede formar reduciendo óxido de renio (VII) con monóxido de carbono a 200 C o renio elemental a 4000 C. También se puede reducir con dioxano. Es un sólido rojo con un brillo metálico que se asemeja al cobre en apariencia y es el único trióxido estable de los elementos del grupo 7.
Halogenuros
Manganeso
El manganeso puede formar compuestos en los estados de oxidación +2, +3 y +4. Los compuestos de manganeso (II) suelen ser sólidos de color rosa claro. Al igual que otros difluoruros metálicos, el MnF2 cristaliza en la estructura del rutilo, que presenta centros octaédricos de Mn. y se utiliza en la fabricación de tipos especiales de vidrio y láseres. La scacchita es la forma natural anhidra del cloruro de manganeso (II). El único otro mineral actualmente conocido sistematizado como cloruro de manganeso es la kempita, un representante del grupo atacamita, un grupo de hidróxido-cloruros. Se puede utilizar en lugar de paladio en la reacción de Stille, que acopla dos átomos de carbono mediante un compuesto organoestaño. Puede usarse como pigmento rosa o como fuente de ion manganeso o ion yoduro. Se utiliza a menudo en la industria de la iluminación.
Tecnecio
Se conocen los siguientes haluros de tecnecio binarios (que contienen solo dos elementos): TcF6, TcF5, TcCl4, TcBr4, TcBr3, α-TcCl3, β-TcCl3, TcI3, α-TcCl2 y β- TcCl2. Los estados de oxidación varían desde Tc(VI) a Tc(II). Los haluros de tecnecio exhiben diferentes tipos de estructuras, como complejos octaédricos moleculares, cadenas extendidas, láminas en capas y grupos metálicos dispuestos en una red tridimensional. Estos compuestos se producen combinando el metal y el halógeno o mediante reacciones menos directas.
ElTcCl4 se obtiene por cloración de Tc metal o Tc2O7. Al calentarlo, TcCl4 da los correspondientes cloruros de Tc (III) y Tc (II).
- TcCl4 → α-TcCl3 + 1/2 Cl2
- TcCl3 → β-TcCl2 + 1/2 Cl2
La estructura del TcCl4 está compuesta por infinitas cadenas en zigzag de octaedros de TcCl6 que comparten bordes. Es isomorfo a los tetracloruros de metales de transición de circonio, hafnio y platino.

Existen dos polimorfos de tricloruro de tecnecio, α- y β-TcCl3. El polimorfo α también se denomina Tc3Cl9. Adopta una estructura bioctaédrica confacial. Se prepara tratando el cloroacetato Tc2(O2CCH3)4Cl 2 con HCl. Al igual que Re3Cl9, la estructura del polimorfo α consta de triángulos con distancias M-M cortas. El β-TcCl3 presenta centros de Tc octaédricos, que están organizados en pares, como se observa también en el tricloruro de molibdeno. TcBr3 no adopta la estructura de ninguna de las fases de tricloruro. En cambio, tiene la estructura del tribromuro de molibdeno, que consta de cadenas de octaedros confaciales con contactos Tc-Tc cortos y largos alternos. TcI3 tiene la misma estructura que la fase de alta temperatura de TiI3, presentando cadenas de octaedros confaciales con contactos Tc-Tc iguales.
Se conocen varios haluros de tecnecio aniónicos. Los tetrahaluros binarios se pueden convertir en hexahaluros [TcX6]2− (X = F, Cl, Br, I), que adoptan una geometría molecular octaédrica. Los haluros más reducidos forman grupos aniónicos con enlaces Tc-Tc. La situación es similar para los elementos relacionados de Mo, W, Re. Estos grupos tienen la nuclearidad Tc4, Tc6, Tc8 y Tc13. Los grupos más estables de Tc6 y Tc8 tienen formas de prisma donde los pares verticales de átomos de Tc están conectados por enlaces triples y los átomos planos por enlaces simples. Cada átomo de tecnecio forma seis enlaces, y los electrones de valencia restantes pueden saturarse con un átomo de halógeno de ligando axial y dos de puente, como el cloro o el bromo.
Renio
Los cloruros de renio más comunes son ReCl6, ReCl5, ReCl4 y ReCl3. Las estructuras de estos compuestos suelen presentar enlaces Re-Re extensos, característicos de este metal en estados de oxidación inferiores a VII. Las sales de [Re2Cl8]2− presentan un enlace cuádruple metal-metal. Aunque el cloruro de renio más alto presenta Re (VI), el flúor da el heptafluoruro de renio derivado d0 Re(VII). También son bien conocidos los bromuros y yoduros de renio.
Al igual que el tungsteno y el molibdeno, con los que comparte similitudes químicas, el renio forma una variedad de oxihaluros. Los oxicloruros son los más comunes e incluyen ReOCl4, ReOCl3.
Compuestos organometálicos
Manganeso
Los compuestos de organomaganeso fueron reportados por primera vez en 1937 por Gilman y Bailee, quienes describieron la reacción de fenillitio y yoduro de manganeso (II) para formar yoduro de fenilmanganeso (PhMnI) y difenilmanganeso (Ph2Mn).
Siguiendo este precedente, se pueden obtener otros haluros de organomanganeso mediante la alquilación de cloruro de manganeso (II), bromuro de manganeso (II) y yoduro de manganeso (II). El yoduro de manganeso es atractivo porque el compuesto anhidro se puede preparar in situ a partir de manganeso y yodo en éter. Los agentes alquilantes típicos son compuestos de organolitio u organomagnesio.
La química de los compuestos organometálicos de Mn(II) es inusual entre los metales de transición debido al alto carácter iónico del enlace Mn(II)-C. La reactividad de los compuestos de organomaneso se puede comparar con la de los compuestos de organomagnesio y organozinc. La electronegatividad del Mn (1,55) es comparable a la del Mg (1,31) y del Zn (1,65), lo que hace que el átomo de carbono (EN = 2,55) sea nucleofílico. El potencial de reducción del Mn también es intermedio entre el Mg y el Zn.
Tecnecio

El tecnecio forma una variedad de complejos de coordinación con ligandos orgánicos. Muchos han sido bien investigados debido a su relevancia para la medicina nuclear.
El tecnecio forma una variedad de compuestos con enlaces Tc-C, es decir, complejos de organotecnecio. Los miembros destacados de esta clase son complejos con ligandos de CO, areno y ciclopentadienilo. El carbonilo binario Tc2(CO)10 es un sólido volátil de color blanco. En esta molécula, dos átomos de tecnecio están unidos entre sí; cada átomo está rodeado por octaedros de cinco ligandos carbonilo. La longitud del enlace entre los átomos de tecnecio, 303 pm, es significativamente mayor que la distancia entre dos átomos en el tecnecio metálico (272 pm). Los carbonilos similares se forman a partir de los congéneres del tecnecio, el manganeso y el renio. El interés por los compuestos organotecnecio también ha estado motivado por sus aplicaciones en medicina nuclear. Inusual para otros carbonilos metálicos, el Tc forma complejos acuocarbonílicos, entre los que destaca [Tc(CO)3(H2O)3]< sup>+.
Renio
El dirhenio decacarbonilo es la entrada más común a la química del organorrenio. Su reducción con amalgama de sodio da Na[Re(CO)5] con renio en estado de oxidación formal −1. El dirhenio decacarbonilo se puede oxidar con bromo a bromopentacarbonilrenio (I):
- Re2(CO)10 + Br2 → 2 Re(CO)5Br
La reducción de este pentacarbonilo con zinc y ácido acético da pentacarbonilhidridorhenio:
- Re(CO)5Br + Zn + HOAc → Re(CO)5H + ZnBr(OAc)
El trióxido de metilrenio ("MTO"), CH3ReO3 es un sólido volátil e incoloro que se ha utilizado como catalizador en algunos experimentos de laboratorio.. Puede prepararse por muchas rutas, un método típico es la reacción de Re2O7 y tetrametilestaño:
- Re2O7 + (CH)3)4Sn → CH3ReO3 + (CH)3)3SnOReO3
Se conocen derivados de alquilo y arilo análogos. MTO cataliza las oxidaciones con peróxido de hidrógeno. Los alquinos terminales producen el ácido o éster correspondiente, los alquinos internos producen dicetonas y los alquenos dan epóxidos. MTO también cataliza la conversión de aldehídos y diazoalcanos en un alqueno.
Polioxometalatos
El polioxotecnetato (polioxometalato de tecnecio) contiene tanto Tc(V) como Tc(VII) en una proporción de 4:16 y se obtiene como sal de hidronio [H7O3]4[Tc20O68]·4H2O concentrando un HTcO4 solución. El primer polioxorrenato aislado empíricamente fue el blanco [Re4O15]2− y contenía Re(VII) en coordinación octaédrica y tetraédrica.
Historia
Manganeso
El dióxido de manganeso, que abunda en la naturaleza, se ha utilizado durante mucho tiempo como pigmento. Las pinturas rupestres de Gargas, que tienen entre 30.000 y 24.000 años de antigüedad, están hechas de pigmentos MnO2 en forma mineral. Los vidrieros egipcios y romanos utilizaban compuestos de manganeso para añadir o quitar color al vidrio. Úselo como "jabón de vidriero" Continuó a lo largo de la Edad Media hasta los tiempos modernos y es evidente en el vidrio de Venecia del siglo XIV.
Tecnecio y renio
Renio (latín: Rhenus, que significa "Rin") fue el último elemento descubierto que tiene un isótopo estable (otros elementos nuevos descubiertos en desde entonces la naturaleza, como el francio, son radiactivos). La existencia de un elemento aún no descubierto en esta posición de la tabla periódica fue predicha por primera vez por Dmitri Mendeleev. Henry Moseley obtuvo otra información calculada en 1914. En 1908, el químico japonés Masataka Ogawa anunció que había descubierto el elemento número 43 y lo llamó nipponium (Np) en honor a Japón (Nippon en japonés). Sin embargo, análisis recientes indicaron la presencia de renio (elemento 75), no tecnecio, aunque esta reinterpretación ha sido cuestionada por Eric Scerri. El símbolo Np se usó más tarde para el elemento neptunio, y el nombre "nihonium", también llamado así por Japón, junto con el símbolo Nh, se usó más tarde para el elemento 113. El elemento 113 también fue descubierto por un equipo de japoneses. científicos y fue nombrado en respetuoso homenaje al trabajo de Ogawa.
En general, se considera que el renio fue descubierto por Walter Noddack, Ida Noddack y Otto Berg en Alemania. En 1925 informaron que habían detectado el elemento en mineral de platino y en el mineral columbita. También encontraron renio en gadolinita y molibdenita. En 1928 consiguieron extraer 1 g del elemento procesando 660 kg de molibdenita. En 1968 se estimó que el 75% del renio metálico en los Estados Unidos se utilizaba para la investigación y el desarrollo de aleaciones de metales refractarios. Pasaron varios años desde ese momento antes de que las superaleaciones se utilizaran ampliamente.
El descubrimiento del elemento 43 fue finalmente confirmado en un experimento realizado en 1937 en la Universidad de Palermo en Sicilia por Carlo Perrier y Emilio Segrè. A mediados de 1936, Segrè visitó Estados Unidos, primero la Universidad de Columbia en Nueva York y luego el Laboratorio Nacional Lawrence Berkeley en California. Convenció al inventor del ciclotrón, Ernest Lawrence, para que le permitiera recuperar algunas piezas desechadas del ciclotrón que se habían vuelto radiactivas. Lawrence le envió por correo una lámina de molibdeno que había sido parte del deflector del ciclotrón.
Bohrio
Dos grupos afirmaron haber descubierto el elemento bohrio. La evidencia de bohrio fue reportada por primera vez en 1976 por un equipo de investigación soviético dirigido por Yuri Oganessian, en el que objetivos de bismuto-209 y plomo-208 fueron bombardeados con núcleos acelerados de cromo-54 y manganeso-55 respectivamente. Se observaron dos actividades, una con una vida media de uno a dos milisegundos y la otra con una vida media de aproximadamente cinco segundos. Dado que la relación entre las intensidades de estas dos actividades fue constante durante todo el experimento, se propuso que la primera provenía del isótopo bohrium-261 y que la segunda provenía de su hija dubnium-257. Posteriormente, el isótopo dubnio se corrigió a dubnio-258, que de hecho tiene una vida media de cinco segundos (el dubnio-257 tiene una vida media de un segundo); sin embargo, la vida media observada para su progenitor es mucho más corta que las vidas medias observadas posteriormente en el descubrimiento definitivo del bohrio en Darmstadt en 1981. El Grupo de Trabajo sobre Transfermio (TWG) de la IUPAC/IUPAP concluyó que, si bien probablemente se había observado dubnio-258, En este experimento, la evidencia de la producción de su padre bohrium-262 no fue lo suficientemente convincente.
En 1981, un equipo de investigación alemán dirigido por Peter Armbruster y Gottfried Münzenberg en el Centro GSI Helmholtz para la Investigación de Iones Pesados (GSI Helmholtzzentrum für Schwerionenforschung) en Darmstadt bombardeó un objetivo de bismuto-209 con núcleos acelerados de cromo-54 para producir 5 átomos del isótopo bohrio-262:
- 20983 Bi + 5424Cr → 262107 Bh + n
Este descubrimiento fue corroborado aún más por sus mediciones detalladas de la cadena de desintegración alfa de los átomos de bohrio producidos en isótopos previamente conocidos de fermio y californio. El Grupo de Trabajo sobre Transfermium (TWG) de IUPAC/IUPAP reconoció la colaboración de GSI como descubridores oficiales en su informe de 1992.
Ocurrencia y producción
Manganeso
El manganeso comprende alrededor de 1000 ppm (0,1%) de la corteza terrestre, el duodécimo elemento más abundante de la corteza. El suelo contiene entre 7 y 9000 ppm de manganeso con un promedio de 440 ppm. La atmósfera contiene 0,01 μg/m3. El manganeso se presenta principalmente como pirolusita (MnO2), braunita (Mn2+Mn3+6)(SiO12), psilomelano (Ba,H2O)2Mn5O10, y en menor medida como rodocrosita (MnCO3).

El mineral de manganeso más importante es la pirolusita (MnO2). Otros minerales de manganeso de importancia económica suelen mostrar una estrecha relación espacial con los minerales de hierro, como la esfalerita. Los recursos terrestres son grandes pero están distribuidos de manera irregular. Alrededor del 80% de los recursos mundiales conocidos de manganeso se encuentran en Sudáfrica; Otros depósitos importantes de manganeso se encuentran en Ucrania, Australia, India, China, Gabón y Brasil. Según una estimación de 1978, el fondo del océano contiene 500 mil millones de toneladas de nódulos de manganeso. En el decenio de 1970 se abandonaron los intentos de encontrar métodos económicamente viables para recolectar nódulos de manganeso.
En Sudáfrica, la mayoría de los depósitos identificados se encuentran cerca de Hotazel, en la provincia del Cabo Norte, con una estimación de 15 mil millones de toneladas en 2011. En 2011, Sudáfrica produjo 3,4 millones de toneladas, superando a todos los demás países.
El manganeso se extrae principalmente en Sudáfrica, Australia, China, Gabón, Brasil, India, Kazajstán, Ghana, Ucrania y Malasia.
Para la producción de ferromanganeso, el mineral de manganeso se mezcla con mineral de hierro y carbono y luego se reduce en un alto horno o en un horno de arco eléctrico. El ferromanganeso resultante tiene un contenido de manganeso del 30 al 80%. El manganeso puro utilizado para la producción de aleaciones sin hierro se produce lixiviando el mineral de manganeso con ácido sulfúrico y un posterior proceso de electroobtención.
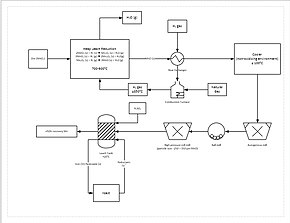
Un proceso de extracción más progresivo implica la reducción directa del mineral de manganeso (de baja ley) en una lixiviación en pilas. Esto se hace filtrando gas natural a través del fondo del montón; el gas natural proporciona el calor (debe estar a al menos 850 °C) y el agente reductor (monóxido de carbono). Esto reduce todo el mineral de manganeso a óxido de manganeso (MnO), que es una forma lixiviable. Luego, el mineral viaja a través de un circuito de molienda para reducir el tamaño de las partículas del mineral a entre 150 y 250 μm, aumentando el área de superficie para ayudar a la lixiviación. Luego, el mineral se agrega a un tanque de lixiviación de ácido sulfúrico y hierro ferroso (Fe2+) en una proporción de 1,6:1. El hierro reacciona con el dióxido de manganeso (MnO2) para formar óxido-hidróxido de hierro (III) (FeO(OH)) y manganeso elemental (Mn):
Este proceso produce aproximadamente un 92 % de recuperación del manganeso. Para una mayor purificación, el manganeso se puede enviar a una instalación de electroobtención.
En 1972, el Proyecto Azorian de la CIA, a través del multimillonario Howard Hughes, encargó al barco Hughes Glomar Explorer la historia de portada de la recolección de nódulos de manganeso del fondo marino. Eso desencadenó una oleada de actividad para recolectar nódulos de manganeso, lo que en realidad no era práctico. La verdadera misión del Hughes Glomar Explorer era rescatar un submarino soviético hundido, el K-129, con el objetivo de recuperar libros de códigos soviéticos.
Un recurso abundante de manganeso en forma de nódulos de Mn encontrados en el fondo del océano. Estos nódulos, que están compuestos por un 29% de manganeso, están ubicados a lo largo del fondo del océano y se está investigando el impacto potencial de su extracción. Pueden producirse impactos ambientales físicos, químicos y biológicos debido a que esta extracción de nódulos perturba el fondo marino y provoca la formación de columnas de sedimentos. Esta suspensión incluye metales y nutrientes inorgánicos, que pueden provocar la contaminación de las aguas cercanas al fondo por compuestos tóxicos disueltos. Los nódulos de manganeso son también zonas de pastoreo, espacio vital y protección para los sistemas endo y epifaunales. Cuando se eliminan estos nódulos, estos sistemas se ven directamente afectados. En general, esto puede provocar que las especies abandonen la zona o mueran por completo. Antes del comienzo de la minería, los organismos afiliados a las Naciones Unidas y las empresas patrocinadas por el estado están llevando a cabo investigaciones en un intento de comprender completamente los impactos ambientales con la esperanza de mitigarlos.
Tecnecio
El tecnecio se creó bombardeando átomos de molibdeno con deuterones que habían sido acelerados por un dispositivo llamado ciclotrón. El tecnecio se encuentra naturalmente en la corteza terrestre en concentraciones diminutas de aproximadamente 0,003 partes por billón. El tecnecio es muy raro porque la vida media del 97Tc y del 98Tc es de sólo 4,2 millones de años. Han pasado más de mil de esos períodos desde la formación de la Tierra, por lo que la probabilidad de supervivencia de incluso un átomo de tecnecio primordial es efectivamente cero. Sin embargo, existen pequeñas cantidades como productos de fisión espontánea en los minerales de uranio. Se estima que un kilogramo de uranio contiene 1 nanogramo (10−9 g) equivalente a diez billones de átomos de tecnecio. Algunas estrellas gigantes rojas con los tipos espectrales S-, M- y N contienen una línea de absorción espectral que indica la presencia de tecnecio. Estas gigantes rojas se conocen informalmente como estrellas de tecnecio.
Renio

El renio es uno de los elementos más raros de la corteza terrestre con una concentración promedio de 1 ppb; otras fuentes citan la cifra de 0,5 ppb, lo que lo convierte en el 77º elemento más abundante en la corteza terrestre. El renio probablemente no se encuentra libre en la naturaleza (su posible aparición natural es incierta), pero se encuentra en cantidades de hasta el 0,2% en el mineral molibdenita (que es principalmente disulfuro de molibdeno), la principal fuente comercial, aunque muestras individuales de molibdenita con hasta 1,88 % se han encontrado. Chile tiene las reservas de renio más grandes del mundo, parte de los yacimientos de mineral de cobre, y fue el principal productor en 2005. Sólo recientemente se encontró y describió el primer mineral de renio (en 1994), un mineral de sulfuro de renio. (ReS2) condensación de una fumarola en el volcán Kudriavy, isla Iturup, en las islas Kuriles. Kudriavy descarga entre 20 y 60 kg de renio al año, principalmente en forma de disulfuro de renio. Este raro mineral, llamado reniita, alcanza precios elevados entre los coleccionistas.

La mayor parte del renio extraído proviene de depósitos de pórfido de molibdeno. Estos minerales suelen contener entre un 0,001% y un 0,2% de renio. Tostar el mineral volatiliza los óxidos de renio. El óxido de renio (VII) y el ácido perrénico se disuelven fácilmente en agua; se lixivian de los polvos y gases de combustión y se extraen mediante precipitación con cloruro de potasio o amonio como sales de perrenato, y se purifican mediante recristalización. La producción mundial total oscila entre 40 y 50 toneladas/año; los principales productores están en Chile, Estados Unidos, Perú y Polonia. El reciclaje del catalizador Pt-Re usado y de aleaciones especiales permite recuperar otras 10 toneladas al año. Los precios del metal aumentaron rápidamente a principios de 2008, de 1000 a 2000 dólares por kg en 2003-2006 a más de 10 000 dólares en febrero de 2008. La forma metálica se prepara reduciendo perrenato de amonio con hidrógeno a altas temperaturas:
- 2 NH4ReO4 + 7 H2 → 2 Re + 8 H2O + 2 NH3
- Existen tecnologías para la extracción asociada del renio de soluciones productivas de lixiviación subterránea de ores de uranio.
Bohrio
El bohrio es un elemento sintético que no se encuentra en la naturaleza. Se han sintetizado muy pocos átomos y, debido también a su radiactividad, sólo se han realizado investigaciones limitadas. El bohrio sólo se produce en reactores nucleares y nunca se ha aislado en forma pura.
Aplicaciones
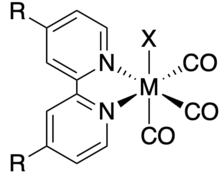
El isómero facial de los complejos de haluro de 2,2'-bipiridil tricarbonilo de renio y manganeso se ha investigado ampliamente como catalizador para la reducción electroquímica de dióxido de carbono debido a su alta selectividad y estabilidad. Comúnmente se abrevian como M(R-bpy)(CO)3X donde M = Mn, Re; R-bpy = 4,4'-2,2'-bipiridina disustituida; y X = Cl, Br.
Manganeso
La rareza del renio ha hecho que la investigación se desplace hacia la versión de manganeso de estos catalizadores como una alternativa más sostenible. Los primeros informes de la actividad catalítica de Mn(R-bpy)(CO)3Br hacia la reducción de CO2 provinieron de Chardon-Noblat y sus compañeros de trabajo en 2011. En comparación con los análogos de Re, Mn(R-bpy)(CO)3Br muestra actividad catalítica con sobrepotenciales más bajos.
El mecanismo catalítico del Mn(R-bpy)(CO)3X es complejo y depende del perfil estérico del ligando bipiridina. Cuando R no es voluminoso, el catalizador se dimeriza para formar [Mn(R-bpy)(CO)3]2 antes de formar la especie activa. Sin embargo, cuando R es voluminoso, el complejo forma la especie activa sin dimerizarse, lo que reduce el sobrepotencial de reducción de CO2 en 200-300 mV. A diferencia de Re(R-bpy)(CO)3X, Mn(R-bpy)(CO)3X solo reduce el CO2 en la presencia de un ácido.
Tecnecio

El tecnecio-99m ("m" indica que se trata de un isómero nuclear metaestable) se utiliza en pruebas médicas de isótopos radiactivos. Por ejemplo, el tecnecio-99m es un trazador radiactivo que los equipos de imágenes médicas rastrean en el cuerpo humano. Se adapta bien a esta función porque emite rayos gamma de 140 keV fácilmente detectables y su vida media es de 6,01 horas (lo que significa que alrededor del 94% se desintegra en tecnecio-99 en 24 horas). La química del tecnecio le permite unirse a una variedad de compuestos bioquímicos, cada uno de los cuales determina cómo se metaboliza y deposita en el cuerpo, y este único isótopo puede usarse para una multitud de pruebas de diagnóstico. Más de 50 radiofármacos comunes se basan en el tecnecio-99m para estudios funcionales y de imagen del cerebro, el músculo cardíaco, la tiroides, los pulmones, el hígado, la vesícula biliar, los riñones, el esqueleto, la sangre y los tumores. El tecnecio-99m también se utiliza en radioimagen.
El isótopo de vida más larga, el tecnecio-95m, con una vida media de 61 días, se utiliza como trazador radiactivo para estudiar el movimiento del tecnecio en el medio ambiente y en los sistemas vegetales y animales.
El tecnecio-99 se desintegra casi por completo mediante desintegración beta, emitiendo partículas beta con energías consistentemente bajas y sin rayos gamma que las acompañen. Además, su larga vida media hace que esta emisión disminuya muy lentamente con el tiempo. También se puede extraer con una alta pureza química e isotópica a partir de desechos radiactivos. Por estos motivos, es un emisor beta estándar del Instituto Nacional de Estándares y Tecnología (NIST) y se utiliza para la calibración de equipos. También se ha propuesto el tecnecio-99 para dispositivos optoelectrónicos y baterías nucleares a nanoescala.
Al igual que el renio y el paladio, el tecnecio puede servir como catalizador. En procesos como la deshidrogenación del alcohol isopropílico, es un catalizador mucho más eficaz que el renio o el paladio. Sin embargo, su radiactividad es un problema importante en aplicaciones catalíticas seguras.
Cuando el acero se sumerge en agua, agregar una pequeña concentración (55 ppm) de pertecnetato de potasio (VII) al agua protege el acero de la corrosión, incluso si la temperatura se eleva a 250 °C (523 K). Por esta razón, el pertecnetato se ha utilizado como inhibidor de la corrosión anódica del acero, aunque la radiactividad del tecnecio plantea problemas que limitan esta aplicación a sistemas autónomos. Mientras que (por ejemplo) CrO2−
4 también puede inhibir la corrosión; requiere una concentración diez veces mayor. En un experimento, una muestra de acero al carbono se mantuvo en una solución acuosa de pertecnetato durante 20 años y aún no estaba corroída. El mecanismo por el cual el pertecnetato previene la corrosión no se comprende bien, pero parece implicar la formación reversible de una capa superficial delgada (pasivación). Una teoría sostiene que el pertecnetato reacciona con la superficie del acero para formar una capa de dióxido de tecnecio que evita una mayor corrosión; el mismo efecto explica cómo se puede utilizar el polvo de hierro para eliminar el pertecnetato del agua. El efecto desaparece rápidamente si la concentración de pertecnetato cae por debajo de la concentración mínima o si se añade una concentración demasiado alta de otros iones.
Como se señaló, la naturaleza radiactiva del tecnecio (3 MBq/L en las concentraciones requeridas) hace que esta protección contra la corrosión no sea práctica en casi todas las situaciones. Sin embargo, se propuso (pero nunca se adoptó) la protección contra la corrosión mediante iones pertecnetato para su uso en reactores de agua en ebullición.
Renio
La actividad catalítica de Re(bpy)(CO)3Cl para la reducción de dióxido de carbono fue estudiada por primera vez por Lehn et al. y Meyer et al. en 1984 y 1985, respectivamente. Los complejos Re(R-bpy)(CO)3X producen exclusivamente CO a partir de la reducción de CO2 con eficiencias faradaicas cercanas al 100 % incluso en soluciones con altas concentraciones de agua o Ácidos de Bronsted.
El mecanismo catalítico de Re(R-bpy)(CO)3X implica la reducción del complejo dos veces y la pérdida del ligando X para generar una especie activa de cinco coordenadas que se une al CO2. Estos complejos reducirán el CO2 tanto con como sin un ácido adicional presente; sin embargo, la presencia de un ácido aumenta la actividad catalítica. Los estudios de la teoría funcional de la densidad han demostrado que la alta selectividad de estos complejos para la reducción de CO2 frente a la reacción competitiva de evolución de hidrógeno está relacionada con una cinética más rápida de unión de CO2 en comparación con al enlace H+.
Bohrio
El bohrio es un elemento sintético y es demasiado radiactivo para usarse en cualquier cosa.
Toxicidad y precauciones
Los compuestos de manganeso son menos tóxicos que los de otros metales muy extendidos, como el níquel y el cobre. Sin embargo, la exposición a polvos y vapores de manganeso no debe exceder el valor máximo de 5 mg/m3 incluso durante períodos cortos debido a su nivel de toxicidad. La intoxicación por manganeso se ha relacionado con alteraciones de las habilidades motoras y trastornos cognitivos.
El tecnecio tiene una baja toxicidad química. Por ejemplo, no se pudo detectar ningún cambio significativo en la fórmula sanguínea, el peso corporal y de los órganos ni en el consumo de alimentos en ratas que ingirieron hasta 15 µg de tecnecio-99 por gramo de alimento durante varias semanas. En el cuerpo, el tecnecio se convierte rápidamente en el estable TcO−
4 ion, que es altamente soluble en agua y se excreta rápidamente. La toxicidad radiológica del tecnecio (por unidad de masa) es función del compuesto, el tipo de radiación del isótopo en cuestión y la vida media del isótopo. Sin embargo, es radiactivo, por lo que todos los isótopos deben manipularse con cuidado. El principal peligro al trabajar con tecnecio es la inhalación de polvo; Esta contaminación radiactiva en los pulmones puede suponer un importante riesgo de cáncer. Para la mayoría de los trabajos, es suficiente un manejo cuidadoso en una campana extractora y no se necesita una guantera.
Se sabe muy poco sobre la toxicidad del renio y sus compuestos porque se utilizan en cantidades muy pequeñas. Las sales solubles, como los haluros de renio o los perrenatos, podrían ser peligrosas debido a elementos distintos del renio o al propio renio. Sólo se ha probado la toxicidad aguda de unos pocos compuestos de renio; dos ejemplos son el perrenato de potasio y el tricloruro de renio, que se inyectaron en forma de solución a ratas. El perrenato tenía un valor LD50 de 2800 mg/kg después de siete días (esto es una toxicidad muy baja, similar a la de la sal de mesa) y el tricloruro de renio mostró una LD50 de 280 mg/kg.
Papel biológico
De los elementos del grupo 7, sólo el manganeso tiene un papel en el cuerpo humano. Es un oligoelemento esencial y el cuerpo contiene aproximadamente 10 miligramos en un momento dado. Está presente como coenzima en procesos biológicos que incluyen el metabolismo de macronutrientes, la formación ósea y los sistemas de defensa de radicales libres. Es un componente crítico en docenas de proteínas y enzimas. El manganeso del cuerpo humano se concentra principalmente en los huesos y el resto del tejido blando se concentra en el hígado y los riñones. En el cerebro humano, el manganeso está unido a metaloproteínas de manganeso, sobre todo a la glutamina sintetasa en los astrocitos. El tecnecio, el renio y el bohrio no tienen funciones biológicas conocidas. Sin embargo, el tecnecio se utiliza en radioimagen.
Contenido relacionado
Xantofila
Munición de percusión anular
Raymond Z. Gallún