El impacto humano en el ciclo del nitrógeno
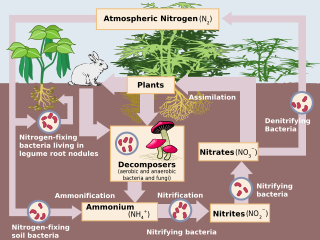

El impacto humano en el ciclo del nitrógeno es diverso. Los aportes de nitrógeno (N) agrícolas e industriales al medio ambiente actualmente superan los aportes provenientes de la fijación natural de N. Como consecuencia de los aportes antropogénicos, el ciclo global del nitrógeno (Fig. 1) se ha alterado significativamente durante el último siglo. Las fracciones molares de óxido nitroso (N2O) atmosférico global han aumentado de un valor preindustrial de ~270 nmol/mol a ~319 nmol/mol en 2005. Las actividades humanas son responsables de más de un tercio de las emisiones de N2O, la mayoría de las cuales se deben al sector agrícola. Este artículo tiene como objetivo brindar una breve revisión de la historia de los aportes antropogénicos de N y los impactos notificados de los aportes de nitrógeno en ecosistemas terrestres y acuáticos seleccionados.
Historia de insumos antropogénicos de nitrógeno
| Tipos de alimentos | Emisiones acidificantes (g SO2proteína eq por 100g) |
|---|---|
| Beef | |
| Queso | |
| Pork | |
| Cordero y Mutton | |
| Farmed Crustaceans | |
| Poultry | |
| Farmed Fish | |
| huevos | |
| Castañas | |
| Peas | |
| Tofu |
Aproximadamente el 78% de la atmósfera de la Tierra es gas N (N2), que es un compuesto inerte y biológicamente no disponible para la mayoría de los organismos. Para ser utilizado en la mayoría de los procesos biológicos, el N2 debe convertirse en nitrógeno reactivo (Nr), que incluye formas inorgánicas reducidas (NH3 y NH4+), formas inorgánicas oxidadas (NO, NO2, HNO3, N2O y NO3−) y compuestos orgánicos (urea, aminas y proteínas). El N2 tiene un triple enlace fuerte, por lo que se requiere una cantidad significativa de energía (226 kcal mol−1) para convertir el N2 en Nr. Antes de los procesos industriales, las únicas fuentes de energía eran la radiación solar y las descargas eléctricas. Utilizando una gran cantidad de energía metabólica y la enzima nitrogenasa, algunas bacterias y cianobacterias convierten el N2 atmosférico en NH3, un proceso conocido como fijación biológica del nitrógeno (FBN). El análogo antropogénico de la FBN es el proceso Haber-Bosch, en el que el H2 reacciona con el N2 atmosférico a altas temperaturas y presiones para producir NH3. Por último, el N2 se convierte en NO mediante la energía de los rayos, que es insignificante en los ecosistemas templados actuales, o mediante la combustión de combustibles fósiles.
Hasta 1850, la biomasa nitrogenada natural, la biomasa nitrogenada inducida por el cultivo (por ejemplo, la plantación de cultivos leguminosos) y la materia orgánica incorporada eran las únicas fuentes de nitrógeno para la producción agrícola. Hacia el cambio de siglo, el nitrógeno de los depósitos de guano y nitrato de sodio se cosechaba y exportaba desde las áridas islas del Pacífico y los desiertos sudamericanos. A fines de la década de 1920, los primeros procesos industriales, aunque ineficientes, se usaban comúnmente para producir NH3. Debido a los esfuerzos de Fritz Haber y Carl Bosch, el proceso Haber-Bosch se convirtió en la mayor fuente de fertilizantes nitrogenados después de la década de 1950 y reemplazó a la biomasa nitrogenada como la fuente dominante de producción de NH3. Entre 1890 y 1990, el nitrógeno creado antropogénicamente aumentó casi nueve veces. Durante este tiempo, la población humana se triplicó, en parte debido al aumento de la producción de alimentos.
Desde la Revolución Industrial, otra fuente de aporte antropogénico de nitrógeno ha sido la combustión de combustibles fósiles, que se utiliza para liberar energía (por ejemplo, para impulsar automóviles). A medida que se queman combustibles fósiles, las altas temperaturas y presiones proporcionan energía para producir NO a partir de la oxidación de N2. Además, cuando se extrae y se quema combustible fósil, el nitrógeno fósil puede volverse reactivo (es decir, emisiones de NOx). Durante la década de 1970, los científicos comenzaron a reconocer que los aportes de nitrógeno se estaban acumulando en el medio ambiente y afectando a los ecosistemas.
Impactos de los insumos antropógenos en el ciclo del nitrógeno
Entre 1600 y 1990, la creación global de nitrógeno reactivo (Nr) había aumentado casi un 50%. Durante este período, las emisiones atmosféricas de especies de Nr aumentaron un 250% y la deposición en ecosistemas marinos y terrestres aumentó más del 200%. Además, se informó de un aumento de cuatro veces en los flujos de N inorgánico disuelto de los ríos hacia las costas. El nitrógeno es un nutriente limitante crítico en muchos sistemas, incluidos los bosques, los humedales y los ecosistemas costeros y marinos; por lo tanto, este cambio en las emisiones y la distribución de Nr ha tenido consecuencias sustanciales para los ecosistemas acuáticos y terrestres.
Atmósfera
| Tipos de alimentos | Emisiones de gases de efecto invernadero (g CO2-Ceq por proteína g) |
|---|---|
| Carne oxidante | |
| Acuicultura recircular | |
| Trawling Fishery | |
| Acuicultura no recirculada | |
| Pork | |
| Poultry | |
| Dairy | |
| Pesquerías no contaminantes | |
| huevos | |
| Starchy Roots | |
| Trigo | |
| Maize | |
| Legumes |
Las entradas de nitrógeno atmosférico incluyen principalmente óxidos de nitrógeno (NOx), amoníaco (NH3) y óxido nitroso (N2O) de los ecosistemas acuáticos y terrestres, y NOx de la combustión de combustibles fósiles y biomasa.
En los agroecosistemas, la aplicación de fertilizantes ha aumentado la nitrificación microbiana (proceso aeróbico en el que los microorganismos oxidan el amonio [NH4+] a nitrato [NO3−]) y la desnitrificación (proceso anaeróbico en el que los microorganismos reducen el NO3− a nitrógeno atmosférico gaseoso [N2]). Ambos procesos liberan naturalmente óxido nítrico (NO) y óxido nitroso (N2O) a la atmósfera. De particular preocupación es el N2O, que tiene una vida atmosférica promedio de 114 a 120 años y es 300 veces más efectivo que el CO2 como gas de efecto invernadero. El NOx producido por los procesos industriales, los automóviles y la fertilización agrícola, y el NH3 emitido por los suelos (es decir, como un subproducto adicional de la nitrificación) y las operaciones ganaderas se transportan a los ecosistemas a sotavento, lo que influye en el ciclo del nitrógeno y las pérdidas de nutrientes. Se han citado seis efectos principales de las emisiones de NOx y NH3: 1) disminución de la visibilidad atmosférica debido a los aerosoles de amonio (materia particulada fina [PM]); 2) concentraciones elevadas de ozono; 3) el ozono y las PM afectan la salud humana (por ejemplo, enfermedades respiratorias, cáncer); 4) aumentos en el forzamiento radiativo y el cambio climático global; 5) disminución de la productividad agrícola debido a la deposición de ozono; y 6) acidificación y eutrofización de los ecosistemas.
Biosfera
Los ecosistemas terrestres y acuáticos reciben aportes de nitrógeno de la atmósfera a través de la deposición húmeda y seca. Las especies atmosféricas de nitrógeno pueden depositarse en los ecosistemas en forma de precipitaciones (p. ej., NO3−, NH4+, compuestos orgánicos de nitrógeno), como gases (p. ej., NH3 y ácido nítrico gaseoso [HNO3]) o como aerosoles (p. ej., nitrato de amonio [NH4NO3]). Los ecosistemas acuáticos reciben nitrógeno adicional de la escorrentía superficial y de los aportes fluviales.
El aumento de la deposición de nitrógeno puede acidificar los suelos, los arroyos y los lagos y alterar la productividad de los bosques y los pastizales. En los ecosistemas de pastizales, los aportes de nitrógeno han producido aumentos iniciales de la productividad seguidos de descensos a medida que se superan los umbrales críticos. También se han demostrado los efectos del nitrógeno sobre la biodiversidad, el ciclo del carbono y los cambios en la composición de las especies. En las zonas altamente desarrolladas de los sistemas costeros oceánicos y estuarinos cercanos a la costa, los ríos aportan aportes directos (por ejemplo, escorrentía superficial) e indirectos (por ejemplo, contaminación de las aguas subterráneas) de nitrógeno procedentes de los agroecosistemas. El aumento de los aportes de nitrógeno puede dar lugar a la acidificación del agua dulce y a la eutrofización de las aguas marinas.
Ecosistemas terrestres
Impactos en la productividad y el ciclismo de nutrientes
Gran parte del crecimiento terrestre en los sistemas templados está limitado por el nitrógeno; por lo tanto, los aportes de nitrógeno (es decir, a través de la deposición y la fertilización) pueden aumentar la disponibilidad de nitrógeno, lo que aumenta temporalmente la absorción de nitrógeno, el crecimiento de las plantas y los microbios, y la acumulación de nitrógeno en la biomasa de las plantas y la materia orgánica del suelo. La incorporación de mayores cantidades de nitrógeno en la materia orgánica disminuye las relaciones C:N, lo que aumenta la liberación de nitrógeno mineral (NH4+) durante la descomposición de la materia orgánica por microbios heterotróficos (es decir, amonificación). A medida que aumenta la amonificación, también lo hace la nitrificación del nitrógeno mineralizado. Debido a que la nitrificación y la desnitrificación microbianas son "permeables", se espera que la deposición de nitrógeno aumente las emisiones de gases traza. Además, con el aumento de la acumulación de NH4+ en el suelo, los procesos de nitrificación liberan iones de hidrógeno, que acidifican el suelo. El NO3−, producto de la nitrificación, es muy móvil y puede lixiviarse del suelo junto con minerales alcalinos con carga positiva, como el calcio y el magnesio. En suelos ácidos, los iones de aluminio movilizados pueden alcanzar concentraciones tóxicas, lo que afecta negativamente tanto a los ecosistemas terrestres como a los acuáticos adyacentes.
Las fuentes antropogénicas de N generalmente llegan a los bosques de tierras altas a través de la deposición. Una posible preocupación del aumento de la deposición de N debido a las actividades humanas es la alteración del ciclo de nutrientes en los ecosistemas forestales. Numerosos estudios han demostrado impactos tanto positivos como negativos de la deposición atmosférica de N en la productividad forestal y el almacenamiento de carbono. El N añadido suele ser inmovilizado rápidamente por los microbios, y el efecto del N restante disponible depende de la capacidad de la comunidad vegetal para absorber N. En sistemas con alta absorción, el N se asimila en la biomasa vegetal, lo que conduce a una mayor productividad primaria neta (NPP) y posiblemente a un mayor secuestro de carbono a través de una mayor capacidad fotosintética. Sin embargo, las respuestas del ecosistema a las adiciones de N dependen de muchos factores específicos del sitio, incluidos el clima, el historial de uso de la tierra y la cantidad de adiciones de N. Por ejemplo, en el noreste de los Estados Unidos, las masas de madera dura que reciben aportes crónicos de N han demostrado una mayor capacidad para retener N y aumentar la productividad primaria neta anual (ANPP) que las masas de coníferas. Una vez que el aporte de N excede la demanda del sistema, el N puede perderse a través de la lixiviación y los flujos de gas. Cuando el nitrógeno disponible excede la capacidad de absorción del ecosistema (es decir, vegetación, suelo, microbios, etc.), se produce una saturación de nitrógeno y el exceso de nitrógeno se pierde en las aguas superficiales, subterráneas y en la atmósfera. La saturación de nitrógeno puede provocar desequilibrios de nutrientes (por ejemplo, pérdida de calcio debido a la lixiviación de nitratos) y una posible disminución de los bosques.
Un estudio de 15 años sobre las adiciones crónicas de nitrógeno en el programa de Investigación Ecológica a Largo Plazo (LTER) de la Universidad de Harvard ha esclarecido muchos de los impactos del aumento de la deposición de nitrógeno en el ciclo de nutrientes en los bosques templados. Se encontró que las adiciones crónicas de nitrógeno dieron lugar a mayores pérdidas por lixiviación, mayor mortalidad de pinos y cese de la acumulación de biomasa. Otro estudio informó que las adiciones crónicas de nitrógeno dieron lugar a la acumulación de nitrógeno no fotosintético y, posteriormente, redujeron la capacidad fotosintética, lo que supuestamente condujo a un grave estrés de carbono y a la mortalidad. Estos hallazgos niegan las hipótesis anteriores de que el aumento de las entradas de nitrógeno aumentaría la producción neta de nitrógeno y el secuestro de carbono.
Impactos en la diversidad de especies vegetales
Muchas comunidades vegetales han evolucionado en condiciones de bajos nutrientes; por lo tanto, el aumento de los aportes de N puede alterar las interacciones bióticas y abióticas, lo que lleva a cambios en la composición de la comunidad. Varios estudios de adición de nutrientes han demostrado que el aumento de los aportes de N conduce al predominio de especies vegetales de rápido crecimiento, con disminuciones asociadas en la riqueza de especies. Las especies de rápido crecimiento tienen una mayor afinidad por la absorción de nitrógeno y desplazarán a las especies vegetales de crecimiento más lento al bloquear el acceso a la luz solar con su mayor biomasa sobre el suelo. Otros estudios han descubierto que las respuestas secundarias del sistema al enriquecimiento de N, incluida la acidificación del suelo y los cambios en las comunidades micorrízicas, han permitido que las especies tolerantes al estrés superen a las especies sensibles. Los árboles que tienen asociaciones micorrízicas arbusculares tienen más probabilidades de beneficiarse de un aumento en el nitrógeno del suelo, ya que estos hongos son incapaces de descomponer el nitrógeno orgánico del suelo. Otros dos estudios encontraron evidencia de que el aumento de la disponibilidad de N ha resultado en disminuciones en brezales con diversidad de especies. Los brezales se caracterizan por suelos pobres en N, que excluyen las gramíneas demandantes de N; Sin embargo, con el aumento de la deposición de nitrógeno y la acidificación del suelo, los pastizales invasores reemplazan a los brezales de las tierras bajas.
En un estudio experimental más reciente de fertilización con N y perturbación (es decir, labranza) en sucesiones de campos antiguos, se encontró que la riqueza de especies disminuía con el aumento de N, independientemente del nivel de perturbación. Los experimentos de competencia mostraron que los dominantes competitivos excluían a las especies competitivamente inferiores entre eventos de perturbación. Con mayores aportes de N, la competencia se desplazó del subsuelo al subsuelo (es decir, competencia por luz), y las tasas de colonización de parches disminuyeron significativamente. Estos cambios internos pueden afectar dramáticamente a la comunidad al cambiar el equilibrio de las compensaciones competencia-colonización entre especies. En sistemas basados en parches, la coexistencia regional puede ocurrir a través de compensaciones en las habilidades competitivas y colonizadoras dadas tasas de perturbación suficientemente altas. Es decir, con una clasificación inversa de las habilidades competitivas y colonizadoras, las plantas pueden coexistir en el espacio y el tiempo a medida que la perturbación elimina a los competidores superiores de los parches, lo que permite el establecimiento de colonizadores superiores. Sin embargo, como demostraron Wilson y Tilman, el aumento de los aportes de nutrientes puede anular las compensaciones, lo que resulta en la exclusión competitiva de estos colonizadores superiores/competidores pobres.
Ecosistemas acuáticos
Los ecosistemas acuáticos también muestran respuestas variadas al enriquecimiento de nitrógeno. La carga de NO3− de los ecosistemas terrestres saturados de N puede provocar la acidificación de los sistemas de agua dulce aguas abajo y la eutrofización de los sistemas marinos aguas abajo. La acidificación del agua dulce puede causar toxicidad por aluminio y mortalidad de especies de peces sensibles al pH. Debido a que los sistemas marinos generalmente tienen un contenido limitado de nitrógeno, los aportes excesivos de N pueden provocar la degradación de la calidad del agua debido a floraciones de algas tóxicas, deficiencia de oxígeno, pérdida de hábitat, disminución de la biodiversidad y pérdidas de pesca.
Acidificación de las aguas dulces
La deposición atmosférica de nitrógeno en paisajes terrestres puede transformarse a través de procesos microbianos del suelo en nitrógeno biológicamente disponible, lo que puede provocar la acidificación de las aguas superficiales y la pérdida de biodiversidad. Los aportes de NO3− y NH4+ de los sistemas terrestres y la atmósfera pueden acidificar los sistemas de agua dulce cuando hay poca capacidad de amortiguación debido a la acidificación del suelo. La contaminación por nitrógeno en Europa, el noreste de los Estados Unidos y Asia es una preocupación actual por la acidificación del agua dulce. Los estudios de acidificación de lagos en el Área Experimental de Lagos (ELA) en el noroeste de Ontario demostraron claramente los efectos negativos del aumento de la acidez en una especie de pez nativo: el reclutamiento y el crecimiento de la trucha de lago (Salvelinus namaycush) disminuyeron drásticamente debido a la extirpación de sus principales especies de presas durante la acidificación. El nitrógeno reactivo proveniente de la agricultura, la cría de animales, los fertilizantes, los sistemas sépticos y otras fuentes han aumentado las concentraciones de nitrato en las vías fluviales de la mayoría de las naciones industrializadas. Las concentraciones de nitratos en 1.000 lagos noruegos se han duplicado en menos de una década. Los ríos del noreste de Estados Unidos y la mayor parte de Europa han aumentado de diez a quince veces durante el último siglo. El nitrógeno reactivo puede contaminar el agua potable a través de su escorrentía hacia arroyos, lagos, ríos y aguas subterráneas. Sólo en Estados Unidos, hasta un 20% de las fuentes de agua subterránea superan el límite de concentración de nitratos en el agua potable establecido por la Organización Mundial de la Salud. Estas altas concentraciones pueden causar la "enfermedad del bebé azul", en la que los iones de nitrato debilitan la capacidad de la sangre para transportar oxígeno. Los estudios también han vinculado las altas concentraciones de nitratos a problemas reproductivos y a la propensión a algunos cánceres, como el de vejiga y el de ovario.
Eutrophication of marine systems
La urbanización, la deforestación y las actividades agrícolas contribuyen en gran medida a la entrada de sedimentos y nutrientes a las aguas costeras a través de los ríos. El aumento de la entrada de nutrientes a los sistemas marinos ha demostrado tanto aumentos a corto plazo de la productividad y el rendimiento pesquero como efectos perjudiciales a largo plazo de la eutrofización. La triplicación de las cargas de NO3− en el río Misisipi en la segunda mitad del siglo XX se ha correlacionado con un aumento de los rendimientos pesqueros en las aguas que rodean el delta del Misisipi; sin embargo, estas entradas de nutrientes han producido hipoxia estacional (concentraciones de oxígeno inferiores a 2-3 mg L−1, "zonas muertas") en el Golfo de México. En los sistemas estuarinos y costeros, las altas entradas de nutrientes aumentan la producción primaria (p. ej., fitoplancton, pastos marinos, macroalgas), lo que aumenta la turbidez con la consiguiente disminución de la penetración de la luz en toda la columna de agua. En consecuencia, el crecimiento de la vegetación sumergida disminuye, lo que reduce la complejidad del hábitat y la producción de oxígeno. El aumento de la producción primaria (es decir, fitoplancton, macroalgas, etc.) conduce a un flujo de carbono hacia las aguas del fondo cuando la materia orgánica en descomposición (es decir, la producción primaria senescente) se hunde y es consumida por bacterias aeróbicas en la parte inferior de la columna de agua. Como resultado, el consumo de oxígeno en las aguas del fondo es mayor que la difusión de oxígeno desde las aguas superficiales. Además, ciertas floraciones de algas denominadas floraciones de algas nocivas (FAN) producen toxinas que pueden actuar como compuestos neuromusculares o dañinos para los órganos. Estas floraciones de algas pueden ser dañinas para otras formas de vida marina, así como para los seres humanos.
Integración
Las respuestas de los sistemas antes mencionados a los aportes de nitrógeno reactivo (Nr) se estudian casi exclusivamente por separado; sin embargo, las investigaciones indican cada vez más que los problemas de carga de nitrógeno están vinculados por múltiples vías que transportan nutrientes a través de los límites del sistema. Esta transferencia secuencial entre ecosistemas se denomina cascada de nitrógeno (véase la ilustración del Programa de las Naciones Unidas para el Medio Ambiente). Durante la cascada, algunos sistemas acumulan Nr, lo que da lugar a un desfase temporal en la cascada y a mayores efectos del Nr en el entorno en el que se acumula. En última instancia, los aportes antropogénicos de Nr se acumulan o se desnitrifican; sin embargo, se ha avanzado poco en la determinación de la importancia relativa de la acumulación y la desnitrificación de Nr, lo que se ha debido principalmente a una falta de integración entre las disciplinas científicas.
La mayor parte del Nr aplicado a los agroecosistemas globales se transmite en cascada a través de la atmósfera y los ecosistemas acuáticos y terrestres hasta que se convierte en N2, principalmente a través de la desnitrificación. Aunque la desnitrificación terrestre produce intermediarios gaseosos (óxido nítrico [NO] y óxido nitroso [N2O]), el último paso —la producción microbiana de N2— es fundamental porque el N2 atmosférico es un sumidero de Nr. Muchos estudios han demostrado claramente que las franjas de amortiguación y los humedales gestionados pueden eliminar cantidades significativas de nitrato (NO3−) de los sistemas agrícolas a través de la desnitrificación. Este tipo de gestión puede ayudar a atenuar los efectos en cascada indeseables y eliminar la acumulación de Nr en el medio ambiente.
Las actividades humanas dominan los ciclos globales y regionales del nitrógeno. Los aportes de nitrógeno han demostrado tener consecuencias negativas tanto para el ciclo de nutrientes como para la diversidad de especies nativas en los sistemas terrestres y acuáticos. De hecho, debido a los impactos a largo plazo en las redes alimentarias, los aportes de nitrógeno se consideran ampliamente el problema de contaminación más crítico en los sistemas marinos. En los ecosistemas terrestres y acuáticos, las respuestas al enriquecimiento de nitrógeno varían; sin embargo, un tema general recurrente es la importancia de los umbrales (por ejemplo, la saturación de nitrógeno) en la capacidad de retención de nutrientes del sistema. Para controlar la cascada de nitrógeno, debe haber una integración de disciplinas científicas y más trabajo sobre el almacenamiento de nitrógeno y las tasas de desnitrificación.
Véase también
- Límites planetarios
Referencias
- ^ a b c d e f h i j k l m n o p q r s t Galloway, J. N.; Aber, J. D.; Erisman, J. N. W.; Seitzinger, S. P.; Howarth, R. W.; Cowling, E. B.; Cosby, B. J. (2003). "La Cascada del Nitrógeno". BioScience. 53 (4): 341. doi:10.1641/0006-3568(2003)053[0341:TNC]2.0.CO;2. S2CID 3356400.
- ^ a b Alley et al. 2007. IPCC Climate Change 2007: The Physical Science Basis. Contribution of Working Group I in the Third Assessment Report of Intergovernmental Panel on Climate Change. Report Summary for Policy Makers (SPM) Archivado 2011-07-16 en el Wayback Machine.
- ^ Nemecek, T.; Poore, J. (2018-06-01). "Reducir los impactos ambientales de los alimentos a través de productores y consumidores". Ciencia. 360 (6392): 987 –992. Bibcode:2018Sci...360..987P. doi:10.1126/science.aaaq0216. ISSN 0036-8075. PMID 29853680. S2CID 206664954.
- ^ a b c d e f Schlesinger, W. H. 1997. Biogeoquímica: Un análisis del cambio mundialSan Diego, CA.
- ^ a b c d Smil, V. 2001. Enriqueciendo la tierra: Fritz Haber, Carl Bosch, y la transformación de la producción mundial de alimentos. MIT Prensa, Cambridge, MA.
- ^ a b c d Galloway, James N.; Cowling, Ellis B. (2002). "Nitrógeno reactiva y el mundo: 200 años de cambio". Ambio: A Journal of the Human Environment. 31 2): 64–71. Bibcode:2002Ambio..31...64G. doi:10.1579/0044-7447-31.2.64 PMID 12078011. S2CID 8104525.
- ^ Vitousek, P.; Howarth, R. (1991). " Limitación nitrógeno en tierra y en el mar: ¿Cómo puede ocurrir?". Biogeoquímica. 13 2) doi:10.1007/BF00002772. S2CID 93106377.
- ^ a b c d e f g h Rabalais, Nancy N. (2002). "Nitrógeno en ecosistemas acuáticos". Ambio: A Journal of the Human Environment. 31 2): 102 –12. doi:10.1639/0044-7447(2002)031[0102:NIAE]2.0.CO;2. PMID 12077998.
- ^ Michael Clark; Tilman, David (noviembre de 2014). "Las dietas globales vinculan la sostenibilidad ambiental y la salud humana". Naturaleza. 515 (7528): 518 –522. Bibcode:2014Natur.515..518T. doi:10.1038/nature13959. ISSN 1476-4687. S2CID 4453972.
- ^ John T. Houghton, Y. Ding, D. J. Griggs, M. Noguer, P. J. van der Linden, X. Dai, K. Maskell y C. A. Johnson. 2001. IPCC Climate Change 2001: The Scientific Basis. Contribution of Working Group I in the Third Assessment Report of Intergovernmental Panel on Climate Change. Cambridge University Press]
- ^ a b Houdijk, A. L. F. M.; Verbeek, P. J. M.; Dijk, H. F. G.; Roelofs, J. G. M. (1993). "Distribución y declinación de especies herbáceas amenazadas en relación con la composición química del suelo". Planta y suelo. 148 1): 137 –143. Bibcode:1993PlSoi.148..137H. doi:10.1007/BF02185393. S2CID 22600629.
- ^ a b Aber, J. D., K. J. Nadelhoffer, P. Steudler y J. M. Melillo. 1989. "Saturación nitrógeno en los ecosistemas forestales del norte". Biociencia 39:378–386
- ^ a b Aber, J. D. (1992). "El ciclismo nitrógeno y la saturación de nitrógeno en los ecosistemas forestales templados". Tendencias en la Ecología " Evolución. 7 (7): 220 –224. doi:10.1016/0169-5347(92)90048-G. PMID 21236013.
- ^ Matson, P; Lohse, KA; Hall, SJ (2002). "La globalización de la deposición del nitrógeno: consecuencias para los ecosistemas terrestres". Ambio. 31 2): 113–9. doi:10.1639/0044-7447(2002)031[0113:tgondc]2.0.co;2. JSTOR 4315223. PMID 12077999.
- ^ Aber, John D.; Goodale, Christine L.; Ollinger, Scott V.; Smith, Marie-Louise; Magill, Alison H.; Martin, Mary E.; Hallett, Richard A.; Stoddard, John L. (2003). "¿Es la deposición del nitrógeno alterando el estado del nitrógeno de los bosques del noreste?". BioScience. 53 (4): 375. doi:10.1641/0006-3568(2003)053[0375:INDATN]2.0.CO;2. JSTOR 1314369. S2CID 54037020.
- ^ Nadelhoffer, K. J.; Downs, M. R.; Fry, B. (1999). "Sinks For15N-Enriched Additions to an Oak Forest and a Red Pine Plantation". Aplicaciones ecológicas. 9: 72–86. doi:10.1890/1051-0761(1999)009[0072:SFNEAT]2.0.CO;2.
- ^ a b c Bauer, G. A.; Bazzaz, F. A.; Minocha, R.; Long, S.; Magill, A.; Aber, J.; Berntson, G. M. (2004). "Efectos de adiciones N crónicas sobre química de tejido, capacidad fotosintética, y potencial de secuestro de carbono de un pino rojo (Pinus resinosa Ait.) están en los Estados Unidos NE". Forest Ecology and Management. 196: 173–186. doi:10.1016/j.foreco.2004.03.032.
- ^ a b c Magill, A. H.; Aber, J. D.; Currie, W. S.; Nadelhoffer, K. J.; Martin, M. E.; McDowell, W. H.; Melillo, J. M.; Steudler, P. (2004). "Respuesta del ecosistema a 15 años de adiciones crónicas de nitrógeno en el Bosque de Harvard LTER, Massachusetts, Estados Unidos". Forest Ecology and Management. 196: 7-28. doi:10.1016/j.foreco.2004.03.033.
- ^ Laura Foster Huenneke; Steven P. Hamburg; Roger Koide; Harold A. Mooney; Peter M. Vitousek (1990). "Efectos de los recursos del suelo sobre invasión vegetal y estructura comunitaria en la Serpentina Californiana Grasland". Ecología. 71 2): 478 –491. Bibcode:1990Ecol...71..478H. doi:10.2307/1940302. JSTOR 1940302.
- ^ Tilman, D. (1997). "Invasibilidad comunitaria, limitación de reclutamiento y biodiversidad de pastizales". Ecología. 78: 81 –83. doi:10.1890/0012-9658(1997)078[0081:CIRLAG]2.0.CO;2.
- ^ a b c Wilson, S. D.; Tilman, D. (2002). "Diferenciación Quadratica en las especies de antaño Riqueza a lo largo de los ingredientes de la perturbación y el nitrógeno". Ecología. 83 (2): 492. doi:10.1890/0012-9658(2002)083[0492:QVIOFS]2.0.CO;2.
- ^ Wamelink, G.W.; van Dobben, H.F.; Mol-Dijkstra, J.P.; Schouwenberg, E.P.A.G.; Kros, J.; de Vries, W.; Berendse, F. (septiembre de 2009). "Efecto de la reducción de la deposición de nitrógeno sobre biodiversidad y secuestro de carbono". Forest Ecology and Management. 258 (8): 1774 –1779. doi:10.1016/j.foreco.2008.10.024.
- ^ Egerton-Warburton, L. M.; Allen, E. B. (2000). "Hifts in Arbuscular Mycorrhizal Communities along antropogenic Nitrogen Deposition Gradient". Aplicaciones ecológicas. 10 (2): 484. doi:10.1890/1051-0761(2000)010[0484:SIAMCA]2.0.CO;2.
- ^ Quinn Thomas, R; Canham, Charles D.; Weathers, Kathleen C.; Goodale, Christine L. (22 de diciembre de 2009). "Aumento de almacenamiento de carbono de árboles en respuesta a la deposición de nitrógeno en Estados Unidos". Nature Geoscience. 3 1): 13 –17. doi:10.1038/ngeo721. ISSN 1752-0908.
- ^ Aertes, Rien; Berendse, Frank (agosto de 1988). "El efecto del aumento de la disponibilidad de nutrientes en la dinámica de la vegetación en las tierras húmedas". Vegetatio. 76 ()1 –2): 63–69. doi:10.1007/BF00047389. ISSN 0042-3106. S2CID 34882407.
- ^ Bobbink, R. Heil, G. W.; Raessen, M. B. (1992). "Procesos de deposición atmosférica y canopy canopy en ecosistemas heathland". Environmental Pollution. 75 1): 29–37. Bibcode:1992EPoll..75...29B. doi:10.1016/0269-7491(92)90053-D. PMID 15092046.
- ^ Hastings, A. (1980). "Disturbance, coexistencia, historia y competencia por el espacio". Biología de la población. 18 3): 363 –373. doi:10.1016/0040-5809(80)90059-3.
- ^ Driscoll, C. T., G. B. Lawrence, A. J. Bulger, T. J. Butler, C. S. Cronan, C. Eagar, K. F. Lambert, G. E. Likens, J. L. Stoddard, and K. C. Weathers. 2001 Acidic Deposition in the Northeastern United States: Sources and Inputs, Ecosystem Effects, and Management Strategies. pp. 180-198
- ^ Mills, K. H.; Chalanchuk, S. M.; Allan, D. J. (2000). "Recovery of fish populations in Lake 223 from experimental acidification". Canadian Journal of Fisheries and Aquatic Sciences. 57: 192 –204. doi:10.1139/f99-186.
- ^ Fields, Scott (julio de 2004). "Nitrógeno Global: Ciclismo fuera de control". Environmental Health Perspectives. 112 (10): A556 – A563. doi:10.1289/ehp.112-a556. PMC 1247398. PMID 15238298.
- ^ Grimes, Churchill B. (2001). "Fishery Production and the Mississippi River Discharge". Pesca. 26 (8): 17 –26. Bibcode:2001Fish...26g..17G. doi:10.1577/1548-8446(2001)026 se hizo realidad0017:FPATMR conviene2.0.CO;2.
- ^ Skulberg, Olav M.; Codd, Geoffrey A.; Carmichael, Wayne W. (1984-01-01). "Toxic Blue-Green Algal Blooms in Europe: A Growing Problem". Ambio. 13 4): 244–247. JSTOR 4313034.
- ^ Smith, V.H.; Tilman, G.D.; Nekola, J.C. (1999). "Eutrophication: impacts of excess nutrient inputs on freshwater, marine, and terrestrial ecosystems". Environmental Pollution. 100 ()1 –3): 179 –196. doi:10.1016/s0269-7491(99)00091-3. PMID 15093117. S2CID 969039.
- ^ a b c Davidson, E. A.; Seitzinger, S. (2006). "El Enigma del Progreso en la Investigación de la Denitrificación". Aplicaciones ecológicas. 16 (6): 2057–2063. doi:10.1890/1051-0761(2006)016[2057:TEOPID]2.0.CO;2. PMID 17205889.
- ^ Jackson, R. D.; Allen-Diaz, B.; Oates, L. G.; Tate, K. W. (2006). "Número de aguas residuales aumentado con la eliminación de pasto de ganado en un Savanna de California Oak". Ecosystems. 9 (2): 254. Código:2006Ecosy...9..254J. doi:10.1007/s10021-005-0166-7. S2CID 24450808.
- ^ Galloway, J. N.; Dentener, F. J.; Capone, D. G.; Boyer, E. W.; Howarth, R. W.; Seitzinger, S. P.; Asner, G. P.; Cleveland, C.; Green, P. A.; Holland, E. A.; Karl, D. M.; Michaels, A. F. H.; Porter (2004) "Cículos nitrógenos: pasado, presente y futuro" (PDF). Biogeoquímica. 70 (2): 153. Código:2004Biogc...70..153G. doi:10.1007/s10533-004-0370-0. JSTOR 4151466. S2CID 98109580. Archivado desde el original (PDF) el 2005-11-11.
Más lectura
- Bien, A. G.; Beatty, P. H. (2011). "Fertilizar la naturaleza: Una tragedia de la Excesidad en los Comunes". PLOS Biología. 9 (8): e1001124. doi:10.1371/journal.pbio.1001124. PMC 3156687. PMID 21857803..
- Scarsbrook M.; Barquin J.; Gray D. (2007). Nueva Zelanda agua fría y su biodiversidad (PDF). ISBN 978-0-478-14289-1. ISSN 1173-2946.
{{cite book}}:|journal=ignorado (ayuda) - Olde Venterink, H.; Wassen, M. J.; Verkroost, A. W. M.; De Ruiter, P. C. (2003). "La riqueza de las especies – los patrones de productividad difieren entre los humedales de N, P y K" (PDF). Ecología. 84 (8): 2191–2199. Bibcode:2003Ecol...84.2191O. doi:10.1890/01-0639. JSTOR 3450042. Archivado desde el original (PDF) on 2016-03. Retrieved 2009-09-03.