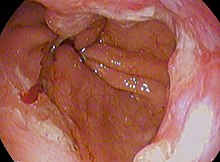
El esófago de Barrett
El esófago de Barrett es una afección en la que hay un cambio anormal (metaplásico) en las células de la mucosa que recubren la porción inferior del esófago, de epitelio escamoso estratificado a epitelio cilíndrico simple con células caliciformes intercaladas que normalmente están presentes solo en el intestino delgado y el intestino grueso. Este cambio se considera una condición premaligna porque está asociado con una alta incidencia de transición adicional a adenocarcinoma esofágico, un cáncer que a menudo es mortal.
Se cree que la causa principal del esófago de Barrett es una adaptación a la exposición crónica al ácido por esofagitis por reflujo. El esófago de Barrett se diagnostica mediante endoscopia: observando el aspecto característico de esta afección mediante inspección directa del esófago inferior; seguido de un examen microscópico del tejido del área afectada obtenido de una biopsia. Las células del esófago de Barrett se clasifican en cuatro categorías: no displásicas, displasia de bajo grado, displasia de alto grado y carcinoma franco. La displasia de alto grado y las primeras etapas del adenocarcinoma pueden tratarse mediante resección endoscópica o ablación por radiofrecuencia. Las etapas posteriores del adenocarcinoma se pueden tratar con resección quirúrgica o paliación. Aquellos con displasia no displásica o de bajo grado se manejan mediante observación anual con endoscopia o tratamiento con ablación por radiofrecuencia. En la displasia de alto grado, el riesgo de desarrollar cáncer puede ser del 10 % por paciente-año o más.
La incidencia del adenocarcinoma esofágico ha aumentado sustancialmente en el mundo occidental en los últimos años. La condición se encuentra en 5 a 15% de los pacientes que buscan atención médica por acidez estomacal (enfermedad por reflujo gastroesofágico o ERGE), aunque un gran subgrupo de pacientes con esófago de Barrett son asintomáticos. La afección lleva el nombre del cirujano Norman Barrett (1903–1979), aunque Philip Rowland Allison la describió originalmente en 1946.
Signos y síntomas
El cambio de células normales a premalignas indica que el esófago de Barrett no causa ningún síntoma en particular. Sin embargo, el esófago de Barrett está asociado con estos síntomas:
- acidez de corazón frecuente y larga
- problemas para tragar (disfagia)
- vómitos de sangre (hematemesis)
- dolor bajo el esterno donde el esófago encuentra el estómago
- dolor al tragar (odynofagia), que puede conducir a la pérdida de peso no intencional
El riesgo de desarrollar esófago de Barrett aumenta con la obesidad central (frente a la obesidad periférica). El mecanismo exacto no está claro. La diferencia en la distribución de la grasa entre hombres (más central) y mujeres (más periférica) puede explicar el mayor riesgo en los hombres.
Fisiopatología

El esófago de Barrett se produce debido a una inflamación crónica. La causa principal de la inflamación crónica es la enfermedad por reflujo gastroesofágico, ERGE (Reino Unido: ERGE). En esta enfermedad, el contenido ácido del estómago, la bilis y el intestino delgado y el páncreas daña las células del esófago inferior. A su vez, esto provoca una ventaja para las células más resistentes a estos estímulos nocivos, en particular las células madre que expresan HOXA13 que se caracterizan por características distales (intestinales) y superan a las células escamosas normales.
Este mecanismo también explica la selección de HER2/neu (también llamado ERBB2) y las células cancerosas que sobreexpresan (adictos al linaje) durante el proceso de carcinogénesis, y la eficacia de la terapia dirigida contra el receptor Her-2 con trastuzumab (Herceptin) en el tratamiento de adenocarcinomas en la unión gastroesofágica.
Los investigadores no pueden predecir quién con acidez estomacal desarrollará esófago de Barrett. Si bien no existe una relación entre la gravedad de la acidez estomacal y el desarrollo del esófago de Barrett, sí existe una relación entre la acidez estomacal crónica y el desarrollo del esófago de Barrett. A veces, las personas con esófago de Barrett no presentan ningún síntoma de acidez estomacal.
Alguna evidencia anecdótica indica que las personas con el trastorno alimentario bulimia tienen más probabilidades de desarrollar esófago de Barrett porque la bulimia puede causar reflujo ácido severo y porque la purga también inunda el esófago con ácido. Sin embargo, aún no se ha demostrado un vínculo entre la bulimia y el esófago de Barrett.
Durante los episodios de reflujo, los ácidos biliares ingresan al esófago y esto puede ser un factor importante en la carcinogénesis. Las personas con GERD y BE están expuestas a altas concentraciones de ácido desoxicólico que tiene efectos citotóxicos y puede dañar el ADN.
Diagnóstico

Se requieren resultados positivos tanto macroscópicos (de la endoscopia) como microscópicos para hacer un diagnóstico. El esófago de Barrett se caracteriza por la presencia de epitelio cilíndrico en la parte inferior del esófago, que reemplaza al epitelio normal de células escamosas, un ejemplo de metaplasia. El epitelio cilíndrico secretor puede resistir mejor la acción erosiva de las secreciones gástricas; sin embargo, esta metaplasia confiere un mayor riesgo de adenocarcinoma.
Proyección
Se recomienda la endoscopia de detección entre los hombres mayores de 60 años que tienen síntomas de reflujo que son de larga duración y no controlables con tratamiento. Entre los que no se espera que vivan más de cinco años, no se recomienda la detección.
El protocolo de Seattle se usa comúnmente en endoscopia para obtener biopsias endoscópicas para detección, tomadas cada 1 a 2 cm desde la unión gastroesofágica.
Desde la pandemia de COVID-19 en Escocia, el NHS local comenzó a usar una esponja que se puede tragar (Cytosponge) en los hospitales para recolectar muestras de células para el diagnóstico. Los estudios preliminares han demostrado que esta prueba de diagnóstico es una herramienta útil para evaluar a las personas con síntomas de acidez estomacal y mejorar el diagnóstico.
Metaplasia intestinal
La presencia de células caliciformes, denominada metaplasia intestinal, es necesaria para hacer un diagnóstico de esófago de Barrett. Esto ocurre con frecuencia en presencia de otras células columnares metaplásicas, pero solo la presencia de células caliciformes es diagnóstica. La metaplasia es visible a simple vista a través de un gastroscopio, pero las muestras de biopsia deben examinarse con un microscopio para determinar si las células son de naturaleza gástrica o colónica. La metaplasia colónica generalmente se identifica al encontrar células caliciformes en el epitelio y es necesaria para el diagnóstico verdadero.
Se conocen muchas imitaciones histológicas del esófago de Barrett (es decir, células caliciformes que se encuentran en el epitelio de transición de los conductos de las glándulas submucosas esofágicas normales, "células pseudocaliciformes" en las que abundante mucina foveolar [gástrica] simula las células caliciformes verdaderas de mucina ácida). La evaluación de la relación con las glándulas submucosas y el epitelio de tipo transicional con el examen de múltiples niveles a través del tejido puede permitir que el patólogo distinga de manera confiable entre las células caliciformes de los conductos de las glándulas submucosas y el esófago de Barrett verdadero (metaplasia columnar especializada). La tinción histoquímica con azul alcián de pH 2,5 también se usa con frecuencia para distinguir las verdaderas mucinas de tipo intestinal de sus imitadores histológicos. Recientemente, el análisis inmunohistoquímico con anticuerpos contra CDX-2 (específicos para la derivación intestinal del intestino medio y posterior) también se ha utilizado para identificar verdaderas células metaplásicas de tipo intestinal. La proteína AGR2 está elevada en el esófago de Barrett y puede usarse como biomarcador para distinguir el epitelio de Barrett del epitelio esofágico normal.
La presencia de metaplasia intestinal en el esófago de Barrett representa un marcador de la progresión de la metaplasia hacia la displasia y, finalmente, el adenocarcinoma. Este factor combinado con dos expresiones inmunohistoquímicas diferentes de p53, Her2 y p16 conduce a dos vías genéticas diferentes que probablemente progresen a displasia en el esófago de Barrett. También las células metaplásicas intestinales pueden ser positivas para CK 7+/CK20-.
Displasia epitelial
Después de que se realiza el diagnóstico inicial de esófago de Barrett, las personas afectadas se someten a vigilancia anual para detectar cambios que indiquen un mayor riesgo de progresión a cáncer: desarrollo de displasia epitelial (o "neoplasia intraepitelial"). Entre todas las lesiones metaplásicas, alrededor del 8% se asociaron con displasia. particularmente un estudio reciente demostró que las lesiones displásicas se localizaban principalmente en la pared posterior del esófago.
Se observa una variabilidad considerable en la evaluación de la displasia entre los patólogos. Recientemente, las sociedades de gastroenterología y patología GI han recomendado que cualquier diagnóstico de displasia de alto grado en Barrett sea confirmado por al menos dos patólogos GI capacitados antes del tratamiento definitivo de los pacientes. Para una mayor precisión y reproducibilidad, también se recomienda seguir los sistemas de clasificación internacionales, como la "clasificación de Viena" de neoplasia epitelial gastrointestinal (2000).
Administración
Muchas personas con esófago de Barrett no tienen displasia. Las sociedades médicas recomiendan que si un paciente tiene esófago de Barrett, y si los últimos dos exámenes de endoscopia y biopsia han confirmado la ausencia de displasia, entonces el paciente no debe someterse a otra endoscopia dentro de los tres años.
A menudo se recomienda la vigilancia endoscópica de personas con esófago de Barrett, aunque poca evidencia directa apoya esta práctica. Las opciones de tratamiento para la displasia de alto grado incluyen la extirpación quirúrgica del esófago (esofagectomía) o tratamientos endoscópicos como la resección o ablación (destrucción) de la mucosa endoscópica.
El riesgo de malignidad es más alto en los Estados Unidos en hombres caucásicos mayores de cincuenta años con más de cinco años de síntomas. Las recomendaciones actuales incluyen endoscopia y biopsia de rutina (en busca de cambios displásicos). Aunque en el pasado los médicos han adoptado un enfoque de espera vigilante, la investigación recientemente publicada respalda la consideración de la intervención para el esófago de Barrett. La ablación por radiofrecuencia con globo, inventada por Ganz, Stern y Zelickson en 1999, es una nueva modalidad de tratamiento para el esófago de Barrett y la displasia y ha sido objeto de numerosos ensayos clínicos publicados. Los hallazgos demuestran que la ablación por radiofrecuencia es al menos un 90 % efectiva para eliminar por completo el esófago y la displasia de Barrett, con una durabilidad de hasta cinco años y un perfil de seguridad favorable.
No se ha demostrado que la cirugía antirreflujo prevenga el cáncer de esófago. Sin embargo, la indicación es que los inhibidores de la bomba de protones son efectivos para limitar la progresión del cáncer de esófago. El tratamiento con láser se usa en la displasia grave, mientras que la malignidad manifiesta puede requerir cirugía, radioterapia o quimioterapia sistémica. Un ensayo controlado aleatorio reciente de cinco años ha demostrado que la terapia fotodinámica con Photofrin es estadísticamente más eficaz para eliminar las áreas de crecimiento displásico que el uso exclusivo de un inhibidor de la bomba de protones.
Actualmente, no existe una forma confiable de determinar qué pacientes con esófago de Barrett desarrollarán cáncer de esófago, aunque un estudio reciente encontró que la detección de tres anomalías genéticas diferentes se asoció con una probabilidad de hasta un 79 %. de desarrollar cáncer en seis años.
La resección mucosa endoscópica también se ha evaluado como técnica de manejo. Además, una operación conocida como fundoplicatura de Nissen puede reducir el reflujo de ácido del estómago hacia el esófago.
En una variedad de estudios, los medicamentos antiinflamatorios no esteroideos (AINE), como la aspirina en dosis bajas (75 a 300 mg/día), han mostrado evidencia de prevención del cáncer de esófago en personas con esófago de Barrett.
Pronóstico
El esófago de Barrett es una condición premaligna, no maligna. Su secuela maligna, el adenocarcinoma de la unión esofagogástrica, tiene una tasa de mortalidad superior al 85%. Se ha estimado que el riesgo de desarrollar adenocarcinoma esofágico en personas con esófago de Barrett es de 6 a 7 por 1000 años-persona, pero un estudio de cohorte de 11 028 pacientes de Dinamarca publicado en 2011 mostró una incidencia de solo 1,2 por 1000 años-persona (5,1 por 1000 años-persona en pacientes con displasia, 1,0 por 1000 años-persona en pacientes sin displasia).
El riesgo relativo de adenocarcinoma esofágico es unas diez veces mayor en las personas con esófago de Barrett que en la población general. La mayoría de los pacientes con carcinoma esofágico sobreviven menos de un año.
Epidemiología
La incidencia en los Estados Unidos entre los hombres caucásicos es ocho veces mayor que la tasa entre las mujeres caucásicas y cinco veces mayor que la de los hombres afroamericanos. En general, la proporción entre hombres y mujeres del esófago de Barrett es de 10:1. Varios estudios han estimado que la prevalencia del esófago de Barrett en la población general es del 1,3 % al 1,6 % en dos poblaciones europeas (italiana y sueca) y del 3,6 % en una población coreana.
Historia
La afección lleva el nombre del cirujano torácico australiano Norman Barrett (1903–1979), quien en 1950 argumentó que "las úlceras que se encuentran debajo de la unión escamocolumnar... representan úlceras gástricas dentro de una bolsa de estómago".... dibujado por tejido cicatricial en el mediastino'... que representa un ejemplo de un 'esófago corto congénito'". Por el contrario, Philip Rowland Allison y Alan Johnstone argumentaron que la afección se relacionaba con el "esófago revestido con una membrana mucosa gástrica y no con el estómago intratorácico como creía erróneamente Barrett". Philip Allison, cirujano cardiotorácico y catedrático de cirugía de la Universidad de Oxford, sugirió "llamar al cráter de la úlcera péptica crónica del esófago 'úlcera de Barrett'", pero agregar este nombre no implica acuerdo con la descripción de "Barrett' de un esófago revestido con una membrana mucosa gástrica como estómago." Bani-Hani KE y Bani-Hani KR argumentan que la terminología y la definición del esófago de Barrett están rodeadas de una confusión extraordinaria a diferencia de la mayoría de las otras afecciones médicas y que "[e]l uso del epónimo ' Barrett's' describir [la condición] no está justificado desde un punto de vista histórico". Bani-Hani KE y Bani-Hani KR investigaron los aspectos históricos de la afección y descubrieron que podían establecer "cuán poco había contribuido Norman Barrett al concepto central de esta afección en comparación con las contribuciones de otros investigadores, en particular la contribución de Philip Allison".
Se estableció otra asociación con el adenocarcinoma en 1975.
Contenido relacionado
Tiempo de liberación (telecomunicaciones)
Material de comparación de índices
Flutter (electrónica y comunicación)