Ecuacion quimica
Una ecuación química es la representación simbólica de una reacción química en forma de símbolos y fórmulas químicas. Las entidades de reactivos se dan en el lado izquierdo y las entidades de productos están en el lado derecho con un signo más entre las entidades tanto en los reactivos como en los productos, y una flecha que apunta hacia los productos para mostrar la dirección de la reacción. Las fórmulas químicas pueden ser simbólicas, estructurales (diagramas pictóricos) o entremezcladas. Los coeficientes junto a los símbolos y fórmulas de las entidades son los valores absolutos de los números estequiométricos. La primera ecuación química fue diagramada por Jean Beguin en 1615.
Estructura
Una ecuación química (vea un ejemplo a continuación) consta de una lista de reactivos (las sustancias iniciales) en el lado izquierdo, un símbolo de flecha y una lista de productos (sustancias formadas en la reacción química) en el lado derecho -lado. Cada sustancia se especifica mediante su fórmula química, precedida opcionalmente por un número denominado coeficiente estequiométrico. El coeficiente especifica cuántas entidades (por ejemplo, moléculas) de esa sustancia están involucradas en la reacción sobre una base molecular. Si no se escribe explícitamente, el coeficiente es igual a 1. Varias sustancias en cualquier lado de la ecuación están separadas entre sí por un signo más.
Como ejemplo, la ecuación para la reacción del ácido clorhídrico con el sodio se puede denotar:
- 2NaCl + H2}}}" xmlns="http://www.w3.org/1998/Math/MathML">2HCl+2Narestablecimiento restablecimiento 2NaCl+H2{fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {f}\fnMicrosoft {\\fnMicrosoft {fnMicrosoft {fnMicrosoft {\fnMicrosoft {\fnMicrosoft\\fnMicrosoft {\\\fnMicrosoft}\\\\\fnMicrosoft\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\ {2HCl + 2Na - titulada 2NaCl + H2}}
2NaCl + H2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/9fdfd42b534a4761b4908780f340fd1615c487cd" style="vertical-align: -1.005ex; width:30.427ex; height:2.843ex;"/>
- 2HCl + 2Na → 2NaCl + H2
Dado que las fórmulas son bastante simples, esta ecuación podría leerse como "dos H-C-L más dos N-A producen dos N-A-C-L y H dos." Alternativamente, y en general para las ecuaciones que involucran productos químicos complejos, las fórmulas químicas se leen usando la nomenclatura de la IUPAC, que podría verbalizar esta ecuación como "dos moléculas de ácido clorhídrico y dos átomos de sodio reaccionan para formar dos unidades de fórmula de cloruro de sodio y un hidrógeno". molécula de gas."
Tipos de reacción
Se utilizan diferentes variantes del símbolo de flecha para indicar el tipo de reacción:
Estado de la materia
Para indicar el estado físico de una sustancia química, se puede agregar un símbolo entre paréntesis a su fórmula: (s) para un sólido, (l) para un líquido, (g) para un gas y (aq) para un acuoso solución. Esto se hace especialmente cuando se desea enfatizar los estados o cambios de los mismos. Por ejemplo, la reacción de ácido clorhídrico acuoso con sodio sólido (metálico) para formar cloruro de sodio acuoso e hidrógeno gaseoso se escribiría así:
- 2NaCl(aq) + H2(g)}}}" xmlns="http://www.w3.org/1998/Math/MathML">2HCl()aq)+2Na()s)restablecimiento restablecimiento 2NaCl()aq)+H2()g){displaystyle {ce {2HCl(aq) + 2Na(s) - titulada 2NaCl(aq) + H2(g)}}}
2NaCl(aq) + H2(g)}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/d28d39181682f34a6a4f58f931f4af387af87c4a" style="vertical-align: -1.005ex; width:44.523ex; height:3.009ex;"/>
Esa reacción tendría diferentes propiedades termodinámicas y cinéticas si el cloruro de hidrógeno gaseoso reemplazara al ácido clorhídrico como reactivo:
- 2NaCl(s) + H2(g)}}}" xmlns="http://www.w3.org/1998/Math/MathML">2HCl()g)+2Na()s)restablecimiento restablecimiento 2NaCl()s)+H2()g){displaystyle {ce {2HCl(g) + 2Na(s) - titulada 2NaCl(s) + H2(g)}}}
2NaCl(s) + H2(g)}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/f5038e35372ed615f402f60497b0ab043a0552a4" style="vertical-align: -1.005ex; width:41.821ex; height:3.009ex;"/>
Alternativamente, en algunos casos se usa una flecha sin paréntesis para indicar la formación de un gas ↑ o precipitado ↓. Esto es especialmente útil si solo se forma una de esas especies. Aquí hay un ejemplo que indica que se forma gas hidrógeno:
- 2 NaCl + H2 ^}}}" xmlns="http://www.w3.org/1998/Math/MathML">2HCl+2Narestablecimiento restablecimiento 2NaCl+H2↑ ↑ {fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {f}\fnMicrosoft {\\fnMicrosoft {fnMicrosoft {fnMicrosoft {\fnMicrosoft {\fnMicrosoft\\fnMicrosoft {\\\fnMicrosoft}\\\\\fnMicrosoft\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\ {2HCl + 2Na - título 2 NaCl + H2 ^}}
2 NaCl + H2 ^}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/d8b4b87dcace2b148a6e8e7d8b7d4977a0b010ee" style="vertical-align: -1.005ex; width:31.589ex; height:2.843ex;"/>
Catálisis y otras condiciones
Si la reacción requiere energía, se indica arriba de la flecha. Se coloca una letra griega delta mayúscula (Δ) o un triángulo (△) en la flecha de reacción para mostrar que se agrega energía en forma de calor a la reacción. La expresión hν se utiliza como símbolo de la adición de energía en forma de luz. Otros símbolos se utilizan para otros tipos específicos de energía o radiación.
Del mismo modo, si una reacción requiere un determinado medio con ciertas características específicas, entonces el nombre del ácido o base que se utiliza como medio puede colocarse encima de la flecha. Si no se requiere un ácido o una base específicos, otra forma de indicar el uso de un medio ácido o básico es escribir H+ o OH− (o incluso " ácido" o "base") en la parte superior de la flecha. De la misma manera se pueden indicar condiciones específicas de temperatura y presión, así como la presencia de catalizadores.
Variantes de notación
La notación estándar para ecuaciones químicas solo permite que todos los reactivos estén en un lado, todos los productos en el otro y todos los coeficientes estequiométricos sean positivos. Por ejemplo, la forma habitual de la ecuación para la deshidratación de metanol a dimetiléter es:
- CH3OCH3 + H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">2CH3Oh.restablecimiento restablecimiento CH3OCH3+H2O{displaystyle {ce {2 CH3OH -] CH3OCH3 + H2O}}
CH3OCH3 + H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/5f5cd42b0701acb67296ee714cc51151cf6b162d" style="vertical-align: -1.005ex; width:32.877ex; height:2.843ex;"/>
A veces se usa una extensión, donde algunas sustancias con sus coeficientes estequiométricos se mueven por encima o por debajo de la flecha, precedidas por un signo más o nada para un reactivo y por un signo menos para un producto. Entonces la misma ecuación puede verse así:
- [{overset {}{ce {-H2O}}}]CH3OCH3}}}" xmlns="http://www.w3.org/1998/Math/MathML">2CH3Oh.→− − H2OCH3OCH3{displaystyle {ce {2CH3OH-Inglés[{overset {fnMicrosoft Sans Serif} {fnMicrosoft} {fnMicrosoft}}} {fnMicrosoft}} {fnMicrosoft} {f}}} {fnK}} {f}}} {f}} {f}} {f}}}}} {f}}}}} {f}}}}}} {f}}}}}}}}}}}} {f}}}}}}}}}}}}}}} {f}}}}}}}}}}}}}}}}}}}}}}}}}}} {f}} {f}}}}}}}}} {f}}}}}}}}}}}}}}}}}} {f}}}} {f}}} {f}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {-H2O}}} CH3OCH3}}
[{overset {}{ce {-H2O}}}]CH3OCH3}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/a9322a7fd3bb1fb28dab61d3c7fa287ab389d3c7" style="vertical-align: -1.005ex; margin-top: -0.386ex; width:27.57ex; height:5.343ex;"/>
Tal notación sirve para ocultar sustancias menos importantes de los lados de la ecuación, para hacer que el tipo de reacción en cuestión sea más obvio y para facilitar el encadenamiento de ecuaciones químicas. Esto es muy útil para ilustrar mecanismos de reacción de varios pasos. Tenga en cuenta que las sustancias arriba o abajo de las flechas no son catalizadores en este caso, porque se consumen o producen en la reacción como reactivos o productos ordinarios.
Otra extensión utilizada en los mecanismos de reacción mueve algunas sustancias a las ramas de la flecha. Ambas extensiones se utilizan en la ilustración de ejemplo de un mecanismo.
El uso de coeficientes estequiométricos negativos en cualquier lado de la ecuación (como en el ejemplo a continuación) no se adopta ampliamente y, a menudo, se desaconseja.
- CH3OCH3}}}" xmlns="http://www.w3.org/1998/Math/MathML">2CH3Oh.− − H2Orestablecimiento restablecimiento CH3OCH3{displaystyle {ce {2 CH3OH;-;-; H2O - titulada CH3OCH3}}
CH3OCH3}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/8bd3a1101f75d22efd346977da25d7af801f3836" style="vertical-align: -1.005ex; width:33.135ex; height:2.843ex;"/>
Balance de ecuaciones químicas
Debido a que no se producen reacciones nucleares en una reacción química, los elementos químicos pasan a través de la reacción sin cambios. Por lo tanto, cada lado de la ecuación química debe representar el mismo número de átomos de cualquier elemento en particular (o nucleido, si se toman en cuenta diferentes isótopos). Lo mismo vale para la carga eléctrica total, tal como establece la ley de conservación de la carga. Una ecuación que cumple estos requisitos se dice que está equilibrada.
Una ecuación química se equilibra asignando valores adecuados a los coeficientes estequiométricos. Las ecuaciones simples se pueden equilibrar mediante inspección, es decir, mediante prueba y error. Otra técnica consiste en resolver un sistema de ecuaciones lineales.
Las ecuaciones balanceadas generalmente se escriben con los coeficientes de números naturales más pequeños. Sin embargo, a veces puede ser ventajoso aceptar un coeficiente fraccionario, si simplifica los otros coeficientes. Por lo tanto, el ejemplo introductorio se puede reescribir como
- NaCl + 1/2 H2}}}" xmlns="http://www.w3.org/1998/Math/MathML">HCl+Narestablecimiento restablecimiento NaCl+12H2{displaystyle {ce {cHCl + Na - titulada NaCl + 1/2 H2}}
NaCl + 1/2 H2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/80e085e0596a151cce3a1c5ff82a23fa9cf11535" style="vertical-align: -1.171ex; width:27.436ex; height:3.509ex;"/>
En algunas circunstancias, los coeficientes fraccionarios son incluso inevitables. Por ejemplo, la reacción correspondiente a la entalpía estándar de formación debe escribirse de manera que se forme una molécula de un solo producto. Esto a menudo requerirá que algunos coeficientes de reactivos sean fraccionarios, como es el caso con la formación de fluoruro de litio:
- LiF(s)}}}" xmlns="http://www.w3.org/1998/Math/MathML">Li()s)+12F2()g)restablecimiento restablecimiento LiF()s){fnMicrosoft Sans Serif}}
LiF(s)}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/59965a014de31ada99dbcba42504eba58769a8e7" style="vertical-align: -1.171ex; width:26.306ex; height:3.509ex;"/>
Método de inspección
El método de inspección puede resumirse estableciendo el coeficiente estequiométrico de la sustancia más compleja en 1 y asignando valores a otros coeficientes paso a paso de modo que ambos lados de la ecuación terminen con el mismo número de átomos para cada uno. elemento. Si surgen coeficientes fraccionarios durante este proceso, la presencia de fracciones puede eliminarse (en cualquier momento) multiplicando todos los coeficientes por su mínimo común denominador.
- Ejemplo
Balance de la ecuación química para la combustión completa del metano
- {mathord {?}},{CO2}+{mathord {?}},{H2O}}}}" xmlns="http://www.w3.org/1998/Math/MathML">?CH4+?O2restablecimiento restablecimiento ?CO2+?H2O{fnMicrosoft Sans Serif}, {fnMicrosoft Sans Serif} ¿Qué?
{mathord {?}},{CO2}+{mathord {?}},{H2O}}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/437bb1049e67918fbad8e83489abd367eb7794c0" style="vertical-align: -1.005ex; width:33.198ex; height:2.843ex;"/>
- {mathord {?}},{CO2}+{mathord {?}},{H2O}}}}" xmlns="http://www.w3.org/1998/Math/MathML">?CH4+?O2restablecimiento restablecimiento ?CO2+?H2O{fnMicrosoft Sans Serif}, {fnMicrosoft Sans Serif} ¿Qué?
se logra de la siguiente manera:
- Un coeficiente de 1 se coloca frente a la fórmula más compleja (CH4):
- {mathord {?}},{CO2}+{mathord {?}},{H2O}}}}" xmlns="http://www.w3.org/1998/Math/MathML">1CH4+?O2restablecimiento restablecimiento ?CO2+?H2O{fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {f}\fnMicrosoft {\\fnMicrosoft {fnMicrosoft {fnMicrosoft {\fnMicrosoft {\fnMicrosoft\\fnMicrosoft {\\\fnMicrosoft}\\\\\fnMicrosoft\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\ {1{CH4}+{mathord ¿Qué?
{mathord {?}},{CO2}+{mathord {?}},{H2O}}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/16afae70635fb5854647f6f964a6f4e0538fdb96" style="vertical-align: -1.005ex; width:33.264ex; height:2.843ex;"/>
- {mathord {?}},{CO2}+{mathord {?}},{H2O}}}}" xmlns="http://www.w3.org/1998/Math/MathML">1CH4+?O2restablecimiento restablecimiento ?CO2+?H2O{fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {f}\fnMicrosoft {\\fnMicrosoft {fnMicrosoft {fnMicrosoft {\fnMicrosoft {\fnMicrosoft\\fnMicrosoft {\\\fnMicrosoft}\\\\\fnMicrosoft\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\ {1{CH4}+{mathord ¿Qué?
- El lado izquierdo tiene 1 átomo de carbono, por lo que 1 molécula de CO2 lo equilibrará. El lado izquierdo también tiene 4 átomos de hidrógeno, que serán equilibrados por 2 moléculas de H2O:
- 1{CO2}+2H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">1CH4+?O2restablecimiento restablecimiento 1CO2+2H2O{fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {f}\fnMicrosoft {\\fnMicrosoft {fnMicrosoft {fnMicrosoft {\fnMicrosoft {\fnMicrosoft\\fnMicrosoft {\\\fnMicrosoft}\\\\\fnMicrosoft\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\ {1{CH4}+{mathord {}},{O2}-}}}}}}
1{CO2}+2H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/9e853c398b48546cbf247c4b33439e7bd193939c" style="vertical-align: -1.005ex; width:33.394ex; height:2.843ex;"/>
- 1{CO2}+2H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">1CH4+?O2restablecimiento restablecimiento 1CO2+2H2O{fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {f}\fnMicrosoft {\\fnMicrosoft {fnMicrosoft {fnMicrosoft {\fnMicrosoft {\fnMicrosoft\\fnMicrosoft {\\\fnMicrosoft}\\\\\fnMicrosoft\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\ {1{CH4}+{mathord {}},{O2}-}}}}}}
- Equilibrar los 4 átomos de oxígeno del lado derecho por 2 moléculas de O2 produce la ecuación
- 1 CO2 + 2 H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">1CH4+2O2restablecimiento restablecimiento 1CO2+2H2O{displaystyle {ce {1 CH4 + 2 O2 - titulada 1 CO2 + 2 H2O}}
1 CO2 + 2 H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/5dcef39b057cc4f23c77325bcf43dda36aecc244" style="vertical-align: -1.005ex; width:33.459ex; height:2.843ex;"/>
- 1 CO2 + 2 H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">1CH4+2O2restablecimiento restablecimiento 1CO2+2H2O{displaystyle {ce {1 CH4 + 2 O2 - titulada 1 CO2 + 2 H2O}}
- Los coeficientes iguales a 1 se omiten, ya que no necesitan ser especificados explícitamente:
- CO2 + 2 H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">CH4+2O2restablecimiento restablecimiento CO2+2H2O{displaystyle {ce {CH4 + 2 O2 - titulada CO2 + 2 H2O}}
CO2 + 2 H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/fff89c129e6222f641b40a710d97016377395720" style="vertical-align: -1.005ex; width:30.36ex; height:2.843ex;"/>
- CO2 + 2 H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">CH4+2O2restablecimiento restablecimiento CO2+2H2O{displaystyle {ce {CH4 + 2 O2 - titulada CO2 + 2 H2O}}
- Es prudente comprobar que la ecuación final es equilibrada, es decir, que para cada elemento hay el mismo número de átomos en el lado izquierdo y derecho: 1 carbono, 4 hidrógeno y 4 oxígeno.
Sistema de ecuaciones lineales
Para cada elemento químico (o nucleido o fracción o carga sin cambios) i, su requisito de conservación se puede expresar mediante la fórmula matemática ecuación
- .. j▪ ▪ reaccionariosaijsj=.. j▪ ▪ productosaijsj{displaystyle sum _{j,in ,{text{reactants}}!!!! #####!!sum _{j,in ,{text{products}!!!!!
dónde
- aij es el número de átomos de elemento i en una molécula de sustancia j (por fórmula en la ecuación química) y
- sj es el coeficiente esteichiométrico para la sustancia j.
Esto da como resultado un sistema homogéneo de ecuaciones lineales, que se resuelven fácilmente mediante métodos matemáticos. Dicho sistema siempre tiene la solución trivial de todos ceros, que no nos interesa, pero si hay soluciones adicionales, habrá un número infinito de ellas. Cualquier solución no trivial equilibrará la ecuación química. Un "preferido" la solución es una con números enteros, en su mayoría coeficientes estequiométricos positivos sj con el máximo común divisor igual a uno.
Ejemplo
Asignemos variables a los coeficientes estequiométricos de la ecuación química de la sección anterior y escribamos las ecuaciones lineales correspondientes:
- {mathit {s}}_{3}{CO2}+{mathit {s}}_{4}{H2O}}}}" xmlns="http://www.w3.org/1998/Math/MathML">s1CH4+s2O2restablecimiento restablecimiento s3CO2+s4H2O{fnMicrosoft {fnMitit} {fnMicrosoft} {fnMicrosoft}} {fnMicrosoft} {fnh} {fnh}} {f}}}}} {f}}}}}} {fn}}} {fn}}} {\fnMitit} {f}}}}}}}}}} {\\f}}}}}}}}}}}}}\\\\\\\\\\\\\f}}}}}}}}}}}}}}}}}}}}}}}}}}}}\\\\\\\\\\\\\}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {fnMicrosoft} {fnMicrosoft} {fnMicrosoft} {fnMicrosoft}} {fn}} {fnMicrosoft} {fnMicrosoft} {fnMicrosoft} {fnMicrosoft}} {fnMicrosoft} {f}}} {fnMicrosoft}}}} {fnMicrosoft}}}}} {fn}}}}}}} {f}} {\fnMit}}}}}}}}}}}} {\\\\\\\f}}}}}}}}}}}}}}}}}}}}}}}}\\\\\\\\\\\\\\\\\\\\\\\}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}\\\\\\\\\\\\ {fn}} {fn}} {fn}}} {fn}}}}} {fn}} {fn}}} {fn}}}}}} {fn}}}}}}} {fn}}}}}} {}}}}}}}}}} {}}}}}}} {}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}
{mathit {s}}_{3}{CO2}+{mathit {s}}_{4}{H2O}}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/07f85bf087629c1dc5eb9a008bf0d368c8c27bb3" style="vertical-align: -1.005ex; width:35.282ex; height:2.843ex;"/>
C:s1=s3H:4s1=2s4O:2s2=2s3+s4{displaystyle quad;;;;{begin{aligned}{C:} {} {1} {=s_{3}\\\text{H:} {cH:} {4s_{1}=2s_{4}\\{0}}}}} {2}}}}}}} {3}}}}}}}}}}}}}}}}\\\\\cc}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}\\\\\\\\\\\\\\\\\\\\\\}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}
Todas las soluciones a este sistema de ecuaciones lineales tienen la siguiente forma, donde r es cualquier número real:
- s1=rs2=2rs3=rs4=2r{\fnK} {fnK} {fnK}} {f}}} {fn}}}}} {f}} {f}}}}}} {fn}}}}}}}}}}}
La elección de r = 1 produce la solución preferida,
- s1=1s2=2s3=1s4=2{fnK} {fncip {fncip {fn} {fn}} {fn}} {fn}}} {fn}}}}} {fn}}}}} {fn}}}}}}}} {b}}}}} {b}}}}}}}}} {b}}}}}}}}}}}}}}}}} {b}}}}} {b}}}}}}}}} {b}}}}}}}}}} {b}}}}}}}}}} {b}}}}}}}}}}}}}}}}}}} {b}}}}}} {b}}}}}}}}}}}}}}}} {b}}}}}}}}}}}}}}}}} {b}}}}}}}}}}}}}}}}}}}} {b}}}}
que corresponde a la ecuación química balanceada:
- CO2 + 2 H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">CH4+2O2restablecimiento restablecimiento CO2+2H2O{displaystyle {ce {CH4 + 2 O2 - titulada CO2 + 2 H2O}}
CO2 + 2 H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/fff89c129e6222f641b40a710d97016377395720" style="vertical-align: -1.005ex; width:30.36ex; height:2.843ex;"/>
Método matricial
El sistema de ecuaciones lineales presentado en la sección anterior también se puede escribir usando un formalismo de matriz eficiente. Primero, para unificar los coeficientes estequiométricos del reactivo y del producto sj, introduzcamos la cantidad
- .. j={}− − sjpara un reaccionario+sjpara un producto{displaystyle nu _{j}={begin{cases}-s_{j} a reactant}+s_{text{for a product}end{cases}}
llamado número estequiométrico, que simplifica las ecuaciones lineales a
- .. j=1Jaij.. j=0{displaystyle sum _{j=1}{J}a_{ij}nu ¿Qué?
donde J es el número total de sustancias reactivas y producto (fórmulas) en la ecuación química.
Ubicación de los valores aij en la fila i y columna j de la matriz de composición
- A =[a1,1a1,2⋯ ⋯ a1,Ja2,1a2,2⋯ ⋯ a2,J⋮ ⋮ ⋮ ⋮ ⋱ ⋱ ⋮ ⋮ ]{displaystyle {begin{bmatrix}a_{1,1} limita_{1,2} " a_{1,J}a_{2,1} {2,2} ### {2,J}\vdots - ¿Qué?
y disposición de los números estequiométricos en el vector estequiométrico
- . =[.. 1.. 2⋮ ⋮ .. J]{displaystyle {begin{bmatrix}nu ¿Por qué? ¿Qué?
permite que el sistema de ecuaciones se exprese como una única ecuación matricial:
- AV = 0
Al igual que antes, cualquier vector estequiométrico distinto de cero ν, que resuelve la ecuación matricial, equilibrará la ecuación química.
El conjunto de soluciones de la ecuación matricial es un espacio lineal llamado núcleo de la matriz A. Para que este espacio contenga vectores distintos de cero ν, es decir, que tenga una dimensión positiva JN, las columnas de la matriz de composición A no deben ser linealmente independientes. El problema de equilibrar una ecuación química se convierte entonces en el problema de determinar el núcleo JN-dimensional de la matriz de composición. Es importante tener en cuenta que solo para JN = 1 habrá una única solución preferida para el problema de equilibrio. Para JN > 1 habrá un número infinito de soluciones preferidas con JN de ellas linealmente independientes. Si JN = 0, solo existirá la solución trivial inutilizable, el vector cero.
Se han desarrollado técnicas para calcular rápidamente un conjunto de JN soluciones independientes al problema de equilibrio, que son superiores a la inspección y método algebraico en que son determinantes y dan todas las soluciones al problema de equilibrio.
- Ejemplo
Tomemos la misma ecuación química nuevamente y escribamos la ecuación matricial correspondiente:
- {mathit {s}}_{3}{CO2}+{mathit {s}}_{4}{H2O}}}}" xmlns="http://www.w3.org/1998/Math/MathML">s1CH4+s2O2restablecimiento restablecimiento s3CO2+s4H2O{fnMicrosoft {fnMitit} {fnMicrosoft} {fnMicrosoft}} {fnMicrosoft} {fnh} {fnh}} {f}}}}} {f}}}}}} {fn}}} {fn}}} {\fnMitit} {f}}}}}}}}}} {\\f}}}}}}}}}}}}}\\\\\\\\\\\\\f}}}}}}}}}}}}}}}}}}}}}}}}}}}}\\\\\\\\\\\\\}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {fnMicrosoft} {fnMicrosoft} {fnMicrosoft} {fnMicrosoft}} {fn}} {fnMicrosoft} {fnMicrosoft} {fnMicrosoft} {fnMicrosoft}} {fnMicrosoft} {f}}} {fnMicrosoft}}}} {fnMicrosoft}}}}} {fn}}}}}}} {f}} {\fnMit}}}}}}}}}}}} {\\\\\\\f}}}}}}}}}}}}}}}}}}}}}}}}\\\\\\\\\\\\\\\\\\\\\\\}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}\\\\\\\\\\\\ {fn}} {fn}} {fn}}} {fn}}}}} {fn}} {fn}}} {fn}}}}}} {fn}}}}}}} {fn}}}}}} {}}}}}}}}}} {}}}}}}} {}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}
{mathit {s}}_{3}{CO2}+{mathit {s}}_{4}{H2O}}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/07f85bf087629c1dc5eb9a008bf0d368c8c27bb3" style="vertical-align: -1.005ex; width:35.282ex; height:2.843ex;"/>
- C:H:O:[101040020221][.. 1.. 2.. 3.. 4]=0{displaystyle {begin{Matrix} {text{C:}\\\fnK}\\\\\fnMicrosoft Sans Serif}\fnK}fnK}fnK}f}fnK}f}f}fnKfnKf}fnKf}f}f}f}fnKfnKfnMinKfnKfnKfnKfnMinKfnKfnKfnKfnK}fnKf}fnKf}f}fnMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMinMin {begin{bmatrix}1 tarde0 tarde04}}{begin{bmatrix}nu ¿Por qué? ¿Por qué? {0}
Sus soluciones son de la siguiente forma, donde r es cualquier número real:
- [.. 1.. 2.. 3.. 4]=[− − s1− − s2s3s4]=r[− − 1− − 212]{displaystyle {begin{bmatrix}nu ¿Por qué? ¿Por qué? ¿Por qué? ############ {begin{bmatrix}-s_{1}\-s_{2}\s_{3}\s_{4}end{bmatrix}}=r{bmatrix}-12\2end{bmatrix}}}}}} {4}}}}}}}\______________________________________________________________________________________________________________________________________________________________
La elección de r = 1 y un cambio de signo de las dos primeras filas arrojan la solución preferida para el problema de equilibrio:
- [− − .. 1− − .. 2.. 3.. 4]=[s1s2s3s4]=[1212]{displaystyle {begin{bmatrix}-nu ¿Por qué? ¿Por qué? ¿Por qué? {4}s_s_s_s_{4}s_s_s_s_{3}\s_{4}end{bmatrix}=begin{bmatrix}12121112end{bmatrix}}}
Ecuaciones iónicas
Una ecuación iónica es una ecuación química en la que los electrolitos se escriben como iones disociados. Las ecuaciones iónicas se utilizan para reacciones de desplazamiento simple y doble que ocurren en soluciones acuosas.
Por ejemplo, en la siguiente reacción de precipitación:
- Ca(NO3)2 + 2 AgCl(v)}}}" xmlns="http://www.w3.org/1998/Math/MathML">CaCl2+2AgNO3restablecimiento restablecimiento Ca()NO3)2+2AgCl↓ ↓ {displaystyle {ce {CaCl2 + 2AgNO3 - Confía Ca(NO3)2 + 2 AgCl(v)}}}
Ca(NO3)2 + 2 AgCl(v)}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/a60caffe451e908b0e37044b6d780b454afc6154" style="vertical-align: -1.005ex; width:44.309ex; height:3.009ex;"/>
la ecuación iónica completa es:
- Ca^2+ + 2NO3^- + 2AgCl(v)}}}" xmlns="http://www.w3.org/1998/Math/MathML">Ca2++2Cl− − +2Ag++2NO3− − restablecimiento restablecimiento Ca2++2NO3− − +2AgCl↓ ↓ {fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {f}\fnMicrosoft {\\fnMicrosoft {fnMicrosoft {fnMicrosoft {\fnMicrosoft {\fnMicrosoft\\fnMicrosoft {\\\fnMicrosoft}\\\\\fnMicrosoft\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\ {Ca^2+ + 2Cl^- + 2Ag+ + 2NO3^- Ca^2+ + 2NO3^- + 2AgCl(v)}}}
Ca^2+ + 2NO3^- + 2AgCl(v)}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/f0c766d96acad66802d2ed0d4da1b68a0f7b7aee" style="vertical-align: -1.005ex; width:62.161ex; height:3.343ex;"/>
o, con todos los estados físicos incluidos:
- Ca^2+(aq) + 2NO3^{-}(aq) + 2AgCl(v)}}}" xmlns="http://www.w3.org/1998/Math/MathML">Ca2+()aq)+2Cl− − ()aq)+2Ag+()aq)+2NO3− − ()aq)restablecimiento restablecimiento Ca2+()aq)+2NO3− − ()aq)+2AgCl↓ ↓ {displaystyle {ce {Ca^2+(aq) + 2Cl^{-}(aq) + 2Ag+(aq) + 2NO3^{-}(aq) - Propiedad Ca^2+(aq) + 2NO3^{-}(aq) + 2AgCl(v)}}}}}}}}
Ca^2+(aq) + 2NO3^{-}(aq) + 2AgCl(v)}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/607e8960ed2262e138b2d020e1a038b1700efc68" style="vertical-align: -1.005ex; width:87.357ex; height:3.343ex;"/>
En esta reacción, los iones Ca2+ y NO3− permanecen en solución y no forman parte de la reacción. Es decir, estos iones son idénticos tanto en el lado del reactivo como en el del producto de la ecuación química. Debido a que tales iones no participan en la reacción, se les llama iones espectadores. Una ecuación net ionic es la ecuación iónica completa de la que se han eliminado los iones espectadores. La ecuación iónica neta de las reacciones precedentes es:
- 2AgCl(v)}}}" xmlns="http://www.w3.org/1998/Math/MathML">2Cl− − +2Ag+restablecimiento restablecimiento 2AgCl↓ ↓ {fnMicrosoft Sans Serif}}
2AgCl(v)}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/247f6a5347181c97980e0562b43f07423252964c" style="vertical-align: -0.671ex; width:27.23ex; height:2.843ex;"/>
o, en forma reducida equilibrada,
- AgCl(v)}}}" xmlns="http://www.w3.org/1998/Math/MathML">Ag++Cl− − restablecimiento restablecimiento AgCl↓ ↓ {fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {f}\fnMicrosoft {\\fnMicrosoft {fnMicrosoft {fnMicrosoft {\fnMicrosoft {\fnMicrosoft\\fnMicrosoft {\\\fnMicrosoft}\\\\\fnMicrosoft\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\ {Ag+ + Cl^- - titulada AgCl(v)}}
AgCl(v)}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/00c7171a8a1b43a85ae9c98a01350f3424dc41a2" style="vertical-align: -0.671ex; width:22.581ex; height:2.843ex;"/>
En una reacción de neutralización o ácido/base, la ecuación iónica neta normalmente será:
- H2O(l)}}}" xmlns="http://www.w3.org/1998/Math/MathML">H+()aq)+Oh.− − ()aq)restablecimiento restablecimiento H2O()l){displaystyle {ce {H+ (aq) + OH^{-}(aq) - Confía H2O(l)}}
H2O(l)}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/3ba86d546c335f4424cde3ca3e6d4c6b4fde47ff" style="vertical-align: -1.005ex; width:31.712ex; height:3.176ex;"/>
Hay algunas reacciones ácido/base que producen un precipitado además de la molécula de agua que se muestra arriba. Un ejemplo es la reacción del hidróxido de bario con ácido fosfórico, que produce no solo agua sino también la sal insoluble fosfato de bario. En esta reacción, no hay iones espectadores, por lo que la ecuación iónica neta es la misma que la ecuación iónica completa.
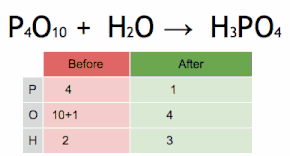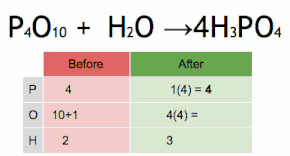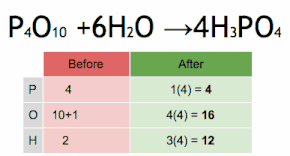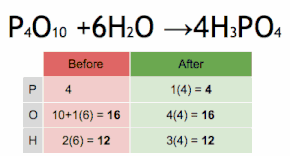
- 6H2O + Ba3(PO4)2(v)}}}" xmlns="http://www.w3.org/1998/Math/MathML">3Ba()Oh.)2+2H3PO4restablecimiento restablecimiento 6H2O+Ba3()PO4)2↓ ↓ {displaystyle {ce {3Ba(OH)2 + 2H3PO4 - titulada 6H2O + Ba3(PO4)2(v)}}}
6H2O + Ba3(PO4)2(v)}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/ac8ce09f4f27e1cb96c3cffbaa3d09323f244b88" style="vertical-align: -1.005ex; width:48.83ex; height:3.009ex;"/>
- {6H2O}+underbrace {Ba3(PO4)2(v)} _{barium~phosphate}}}}" xmlns="http://www.w3.org/1998/Math/MathML">3Ba2++6Oh.− − +6H++2PO43− − ⏟ ⏟ fosfatorestablecimiento restablecimiento 6H2O+Ba3()PO4)2↓ ↓ ⏟ ⏟ bariofosfato{fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {f}\fnMicrosoft {\\fnMicrosoft {fnMicrosoft {fnMicrosoft {\fnMicrosoft {\fnMicrosoft\\fnMicrosoft {\\\fnMicrosoft}\\\\\fnMicrosoft\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\ {{3Ba^{2}+{6OH^{-}+{6H+}}+underbrace {ce {2PO4^{3}}}} # {ce {fnMisfato}{ce} {fnMisfato}} {fnMisfato}}}} {fnK}}} {cH2O}}}}
{6H2O}+underbrace {Ba3(PO4)2(v)} _{barium~phosphate}}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/30887789728a5f55e509321b6c3f24fe7ea19107" style="vertical-align: -4.838ex; width:60.409ex; height:7.843ex;"/>
Las reacciones de doble desplazamiento en las que un carbonato reacciona con un ácido tienen la ecuación iónica neta:
- H2O + CO2 (^)}}}" xmlns="http://www.w3.org/1998/Math/MathML">2H++CO32− − ⏟ ⏟ carbonatorestablecimiento restablecimiento H2O+CO2↑ ↑ {displaystyle {ce {2H+}+compasión {ce {c}}} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} {f}} {fnMicrosoft Sans Serif} {} H2O + CO2 (^)}}
H2O + CO2 (^)}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/5f31bfcd08a92ebd1de3c052683e394fbb81cade" style="vertical-align: -4.338ex; width:32.282ex; height:6.676ex;"/>
Si cada ion es un "ion espectador" entonces no hubo reacción y la ecuación iónica neta es nula.
Por lo general, si zj es el múltiplo de la carga elemental en la molécula j-ésima, la neutralidad de carga puede escribirse como:
- .. j=1Jzj.. j=0{displaystyle sum _{j=1}{J}z_{j}nu _{j}=0}
donde νj son los coeficientes estequiométricos descritos anteriormente. El zj puede incorporarse como una fila adicional en la matriz aij descrita anteriormente, y una ecuación iónica correctamente balanceada también obedecerá:
- .. j=1Jaij.. j=0{displaystyle sum _{j=1}{J}a_{ij}nu ¿Qué?
Historia
Composición tipográfica
Contenido relacionado
Química teórica
Estructura primaria de proteínas
Hidroxi