Ecuación de Debye-Hückel

Los químicos Peter Debye y Erich Hückel notaron que las soluciones que contienen solutos iónicos no se comportan idealmente incluso en concentraciones muy bajas. Por lo tanto, si bien la concentración de los solutos es fundamental para el cálculo de la dinámica de una solución, teorizaron que un factor adicional que denominaron gamma es necesario para el cálculo de las actividades de la solución. De ahí que desarrollaron Debye-Hückel ecuación y Debye-Hückel limiting law. La actividad es sólo proporcional a la concentración y se altera por un factor conocido como coeficiente de actividad γ γ {displaystyle gamma }. Este factor tiene en cuenta la energía de interacción de iones en solución.
Ley limitante de Debye-Hückel
Para calcular la actividad aC{displaystyle A_{C} de un ion C en una solución, se debe conocer la concentración y el coeficiente de actividad:
- γ γ {displaystyle gamma } es el coeficiente de actividad de C,
- [C⊖ ⊖ ]{displaystyle mathrm {}} es la concentración de los elegidos Estado estándar, por ejemplo 1 ml/kg si se utiliza la molidad,
- [C]{displaystyle mathrm {[C]} es una medida de la concentración de C.
Dividir [C]{displaystyle mathrm {[C]} con [C⊖ ⊖ ]{displaystyle mathrm {}} da una cantidad sin dimensión.
La ley limitante de Debye-Hückel permite determinar el coeficiente de actividad de un ion en una solución diluida de fuerza iónica conocida. La ecuación es
- zi{displaystyle z_{i} es el número de carga de especies de iones i,
- q{displaystyle q} es la carga primaria,
- κ κ {displaystyle kappa } es la inversa de la longitud de proyección de Debye λ λ D{displaystyle lambda _{rm {}} (definido a continuación),
- ε ε r{displaystyle varepsilon _{r} es la relativa autorización del solvente,
- ε ε 0{displaystyle varepsilon ¿Qué? es la autorización del espacio libre,
- kB{displaystyle k_{text{B}} es la constante de Boltzmann,
- T{displaystyle T} es la temperatura de la solución,
- NA{displaystyle N_{mathrm {A}} es la constante Avogadro,
- I{displaystyle I} es la fuerza iónica de la solución (definida a continuación),
- A{displaystyle A} es una constante que depende de la temperatura. Si I{displaystyle I} se expresa en términos de molidad, en lugar de molaridad (como en la ecuación anterior y en el resto de este artículo), entonces un valor experimental para A{displaystyle A} de agua es 1.172 mol− − 1/2kg1/2{displaystyle 1.172{text{ mol}}{-1/2}{text{kg}}{1/2}}}}} {f}} {f}}}} {f}} {f}}} {f}}}} {f}}} {f}}}}} {f}}}}}}}}}} {f}}}}}}}}}}}}}}}}}}}}}}}}} {f}}}}} {f}}} {f}}}}}}} {f}}}}} {f}}}}}}}}}}}}}}}}} {f}}}}}}}}}}}}}}} {f}}}}}}}}}}}}}}}}}}}}}} {f}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} a 25 °C. Es común utilizar un logaritmo base-10, en cuyo caso factor In 10{displaystyle ln 10}, entonces A es 0,599 mol− − 1/2kg1/2{displaystyle 0,59{text{ mol}}} {text{kg}} {1/2}}}}} {f}}} {f}}}} {f}}}}} {f}} {f}}} {f}}} {f}}}} {f}}}}}}}}}}} {f}}}}}}}} {f}}}}}}}}}}}}}}}}}}}}}}}}}} {f} {f}}}}}} {f}}}}} {f}}}}}}}}}}}}}}}} {f}}}}}}}} {f}}}}}}}}}}}} {f}}} {f}}}}}}}}}}} {f}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {. El multiplicador 103{displaystyle 10^{3} antes I/2{displaystyle I/2} en la ecuación es para el caso cuando las dimensiones I{displaystyle I} son mol/♪3{displaystyle {text{mol}/{text{dm}} {}}} {f}}} {f}} {f} {f}}}}} {f}}}} {f}}}}}}}}}}} {f}}}} {f}}}}}}}}} {f}f}}}}}}}}}}}}}}}}}}}}}. Cuando las dimensiones I{displaystyle I} son mole/m3{displaystyle {text{mole}/{text{m} {} {}}} {f}}} {f}} {f}}} {fn}}}}}} {fn}}}}}}}}} {f}} {f}}} {f}}}}}}}}}}}}}}}}}, el multiplicador 103{displaystyle 10^{3} debe ser retirado de la ecuación.
Es importante tener en cuenta que debido a que los iones en la solución actúan juntos, el coeficiente de actividad obtenido de esta ecuación es en realidad un coeficiente de actividad medio.
El exceso de presión osmótica obtenido de la teoría de Debye-Hückel está en unidades cgs:
Resumen del primer artículo de Debye y Hückel sobre la teoría de los electrolitos diluidos
El título en inglés del artículo es "Sobre la teoría de los electrolitos". I. Depresión del punto de congelación y fenómenos relacionados". Se publicó originalmente en 1923 en el volumen 24 de una revista en alemán Physikalische Zeitschrift. Se incluye una traducción al inglés del artículo en un libro de artículos recopilados presentado a Debye por "sus alumnos, amigos y editores con motivo de su septuagésimo cumpleaños el 24 de marzo de 1954". En 2019 se completó otra traducción al inglés. El artículo trata sobre el cálculo de las propiedades de soluciones de electrolitos que están bajo la influencia de campos eléctricos inducidos por iones, por lo que trata de la electrostática.
En el mismo año en que publicaron este artículo por primera vez, Debye y Hückel, en adelante D&H, también publicaron un artículo que cubría su caracterización inicial de soluciones bajo la influencia de campos eléctricos llamado "Sobre la teoría de los electrolitos". II. Ley Limitante de la Conductividad Eléctrica", pero el artículo siguiente no se trata (todavía) aquí.
En el siguiente resumen (aún incompleto y sin verificar), se utilizan notación y terminología modernas, tanto de química como de matemáticas, para evitar confusiones. Además, con algunas excepciones para mejorar la claridad, las subsecciones de este resumen son versiones (muy) condensadas de las mismas subsecciones del artículo original.
Introducción
D&H señala que la fórmula de Guldberg-Waage para especies de electrolitos en equilibrio de reacción química en forma clásica es
- ∏ ∏ {textstyle prod } es una notación para la multiplicación,
- i{displaystyle i} es una variable muñeca que indica la especie,
- s{displaystyle s} es el número de especies que participan en la reacción,
- xi{displaystyle x_{i}} es la fracción del topo de las especies i{displaystyle i},
- . . i{displaystyle nu _{i}} es el coeficiente estoichiométrico de las especies i{displaystyle i},
- K es la constante del equilibrio.
D.H dice que, debido a las "fuerzas electrostáticas recíprocas entre los iones", es necesario modificar la ecuación de Guldberg-Waage reemplazando K{displaystyle K} con γ γ K{displaystyle gamma K}, donde γ γ {displaystyle gamma } es un coeficiente de actividad general, no un coeficiente de actividad "especial" (coeficiente de actividad independiente asociado a cada especie)—lo que se utiliza en la química moderna a partir de 2007.
La relación entre γ γ {displaystyle gamma } y los coeficientes de actividad especiales γ γ i{displaystyle gamma _{i} es
Fundamentos
D comprimidoH usan las entropías libres Helmholtz y Gibbs CCPR CCPR {displaystyle Phi y Ξ Ξ {displaystyle Xi} para expresar el efecto de las fuerzas electrostáticas en un electrolito en su estado termodinámico. Específicamente, dividieron la mayoría de los potenciales termodinámicos en términos clásicos y electrostáticos:
- CCPR CCPR {displaystyle Phi es Helmholtz libre entropía,
- S{displaystyle S. es entropía,
- U{displaystyle U} es energía interna,
- T{displaystyle T} es temperatura,
- A{displaystyle A} es Helmholtz energía libre.
D.H da el diferencial total CCPR CCPR {displaystyle Phi como
- P{displaystyle P} es presión,
- V{displaystyle V} es volumen.
Por la definición del diferencial total, esto significa que
Como se indicó anteriormente, la energía interna se divide en dos partes:
- k{displaystyle k} indica la parte clásica,
- e{displaystyle e} indica la parte eléctrica.
Del mismo modo, la entropía libre de Helmholtz también se divide en dos partes:
D&H afirma, sin dar la lógica, que
Parecería que, sin justificación alguna,
Sin mencionarlo específicamente, D plagaH más tarde dar lo que podría ser la justificación requerida (sobre) mientras argumenta que CCPR CCPR e=Ξ Ξ e{displaystyle Phi _{e}= Xi..., una suposición de que el solvente es incompresible.
La definición de la entropía libre de Gibbs Ξ Ξ {displaystyle Xi} es
D.H da el diferencial total Ξ Ξ {displaystyle Xi} como
En este punto Dю nota que, para el agua que contiene 1 mole por litro de cloruro de potasio (no se dan presión nominal y temperatura), la presión eléctrica Pe{displaystyle P_{e} asciende a 20 ambientes. Además, observan que este nivel de presión da un cambio de volumen relativo de 0.001. Por lo tanto, descuidan el cambio en el volumen del agua debido a la presión eléctrica, escribiendo
D&H dice que, según Planck, la parte clásica de la entropía libre de Gibbs es
- i{displaystyle i} es una especie,
- s{displaystyle s} es el número de diferentes tipos de partículas en solución,
- Ni{displaystyle N_{i} es el número de partículas de especies i,
- . . i{displaystyle xi _{i}} es la partícula específica Gibbs entropía libre de especies i,
- kB{displaystyle k_{text{B}} es la constante de Boltzmann,
- xi{displaystyle x_{i}} es la fracción del topo de las especies i.
Las especies cero son el solvente. La definición de . . i{displaystyle xi _{i}} es el siguiente, donde las letras minúsculas indican las versiones específicas de partículas de las propiedades extensas correspondientes:
No lo digas, pero la forma funcional para Ξ Ξ k{displaystyle Xi _{k}} puede derivarse de la dependencia funcional del potencial químico de un componente de una mezcla ideal sobre su fracción de mole.
Dю nota de que la energía interna U{displaystyle U} de una solución se reduce por la interacción eléctrica de sus iones, pero que este efecto no se puede determinar utilizando la aproximación cristalográfica para distancias entre átomos disimilares (la raíz del cubo de la relación del volumen total al número de partículas en el volumen). Esto es porque hay más movimiento térmico en una solución líquida que en un cristal. El movimiento térmico tiende a deshacerse de la celosía natural que de otro modo sería construido por los iones. En su lugar, D plaga introduce el concepto de un ambiente iónico o nube. Como la rejilla cristalina, cada ión todavía intenta rodearse de iones cargados opuestamente, pero de manera más libre; a pequeñas distancias lejos de iones positivos, uno es más probable encontrar iones negativos y viceversa.
La energía potencial de una solución iónica arbitraria
La electroneutralidad de una solución requiere que
- Ni{displaystyle N_{i} es el número total de iones de especies i en la solución,
- zi{displaystyle z_{i} es el número de carga de especies i.
Para traer un ión de especies i, inicialmente lejos, a un punto P{displaystyle P} dentro de la nube ion requiere energía de interacción en la cantidad de ziqφ φ {displaystyle z_{i}qvarphi }, donde q{displaystyle q} es la carga primaria, y φ φ {displaystyle varphi } es el valor del campo potencial eléctrico de escalar en P{displaystyle P}. Si las fuerzas eléctricas fueran el único factor en juego, la configuración de energía mínima de todos los iones se lograría en una configuración de celosía muy ajustada. Sin embargo, los iones están en equilibrio térmico entre sí y son relativamente libres de moverse. Así obedecen las estadísticas Boltzmann y forman una distribución Boltzmann. Número de densidades de todas las especies ni{displaystyle No. se alteran de sus valores de volumen (sobretodo promedio) ni0{displaystyle No. por el factor Boltzmann correspondiente e− − ziqφ φ kBT{displaystyle e^{-{frac {z_{i}qvarphi } {k_{text{B}T}}}}, donde kB{displaystyle k_{text{B}} es la constante de Boltzmann, y T{displaystyle T} es la temperatura. Así en cada punto de la nube
Tenga en cuenta que en el límite de temperatura infinito, todos los iones se distribuyen uniformemente, sin tener en cuenta sus interacciones electrostáticas.
La densidad de carga está relacionada con la densidad numérica:
Al combinar este resultado para la densidad de carga con la ecuación de Poisson de la electrostática, se obtiene una forma de la ecuación de Poisson-Boltzmann:
Esta ecuación es difícil de resolver y no sigue el principio de superposición lineal para la relación entre el número de cargas y la intensidad del campo potencial. Ha sido resuelto por el matemático sueco Thomas Hakon Gronwall y sus colaboradores, los químicos físicos V. K. La Mer y Karl Sandved, en un artículo de 1928 de Physikalische Zeitschrift que trata sobre las extensiones de la teoría de Debye-Huckel, que recurrió a la expansión de la serie de Taylor.
Sin embargo, para concentraciones suficientemente bajas de iones, se puede utilizar una aproximación de expansión de la serie Taylor de primer orden para la función exponencial (ex. . 1+x{displaystyle e^{x}approx 1+x} para <math alttext="{displaystyle 00c)x≪ ≪ 1{displaystyle 0 wonxll 1}<img alt="{displaystyle 0) para crear una ecuación diferencial lineal (Hamann, Hamnett y Vielstich. Electroquímica. Wiley-VCH. section 2.4.2). DT dice que esta aproximación tiene grandes distancias entre iones, lo que es el mismo que decir que la concentración es baja. Por último, afirman sin pruebas que la adición de más términos en la expansión tiene poco efecto en la solución final. Así
La ecuación de Poisson-Boltzmann se transforma a
Factorear el potencial de escalar y asignar las sobras, que son constantes, a κ κ 2{displaystyle kappa ^{2}. Además, deja I{displaystyle I} ser la fuerza iónica de la solución:
Entonces, la ecuación fundamental se reduce a una forma de ecuación de Helmholtz:
Hoy, κ κ − − 1{displaystyle kappa ^{-1} se llama la longitud de detección de Debye. D Pulh reconoce la importancia del parámetro en su artículo y lo caracteriza como una medida del espesor de la atmósfera ion, que es una capa doble eléctrica del tipo Gouy-Chapman.
La ecuación puede expresarse en coordenadas esféricas tomando r=0{displaystyle r=0} en algún ion arbitrario:
La ecuación tiene la siguiente solución general (tenga en cuenta que κ κ {displaystyle kappa } es una constante positiva:
El potencial eléctrico es cero en el infinito por definición, así que A.{displaystyle A'} debe ser cero.
En el siguiente paso, D.H. asume que hay un radio determinado ai{displaystyle A_{i}, más allá de lo cual ningún iones en la atmósfera puede acercarse al centro (cargo) del ión. Este radio puede ser debido al tamaño físico del ión mismo, los tamaños de los iones en la nube, y cualquier molécula de agua que rodea los iones. Matemáticamente, tratan al iión soltero como una carga de punto a la que uno no puede acercarse dentro del radio ai{displaystyle A_{i}.
El potencial de una carga puntual por sí sola es
D&H dice que el potencial total dentro de la esfera es
En una combinación del modelo continuamente distribuido que dio la ecuación Poisson-Boltzmann y el modelo de la carga de punto, se supone que en el radio ai{displaystyle A_{i}, hay una continuidad φ φ ()r){displaystyle varphi (r)} y su primer derivado. Así
Por la definición de la energía potencial eléctrica, la energía potencial asociada con el iión desaparecido en la atmósfera ion es
Observe que esto sólo requiere conocer la carga del ion seleccionado y el potencial de todos los demás iones.
Para calcular la energía potencial de toda la solución de electrolito, se debe utilizar la generalización de cargas múltiples para la energía potencial eléctrica:
El término eléctrico adicional al potencial termodinámico
No dimensionalización
La ecuación diferencial está lista para solución (como se indicó anteriormente, la ecuación solo es válida para concentraciones bajas):
Usar el teorema π de Buckingham en este problema da como resultado los siguientes grupos adimensionales:
Para obtener la ecuación diferencial no dimensionada y las condiciones iniciales, utilice la π π {displaystyle pi} grupos para eliminar φ φ ()r){displaystyle varphi (r)} a favor de CCPR CCPR ()R()r)){displaystyle Phi (R(r)}, luego eliminar R()r){displaystyle R(r)} a favor de r{displaystyle r} mientras realiza la regla de la cadena y sustituye R. . ()r)=a{displaystyle {R^{prime}(r)=a}, luego eliminar r{displaystyle r} a favor de R{displaystyle R. (no se necesita una regla de cadena), luego eliminar I{displaystyle I} a favor de ()κ κ a)2{displaystyle (kappa a)} {2}, luego eliminar z0{displaystyle z_{0} a favor de Z0{displaystyle Z_{0}. Las ecuaciones resultantes son las siguientes:
Para la sal de mesa en la solución 0.01 M a 25 °C, un valor típico de ()κ κ a)2{displaystyle (kappa a)} {2} es 0.0005636, mientras que un valor típico de Z0{displaystyle Z_{0} es 7.017, destacando el hecho de que, en bajas concentraciones, ()κ κ a)2{displaystyle (kappa a)} {2} es un objetivo para un orden cero de aproximación de magnitud, como el análisis de perturbación. Lamentablemente, debido a la condición de límite en el infinito, la perturbación regular no funciona. La misma condición límite nos impide encontrar la solución exacta a las ecuaciones. Sin embargo, la perturbación singular puede funcionar.
Verificación experimental de la teoría
Para verificar la validez de la teoría de Debye-Hückel, se han probado muchas formas experimentales, midiendo los coeficientes de actividad: el problema es que debemos ir hacia diluciones muy altas. Ejemplos típicos son: mediciones de presión de vapor, punto de congelación, presión osmótica (métodos indirectos) y medición del potencial eléctrico en celdas (método directo). Hacia diluciones altas se han encontrado buenos resultados usando celdas de membrana líquida, se ha podido investigar medios acuosos 10−4 M y se ha encontrado que para electrolitos 1:1 (como NaCl o KCl) La ecuación de Debye-Hückel es totalmente correcta, pero para electrolitos 2:2 o 3:2 es posible encontrar una desviación negativa de la ley límite de Debye-Hückel: este extraño comportamiento sólo se puede observar en el área muy diluida, y en más En las regiones concentradas la desviación se vuelve positiva. Es posible que la ecuación de Debye-Hückel no sea capaz de prever este comportamiento debido a la linealización de la ecuación de Poisson-Boltzmann, o tal vez no: los estudios al respecto se iniciaron sólo durante los últimos años del siglo XX porque antes no era No es posible investigar la región 10−4 M, por lo que es posible que durante los próximos años nazcan nuevas teorías.
Extensiones de la teoría
Se han propuesto varios enfoques para extender la validez de la ley a rangos de concentración que se encuentran comúnmente en química.
Una de esas ecuaciones extendidas de Debye-Hückel viene dada por:
La ecuación extendida de Debye-Hückel proporciona resultados precisos para μ ≤ 0,1. Para soluciones de mayor fuerza iónica, se deben utilizar las ecuaciones de Pitzer. En estas soluciones, el coeficiente de actividad puede aumentar con la fuerza iónica.
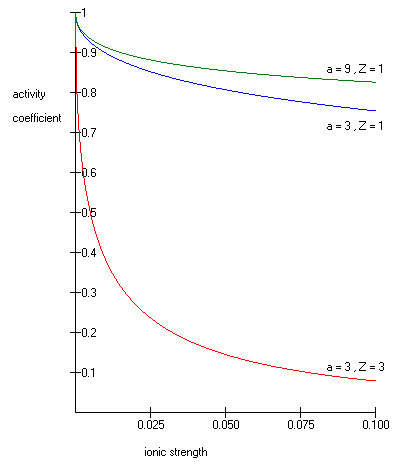
La ecuación de Debye-Hückel no se puede utilizar en soluciones de tensioactivos donde la presencia de micelas influye en las propiedades electroquímicas del sistema (incluso un juicio aproximado sobreestima γ en ~50%).


![{displaystyle a_{C}=gamma {frac {mathrm {[C]} }{mathrm {[C^{ominus }]} }},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/be92f44a5f84c543bf69144f4f84ee3549877477)
![{displaystyle mathrm {[C^{ominus }]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/02336b66ecb1c837c95c019d03c714fb5f78b009)
![{displaystyle mathrm {[C]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/3f23b1f7f94f3ef40a75868150dda7b7ab5cd4d6)
















































































































