Doble enlace
En química, un enlace doble es un enlace covalente entre dos átomos que involucra cuatro electrones de enlace en lugar de dos en un enlace simple. Los enlaces dobles ocurren más comúnmente entre dos átomos de carbono, por ejemplo, en los alquenos. Existen muchos enlaces dobles entre dos elementos diferentes: por ejemplo, en un grupo carbonilo entre un átomo de carbono y un átomo de oxígeno. Otros dobles enlaces comunes se encuentran en compuestos azoicos (N=N), iminas (C=N) y sulfóxidos (S=O). En una fórmula esquelética, un enlace doble se dibuja como dos líneas paralelas (=) entre los dos átomos conectados; tipográficamente, se utiliza el signo igual para esto. Los enlaces dobles fueron introducidos por primera vez en notación química por el químico ruso Alexander Butlerov.
Los enlaces dobles que involucran carbono son más fuertes y más cortos que los enlaces simples. El orden de enlace es dos. Los enlaces dobles también son ricos en electrones, lo que los hace potencialmente más reactivos en presencia de un fuerte aceptor de electrones (como en las reacciones de adición de los halógenos).
- Compuestos químicos con dobles lazos
Dobles enlaces en alquenos
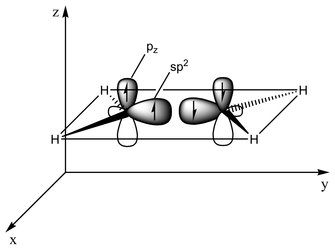
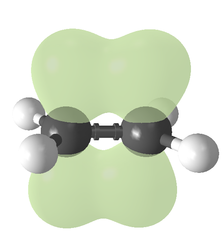
El tipo de enlace se puede explicar en términos de hibridación orbital. En el etileno, cada átomo de carbono tiene tres orbitales sp2 y un orbital p. Los tres orbitales sp2 se encuentran en un plano con ángulos de ~120°. El orbital p es perpendicular a este plano. Cuando los átomos de carbono se aproximan, dos de los orbitales sp2 se superponen para formar un enlace sigma. Al mismo tiempo, los dos orbitales p se acercan (nuevamente en el mismo plano) y juntos forman un enlace pi. Para una superposición máxima, los orbitales p deben permanecer paralelos y, por lo tanto, no es posible la rotación alrededor del enlace central. Esta propiedad da lugar a la isomería cis-trans. Los enlaces dobles son más cortos que los enlaces simples porque se maximiza la superposición del orbital p.
Con 133 pm, la longitud del enlace C=C del etileno es más corta que la longitud del enlace C−C en el etano con 154 pm. El doble enlace también es más fuerte, 636 kJ mol−1 frente a 368 kJ mol−1 pero no el doble, ya que el enlace pi es más débil que el enlace sigma debido a superposición pi menos efectiva.
En una representación alternativa, el doble enlace resulta de dos orbitales sp3 superpuestos como en un enlace doblado.
Variaciones
En moléculas con enlaces dobles y enlaces simples alternantes, la superposición del orbital p puede existir sobre múltiples átomos en una cadena, dando lugar a un sistema conjugado. La conjugación se puede encontrar en sistemas como dienos y enones. En las moléculas cíclicas, la conjugación puede conducir a la aromaticidad. En los cumulenos, dos dobles enlaces son adyacentes.
Los enlaces dobles son comunes para los elementos del período 2, carbono, nitrógeno y oxígeno, y menos comunes con elementos de períodos superiores. Los metales también pueden participar en enlaces múltiples en un enlace múltiple de ligando metálico.
Homólogos de alquenos del grupo 14
Compuestos de doble enlace, homólogos de alquenos, R2E=ER2 ahora se conocen para todos los elementos más pesados del grupo 14. A diferencia de los alquenos, estos compuestos no son planos, sino que adoptan estructuras torcidas y/o transversas. Estos efectos se vuelven más pronunciados para los elementos más pesados. El distaneno (Me3Si)2CHSn=SnCH(SiMe3)2 tiene un enlace estaño-estaño longitud un poco más corta que un enlace simple, una estructura trans doblada con coordinación piramidal en cada átomo de estaño, y se disocia fácilmente en solución para formar (Me3Si)2CHSn: (estananodiilo, un análogo de carbeno). El enlace consta de dos enlaces donador-aceptor débiles, el par solitario de cada átomo de estaño se superpone con el orbital p vacío del otro. Por el contrario, en los disilenos, cada átomo de silicio tiene una coordinación plana, pero los sustituyentes están torcidos, de modo que la molécula en su conjunto no es plana. En los diplumbenos, la longitud del enlace Pb=Pb puede ser más larga que la de muchos enlaces simples correspondientes. Los plombenos y los estannenos generalmente se disocian en solución en monómeros con entalpías de enlace que son solo una fracción de los enlaces simples correspondientes. Algunos dobles enlaces plumbenos y estannenos son similares en fuerza a los enlaces de hidrógeno. El modelo de Carter-Goddard-Malrieu-Trinquier se puede utilizar para predecir la naturaleza del enlace.
Tipos de dobles enlaces entre átomos
| C | O | N | S | Si | Ge | Sn | Pb | |
|---|---|---|---|---|---|---|---|---|
| C | alkene | carbonyl group | imine | thioketone, thial | ||||
| O | dioxigeno | compuesto de nitroso | sulfoxida, sulfona, ácido sulfúrico, ácido sulfónico | |||||
| N | compuesto de azo | |||||||
| S | disulfur | |||||||
| Si | alkylidenesilanes | silenes | ||||||
| Ge | gérmenes | |||||||
| Sn | stannenes | |||||||
| Pb | fontaneros |
Contenido relacionado
Heparina
Dióxido de circonio
Charles hachett