DIU de cobre
Dispositivo intrauterino (DIU) con cobre, también conocido como coil intrauterino o coil de cobre, es un tipo de dispositivo intrauterino que contiene cobre. Se utiliza para el control de la natalidad y la anticoncepción de emergencia dentro de los cinco días posteriores a la relación sexual sin protección. Es una de las formas más efectivas de control de la natalidad con una tasa de fracaso de un año de alrededor del 0,7%. El dispositivo se coloca en el útero y dura hasta doce años. Puede ser utilizado por mujeres de todas las edades independientemente de que hayan tenido o no hijos. Después de la eliminación, la fertilidad regresa rápidamente.
Los efectos secundarios pueden ser períodos menstruales abundantes o, en raras ocasiones, el dispositivo puede salirse. Se recomienda menos para personas con alto riesgo de infecciones de transmisión sexual, ya que puede aumentar el riesgo de enfermedad pélvica inflamatoria en las primeras tres semanas después de la inserción. Se recomienda para personas que no toleran o toleran poco los anticonceptivos hormonales. Si una mujer queda embarazada con un DIU colocado, se recomienda retirarlo. En muy raras ocasiones, se puede producir una perforación uterina durante la inserción si no se realiza correctamente. El DIU de cobre es un tipo de anticonceptivo reversible de acción prolongada. Funciona principalmente matando a los espermatozoides.
El DIU de cobre comenzó a usarse en medicina en la década de 1970. Está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud. Son utilizados por más de 170 millones de mujeres en todo el mundo.
Usos médicos
Los DIU de cobre son una forma de anticoncepción reversible de acción prolongada y son una de las formas más efectivas de control de la natalidad disponibles. El tipo de armazón y la cantidad de cobre pueden afectar la efectividad de los diferentes modelos de DIU de cobre. Las tasas de falla para diferentes modelos varían entre 0.1 y 2.2% después de 1 año de uso. Los modelos en forma de T con una superficie de cobre de 380 mm² tienen las tasas de falla más bajas. El TCu 380A (ParaGard) tiene una tasa de fallas de un año de 0,8 % y una tasa de fallas acumulada de 12 años de 2,2 %. A lo largo de 12 años de uso, los modelos con menor superficie de cobre tienen mayores índices de fallas. El TCu 220A tiene una tasa de fallas de 12 años del 5,8 %. El GyneFix sin marco tiene una tasa de fallas de menos del 1% por año. En todo el mundo, ya no se producen modelos de DIU más antiguos con tasas de efectividad más bajas.
A diferencia de otras formas de anticoncepción reversible, la tasa de falla de uso típica y la tasa de falla de uso perfecto para los DIU de cobre son las mismas porque el DIU no depende de la acción del usuario. Una revisión de 2008 de los DIU de cobre en forma de T disponibles recomendó que el TCu 380A y el TCu 280S se usaran como la primera opción para los DIU de cobre porque esos dos modelos tienen las tasas de falla más bajas y la vida útil más larga. La eficacia del DIU de cobre (tasa de falla del 0,8 %) es comparable a la esterilización tubárica (tasa de falla del 0,5 %) durante el primer año. Sin embargo, los efectos del DIU de cobre son reversibles, lo que puede verse como una ventaja o una desventaja, según los objetivos de anticoncepción de la persona.
Anticoncepción de emergencia
Se descubrió por primera vez en 1976 que el DIU de cobre podía usarse como una forma de anticoncepción de emergencia (AE). El DIU de cobre es la forma más eficaz de anticoncepción de emergencia. Es más efectivo que las píldoras EC hormonales actualmente disponibles. La tasa de embarazo entre las que usan el DIU de cobre para la AE es del 0,09%. Se puede usar para la AE hasta cinco días después del acto sexual sin protección y su eficacia no disminuye durante los cinco días. Una ventaja adicional de usar el DIU de cobre para la anticoncepción de emergencia es que se puede usar como método anticonceptivo durante 10 a 12 años después de la inserción.
Extracción y retorno a la fertilidad
La extracción del DIU de cobre también debe ser realizada por un médico calificado. Se ha demostrado que la fertilidad vuelve a los niveles anteriores rápidamente después de retirar el dispositivo. Un estudio encontró que la mediana de tiempo desde la extracción hasta el embarazo planificado fue de tres meses para aquellas mujeres que usaban el TCu 380Ag.
Efectos secundarios
Expulsión: en ocasiones, el DIU de cobre puede ser expulsado espontáneamente del útero. Las tasas de expulsión pueden oscilar entre el 2,2% y el 11,4% de los usuarios desde el primer año hasta el décimo año. El TCu380A puede tener tasas de expulsión más bajas que otros modelos. El flujo vaginal inusual, los calambres o el dolor, el manchado entre períodos, el manchado poscoital (después del sexo), la dispareunia o la ausencia o el alargamiento de los hilos pueden ser signos de una posible expulsión. Si se produce la expulsión, la mujer no está protegida contra el embarazo. Si se inserta un DIU con cobre después de que se haya producido una expulsión, se ha estimado en un estudio que el riesgo de reexpulsión es de aproximadamente un tercio de los casos después de un año. Las imágenes por resonancia magnética (IRM) pueden causar la dislocación de un DIU de cobre y, por lo tanto, se recomienda verificar la ubicación del DIU antes y después de la IRM.
Perforación: en muy raras ocasiones, el DIU puede atravesar la pared del útero. El riesgo de perforación está determinado principalmente por la habilidad del médico que realiza la inserción. Para los médicos experimentados, el riesgo de perforación es de 1 por cada 1000 inserciones o menos. Se recomienda consultar a un obstetra/ginecólogo, que tenga el equipo para insertar correctamente el DIU y verificar que no se mueva durante los meses posteriores a la inserción.
Infección: la inserción de un DIU de cobre presenta un riesgo transitorio de enfermedad pélvica inflamatoria (EPI) en los primeros 21 días después de la inserción. Sin embargo, es un riesgo pequeño y es atribuible a una infección preexistente de gonorrea o clamidia en el momento de la inserción, y no al DIU en sí. Los procedimientos adecuados de prevención de infecciones tienen poco o ningún efecto sobre el curso de las infecciones por gonorrea o clamidia, pero son importantes para ayudar a proteger tanto a los clientes como a los proveedores de infecciones en general. Dichas prácticas de prevención de infecciones incluyen lavarse las manos y luego ponerse guantes, limpiar el cuello uterino y la vagina, hacer un contacto mínimo con superficies no estériles (utilizando una técnica de inserción sin contacto) y, después del procedimiento, lavarse las manos nuevamente y luego procesar los instrumentos.. El dispositivo en sí no conlleva un mayor riesgo de EIP más allá del momento de la inserción.
Cólicos: algunas mujeres pueden sentir calambres durante el proceso de inserción del DIU e inmediatamente después como resultado de la dilatación del cuello uterino durante la inserción. Tomar AINE antes del procedimiento a menudo reduce las molestias, al igual que el uso de un anestésico local. El misoprostol de 6 a 12 horas antes de la inserción puede ayudar con la dilatación cervical. Algunas mujeres pueden tener calambres durante 1 a 2 semanas después de la inserción.
Períodos más intensos: el DIU de cobre puede aumentar la cantidad de flujo sanguíneo durante los períodos menstruales de una mujer. En promedio, la pérdida de sangre menstrual puede aumentar en un 20 a 50% después de la inserción de un DIU T de cobre; Este síntoma puede desaparecer para algunas mujeres después de 3 a 6 meses.
Sangrado irregular y manchado: para algunas mujeres, el DIU de cobre puede causar manchado entre períodos durante los primeros 3 a 6 meses después de la inserción.
Embarazo: aunque es raro, si se produce un embarazo con el DIU de cobre colocado, puede haber efectos secundarios. El riesgo de embarazo ectópico para una mujer que usa un DIU es menor que el riesgo de embarazo ectópico para una mujer que no usa ningún método anticonceptivo. Sin embargo, de los embarazos que ocurren durante el uso del DIU, un porcentaje mayor al esperado (3-4%) son ectópicos. Si se produce un embarazo con el DIU colocado, existe un mayor riesgo de aborto espontáneo o parto prematuro. Si esto ocurre y los hilos del DIU son visibles, un médico debe retirar el DIU de inmediato. Aunque el DIU Dalkon Shield se asoció con abortos sépticos (infecciones asociadas con el aborto espontáneo), otras marcas de DIU no lo están. Los DIU tampoco están asociados con defectos de nacimiento.
Algunos anticonceptivos de barrera protegen contra las ITS. Los anticonceptivos hormonales reducen el riesgo de desarrollar enfermedad pélvica inflamatoria (EIP), una complicación grave de ciertas ITS. Los DIU, por el contrario, no protegen contra las ITS o la EIP.
Toxicidad por cobre: Existe evidencia anecdótica que relaciona los DIU de cobre con casos de toxicidad por cobre.
Contraindicaciones
Una condición de categoría 3 indica condiciones en las que los riesgos teóricos o comprobados generalmente superan las ventajas de insertar un DIU de cobre. Una condición de categoría 4 indica condiciones que representan un riesgo inaceptable para la salud si se inserta un DIU de cobre.
Las mujeres no deben usar un DIU de cobre si:
(Categoría 4)
- Están embarazadas o piensan que pueden estar embarazadas
- Tener ciertas anomalías uterinas
- Tener enfermedad trofoblástica maligna
- Tener o tener una ETS
- Tener o haber tenido una infección pélvica en los últimos tres meses
- Tener tuberculosis pélvica
- Tener sangrado vaginal anormal sin explicación
- Tener cáncer cervical no tratado
- Tener cáncer uterino
- Tener un embarazo séptico o un aborto
(Categoría 3)
- Son postparto entre 48 horas y 4 semanas (aumento de la tasa de expulsión del DIU con la inserción tardía del postparto). Los criterios del CDC y la OMS difieren en su recomendación para las mujeres después de 48 horas a 4 semanas. El CDC no enumera esto como una contraindicación.
- Tener SIDA (a menos clínicamente bien en terapia antirretroviral)
- Tener enfermedad trofoblástica benigna gestacional
- Tener cáncer de ovario
- Tener muy alta probabilidad individual de exposición a la gonorrea o las infecciones de transmisión sexual
Puede encontrar una lista completa de contraindicaciones en los Criterios médicos de elegibilidad para el uso de anticonceptivos de la Organización Mundial de la Salud (OMS) y los Centros para el Control y la Prevención de Enfermedades (CDC) Elegibilidad médica de los Estados Unidos Criterios para el Uso de Anticonceptivos.
Ser nulípara (mujeres que nunca han dado a luz) no es una contraindicación para el uso del DIU. Los DIU son seguros y aceptables incluso en mujeres nulíparas jóvenes. Es probable que ocurra lo mismo con las mujeres vírgenes, a menos que haya un himen microperforado que obstruya cualquier inserción del DIU.
Descripción del dispositivo
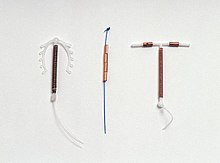
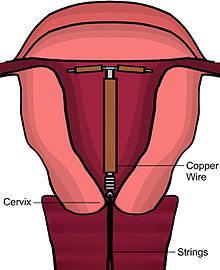
Hay varios modelos de DIU de cobre disponibles en todo el mundo. La mayoría de los dispositivos de cobre consisten en un núcleo de plástico envuelto en un cable de cobre. Muchos de los dispositivos tienen forma de T similar al DIU hormonal. Sin embargo, hay "sin marco" DIU de cobre disponibles también. ParaGard es el único modelo actualmente disponible en los Estados Unidos. Al menos tres modelos de DIU de cobre están disponibles en Canadá, dos de los cuales son versiones más delgadas en forma de T que se usan para mujeres que no han tenido hijos. Los primeros DIU de cobre tenían cobre solo alrededor del vástago vertical, pero los modelos más recientes también tienen fundas de cobre envueltas alrededor de los brazos horizontales, lo que aumenta la eficacia.
Algunos modelos más nuevos también contienen un núcleo plateado en lugar de un núcleo de plástico para retrasar la fragmentación del cobre y aumentar la vida útil del dispositivo. La vida útil de los dispositivos oscila entre 3 y 10 años; sin embargo, algunos estudios han demostrado que el TCu 380A puede ser efectivo durante 12 años.
Su código ATC es G02BA (WHO).
Inserción
El DIU de cobre debe ser insertado por un médico calificado. Se recomienda consultar a un obstetra/ginecólogo, que tenga el equipo para insertar correctamente el DIU y verificar que no se mueva durante los meses posteriores a la inserción. Se puede insertar un DIU de cobre en cualquier fase del ciclo menstrual, pero el momento óptimo es justo después del período menstrual, cuando el cuello uterino está más blando y es menos probable que la mujer quede embarazada. El proceso de inserción generalmente toma cinco minutos o menos. El procedimiento puede causar calambres o ser doloroso para algunas mujeres. Antes de la colocación de un DIU, un historial médico y un examen físico por parte de un profesional médico son útiles para verificar si hay contraindicaciones o inquietudes. Algunos médicos también recomiendan que los pacientes se hagan pruebas de gonorrea y clamidia, ya que estas dos infecciones aumentan el riesgo de contraer la enfermedad pélvica inflamatoria poco después de la inserción.
Inmediatamente antes de la inserción, el médico realizará un examen pélvico para determinar la posición del útero. Después del examen pélvico, la vagina se mantiene abierta con un espéculo. Se utiliza un tenáculo para estabilizar el cuello uterino y el útero. El sondeo uterino se puede usar para medir la longitud y la dirección del canal cervical y el útero para disminuir el riesgo de perforación uterina. El DIU se coloca mediante un tubo estrecho, que se inserta a través del cuello uterino hasta el útero. Cuerdas cortas de monofilamento de plástico/nylon cuelgan desde el útero hasta la vagina. El médico recortará los hilos para que solo sobresalgan de 3 a 4 cm del cuello uterino y permanezcan en la parte superior de la vagina. Los hilos permiten que el paciente o el médico verifiquen periódicamente para asegurarse de que el DIU aún esté en su lugar y para facilitar la extracción del dispositivo.
El DIU de cobre se puede insertar en cualquier momento del ciclo menstrual de una mujer siempre que la mujer no esté embarazada. También se puede insertar un DIU inmediatamente después del parto y después del aborto, siempre que no se haya producido una infección. La lactancia materna no es una contraindicación para el uso del DIU de cobre. El DIU se puede insertar en mujeres con VIH o SIDA ya que no aumenta el riesgo de transmisión. Aunque anteriormente no se recomendaba para mujeres nulíparas (mujeres que no han tenido hijos), ahora se recomienda el DIU para la mayoría de las mujeres que ya pasaron la menarquia (su primer período), incluidas las adolescentes.
Una vez finalizada la inserción, se pueden realizar actividades normales como el sexo, el ejercicio y la natación tan pronto como se sienta cómodo. La actividad física extenuante no afecta la posición del DIU.
Tipos
Actualmente, se fabrican muchos tipos diferentes de DIU de cobre en todo el mundo, pero la disponibilidad varía según el país. En los Estados Unidos, solo se aprueba el uso de un tipo de DIU de cobre, mientras que en el Reino Unido hay más de diez variedades disponibles. Una empresa, Mona Lisa N.V., ofrece versiones genéricas de muchos DIU existentes.
| IUD | Tipo | Width
(mm) | Duración (mm) | Cobre (mm2) | Vida (años) | Fabricantes | Características destacadas |
|---|---|---|---|---|---|---|---|
| Gyneplus Cu 380 | En forma de T | 380 | 5 | Dispo.Cont. | |||
| Multiload Cu375 | En forma de U | 20,5 | 35 | 375 | 5 | Multilan | |
| Multiload Cu250 | En forma de U | 250 | 3 | Multilan | |||
| Multi-Safe 375 | En forma de U | 19,5 | 32,5 | 375 | 5 | Williams Medical Supplies | |
| Multi-Safe 375 Short Loop | En forma de U | 375 | 5 | Williams Medical Supplies | |||
| Carga 375 | En forma de U | 19,5 | 32,5 | 375 | 5 | 7-MED Industrie | |
| Nova-T 380 | En forma de T (plain) | 32 | 32 | 380 | 5 | Bayer | |
| Neo-Safe T 380 | En forma de T (plain) | 32 | 32 | 380 | 5 | Durbin | |
| Neo-Safe T 380 Mini | En forma de T (plain) | 24 | 30 | 380 | 5 | Durbin | |
| UT 380 | En forma de T (plain) | 32 | 32 | 380 | 5 | Laboratoire CCD | |
| UT 380 Short | En forma de T (plain) | 32 | 28.4 | 380 | 5 | Laboratoire CCD | |
| Flexi-T 300 | En forma de T (plain) | 23 | 29 | 300 | 5 | Prosan | |
| Flexi-T + 300 | En forma de T (plain) | 28 | 32 | 300 | 5 | Prosan | Brazos más anchos que Flexi-T 300 |
| T-safe CU 380A | En forma de T (marido) | 31.8 | 35,8 | 380 | 8 | Durbin | |
| Flexi-T + 380 | En forma de T (marido) | 28 | 32 | 380 | 5 | Prosan | |
| TT 380 Slimline | En forma de T (marido) | 31.8 | 35,8 | 380 | 10 | 7-MED Industrie | |
| TT 380 Mini | En forma de T (marido) | 23.2 | 29,5 | 380 | 5 | 7-MED Industrie | |
| Paragard | En forma de T (marido) | 32 | 36 | 380 | 10 | Duramed | Sólo el DIU de cobre actualmente aprobado por la FDA estadounidense |
| Gynefix 330 (estándar) | Frameless | 2.2 | 30 | 330 | 5 o 10 | Contrel | Solo marca IUD sin marco disponible |
| Gynefix 200 (mini) | Frameless | 200 | 5 | Contrel | Solo marca IUD sin marco disponible | ||
| IUB SCu300A/B | Spherical (3D) | 300 | 5 | OCON | Marco de aleación de Nitinol. El nombre de la marca es Ballerine. | ||
| SMB TCu 380A | En forma de T (marido) | 32 | 36 | 380 | 10 | SMB corp | OMS UNFPA Fabricantes de DIU precalificados |
| Proteger TCu 380A | En forma de T (marido) | 380 | 12 | SMB corp | OMS UNFPA Fabricantes de DIU precalificados | ||
| Proteger Multiarma Cu 375 estándar | En forma de U | 375 | 5 | SMB corp | OMS UNFPA Fabricantes de DIU precalificados | ||
| Proteger Multiarma Cu 375 corto | En forma de U | 375 | 5 | SMB corp | OMS UNFPA Fabricantes de DIU precalificados |
DIU sin marco
El DIU sin marco elimina el uso del marco que le da a los DIU convencionales su característica forma de T. Este cambio en el diseño se realizó para reducir la incomodidad y la expulsión asociadas con los DIU anteriores; sin un marco sólido, el DIU sin marco debe amoldarse a la forma del útero. Puede reducir las tasas de expulsión y discontinuación en comparación con los DIU de cobre enmarcados.
Gynefix es la única marca de DIU sin marco disponible actualmente. Consiste en tubos huecos de cobre sobre un hilo de polipropileno. Se inserta a través del cuello uterino con un aplicador especial que sutura el hilo al fondo (parte superior) del útero; Luego, el hilo se corta con una cola que cuelga fuera del cuello uterino, similar a los DIU de marco. Cuando se tira de esta cola, la sutura se deshace y se puede quitar el dispositivo. Esto requiere más fuerza que la extracción de un DIU en forma de T y produce una incomodidad comparable durante la extracción. Gynefix no está aprobado para su uso en los Estados Unidos.
Mecanismo de acción
El principal mecanismo de acción del DIU de cobre es evitar la fertilización. El cobre actúa como espermicida dentro del útero. La presencia de cobre aumenta los niveles de iones de cobre, prostaglandinas y glóbulos blancos dentro de los fluidos uterinos y tubáricos.
Aunque no es un mecanismo de acción primario, algunos expertos en reproducción humana creen que hay evidencia suficiente para sugerir que los DIU con cobre pueden interrumpir la implantación, especialmente cuando se usan como anticoncepción de emergencia. A pesar de esto, no ha habido evidencia definitiva de que las usuarias de DIU tengan tasas más altas de pérdida embrionaria que las mujeres que no usan métodos anticonceptivos. Por lo tanto, el DIU de cobre se considera un verdadero anticonceptivo y no un abortivo.
Uso
A nivel mundial, el DIU es el método anticonceptivo reversible más utilizado. Los datos más recientes indican que hay 169 millones de usuarias de DIU en todo el mundo. Esto incluye tanto los DIU no hormonales como los hormonales. Los DIU son más populares en Asia, donde la prevalencia es de casi el 30%. En África y Europa, la prevalencia ronda el 20%. A partir de 2009, los niveles de uso del DIU en los Estados Unidos se estiman en un 5,5%. Los datos en los Estados Unidos no distinguen entre DIU hormonales y no hormonales. En Europa, la prevalencia del DIU de cobre oscila entre menos del 5 % en el Reino Unido y más del 10 % en Dinamarca en 2006.
Historia
Según la leyenda popular, los comerciantes árabes introducían pequeñas piedras en el útero de sus camellos para evitar el embarazo durante las largas caminatas por el desierto. La historia era originalmente un cuento fantástico para entretener a los delegados en una conferencia científica sobre planificación familiar; aunque luego se repitió como verdad, no tiene una base histórica conocida.
Los precursores de los DIU se comercializaron por primera vez en 1902. Desarrollados a partir de pesarios de vástago (donde el vástago mantenía el pesario en su lugar sobre el cuello uterino), el 'vástago' en estos dispositivos en realidad se extendía hasta el útero mismo. Debido a que ocupaban tanto la vagina como el útero, este tipo de pesario de vástago también se conocía como dispositivo intrauterino. El uso de dispositivos intrauterinos se asoció con altas tasas de infección; por ello, fueron condenados por la comunidad médica.
El primer dispositivo intrauterino (contenido completamente en el útero) se describió en una publicación alemana en 1909, aunque parece que el autor nunca comercializó su producto.
En 1929, Ernst Gräfenberg de Alemania publicó un informe sobre un DIU hecho con suturas de seda. Había encontrado una tasa de embarazo del 3% entre 1.100 mujeres que usaban su anillo. En 1930, Gräfenberg informó una tasa de embarazo más baja del 1,6 % entre 600 mujeres que usaban un anillo mejorado envuelto en alambre de plata. Sin el conocimiento de Gräfenberg, el alambre de plata estaba contaminado con un 26 % de cobre. El papel del cobre en el aumento de la eficacia del DIU no se reconocería hasta casi 40 años después.
En 1934, el médico japonés Tenrei Ota desarrolló una variación del anillo de Gräfenberg que contenía una estructura de apoyo en el centro. La adición de este disco central redujo la tasa de expulsión del DIU. Estos dispositivos todavía tenían altas tasas de infección, y su uso y desarrollo fueron reprimidos aún más por la política de la Segunda Guerra Mundial: la anticoncepción estaba prohibida tanto en la Alemania nazi como en el Japón aliado del Eje. Los aliados no se enteraron del trabajo de Gräfenberg y Ota hasta mucho después de que terminó la guerra.
El primer DIU de plástico, la Espiral de Margulies o Espiral de Margulies, se introdujo en 1958. Este dispositivo era algo grande y causaba molestias a una gran proporción de usuarias, y tenían una cola de plástico duro, causando molestias a sus parejas masculinas. El coloquialismo moderno "bobina" se basa en el diseño en forma de espiral de los primeros DIU.
El Lippes Loop, un dispositivo un poco más pequeño con una cola de monofilamento, se introdujo en 1962 y ganó popularidad sobre el dispositivo Margulies.
El DIU de acero inoxidable de un solo anillo se desarrolló en la década de 1970 y se usa ampliamente en China debido a los bajos costos de fabricación. El gobierno chino prohibió la producción de DIU de acero en 1993 debido a las altas tasas de fallas (hasta 10% por año).
Howard Tatum, en los EE. UU., concibió el DIU de plástico en forma de T en 1968. Poco después, Jaime Zipper, en Chile, presentó la idea de agregar cobre a los dispositivos para mejorar su eficacia anticonceptiva. Se descubrió que los dispositivos que contienen cobre se pueden fabricar en tamaños más pequeños sin comprometer la eficacia, lo que genera menos efectos secundarios, como dolor y sangrado. Los dispositivos en forma de T tenían tasas de expulsión más bajas debido a su mayor similitud con la forma del útero.
El DIU de plástico Dalkon Shield mal diseñado (que tenía una cola multifilamento) fue fabricado por A. H. Robins Company y vendido por Robins en los Estados Unidos durante tres años y medio, desde enero de 1971 hasta junio de 1974, antes de que las ventas fueran suspendidas por Robins el 28 de junio de 1974, a pedido de la FDA debido a problemas de seguridad luego de informes de 110 abortos sépticos espontáneos en mujeres con el Dalkon Shield colocado, siete de los cuales habían muerto. Robins detuvo las ventas internacionales del Dalkon Shield en abril de 1975.
Tatum desarrolló muchos modelos diferentes de DIU de cobre. Creó el TCu220 C, que tenía collares de cobre en lugar de un filamento de cobre, lo que evitaba la pérdida de metal y aumentaba la vida útil del dispositivo. Los DIU T de cobre de segunda generación también se introdujeron en la década de 1970. Estos dispositivos tenían áreas de superficie más altas de cobre y, por primera vez, lograron índices de efectividad superiores al 99 %. El último modelo que desarrolló Tatum fue el TCu380A, el modelo más recomendado en la actualidad. Además de los DIU en forma de T, también hay DIU en forma de U (como el Multiload) y Gravigard Copper 7 en forma de 7 (con una versión mini para mujeres nulíparas introducida en la década de 1980). Más recientemente, se introdujo un DIU sin marco llamado Gynefix.
Marcas
El ParaGard T-380A es un DIU con cobre, fabricado y comercializado en Estados Unidos por The Cooper Companies. Es el único dispositivo intrauterino que contiene cobre aprobado para su uso en los EE. UU. (también están aprobados tres dispositivos uterinos hormonales, Mirena, Skyla y Liletta). El ParaGard consta de un marco de polietileno en forma de T enrollado con alambre de cobre, junto con dos hilos de monofilamento para ayudar en la extracción del DIU.
El ParaGard T 380A fue desarrollado en la década de 1970 por el Consejo de Población y Finishing Enterprises Inc. (FEI). La solicitud de nuevo fármaco (NDA) ParaGard del Consejo de Población fue aprobada por la Administración de Drogas y Alimentos de los Estados Unidos (FDA) y FEI comenzó a fabricarlo para su distribución fuera de los Estados Unidos en 1984. GynoPharma (originalmente GynoMed) comenzó a comercializarlo en los en mayo de 1988. El 2 de agosto de 1995, Ortho-McNeil adquirió GynoPharma y comenzó a comercializar ParaGard en los EE. UU. El 1 de enero de 2004, FEI Women's Health adquirió la patente del Consejo de Población y los derechos de comercialización en EE. McNeil. El 10 de noviembre de 2005, Duramed Pharmaceuticals, una subsidiaria de Barr Pharmaceuticals, adquirió FEI Women's Health y ParaGard. El 18 de julio de 2008, se anunció que Teva Pharmaceutical Industries Ltd. adquiriría Barr Pharmaceuticals.
El 1 de noviembre de 2017, The Cooper Companies adquirió Paragard de Teva Pharmaceutical Industries por aproximadamente 1100 millones de dólares.
La aprobación original de la FDA de ParaGard en 1984 fue por 4 años de uso continuo, luego se extendió a 6 años en 1989, luego a 8 años en 1991, luego a 10 años en 1994. (Código ATC G02BA02 (OMS))
Contenido relacionado
Morbilidad asociada a la obesidad
Área de Broca
Obesidad y cáncer