Distrofia muscular de cinturas y extremidades
Distrofia muscular de cinturas y extremidades (LGMD) es un grupo genéticamente heterogéneo de distrofias musculares raras que comparten un conjunto de características clínicas. Se caracteriza por una atrofia muscular progresiva que afecta predominantemente a los músculos de la cadera y los hombros. La LGMD suele tener un patrón de herencia autosómico. Actualmente no se conoce cura ni tratamiento.
La LGMD puede ser desencadenada o empeorada en individuos genéticamente susceptibles por las estatinas, debido a sus efectos sobre la HMG-CoA reductasa
Signos y síntomas
Por definición, todas las distrofias musculares de cinturas (DGM) causan debilidad proximal progresiva, es decir, debilidad de los músculos en el torso o cerca de él que empeora con el tiempo. Explícitamente, LGMD afecta preferentemente a los músculos de la cintura cadera, muslo, cintura escapular y/o parte superior del brazo. La debilidad muscular es generalmente simétrica. Por lo general, la cintura cadera es la primera área que muestra debilidad, manifestándose como dificultad para caminar, subir y/o bajar escaleras, levantarse de una silla, doblar la cintura o ponerse en cuclillas. Debido a estas dificultades, las caídas pueden ocurrir con frecuencia. La debilidad de la cintura escapular puede hacer que levantar objetos, o incluso elevar los brazos, sea difícil o imposible. La tasa de progresión varía entre pacientes. Con el tiempo, la capacidad para correr y caminar puede deteriorarse. La enfermedad comúnmente conduce a la dependencia de una silla de ruedas a los pocos años de la aparición de los síntomas, aunque algunos pacientes mantienen la movilidad. Con el tiempo, la enfermedad puede afectar a otros músculos como los situados en la cara.
Por definición, las LGMD afectan principalmente a los músculos esqueléticos, aunque el músculo cardíaco puede verse afectado en menor grado en subtipos seleccionados, lo que puede causar palpitaciones.
Puede haber una variabilidad significativa en las características y la gravedad de la enfermedad entre los subtipos de LGMD, e incluso dentro de cualquier subtipo de LGMD determinado. Otras posibles presentaciones incluyen:
- Pseudohipertrofia
- Hipertrofia muscular
- Problemas musculares respiratorios
- Incomodidad de espalda baja
- Problemas musculares distales
- Escapula ganada
En la mayoría de los casos, la LGMD no presenta dolor y la función mental no se ve afectada. La LGMD puede comenzar en la infancia, la adolescencia, la edad adulta temprana o incluso más tarde, la edad de aparición suele ser entre los 10 y los 30 años. Ambos sexos se ven afectados por igual. Cuando la distrofia muscular de cinturas comienza en la infancia, la progresión parece ser más rápida y la enfermedad más incapacitante. Cuando el trastorno comienza en la adolescencia o la edad adulta, la enfermedad generalmente no es tan grave y progresa más lentamente. No hay neuropatía sensorial ni disfunción autonómica o visceral en el momento de la presentación.
Genética

La LGMD es un trastorno genético y hereditario, debido a una de las muchas mutaciones genéticas de proteínas implicadas en la función muscular. Todas las LGMD identificadas actualmente tienen un patrón de herencia dominante o recesivo, aunque la definición de LGMD permite clasificar como LGMD las enfermedades con patrones de herencia más complicados. Las mutaciones patógenas se encuentran principalmente en regiones codificantes, pero también se informaron variantes causantes no codificantes. En Euroasia las mutaciones CAPN3 son la causa más común de LGMD, sin embargo en el norte de Europa las mutaciones en FKRP también son muy comunes. La mutación homocigótica de la HMG CoA reductasa conduce a una forma de LGMD que puede responder al tratamiento con el metabolito mevalonolactona en la vía de síntesis del colesterol.
Diagnóstico
El diagnóstico de distrofia muscular de cinturas y extremidades se puede realizar mediante una biopsia muscular, que mostrará la presencia de distrofia muscular, y se utilizan pruebas genéticas para determinar qué tipo de distrofia muscular tiene un paciente. Las pruebas inmunohistoquímicas de distrofina pueden indicar una disminución de la distrofina detectada en las sarcoglicanopatías. En términos de deficiencia de sarcoglicano, puede haber variaciones (si α-sarcoglicano y γ-sarcoglicano no están presentes, entonces hay una mutación en LGMD2D).
El Resumen de la guía basada en evidencia de 2014: Diagnóstico y tratamiento de distrofias distales y de cinturas indica que las personas sospechosas de tener el trastorno hereditario deben someterse a pruebas genéticas. Otras pruebas/análisis son:
- Altos niveles de CK(x10-150 veces normales)
- MRI puede indicar diferentes tipos de LGMD.
- EMG puede confirmar la característica miopática de la enfermedad.
- Electrocardiografía (acárcitmias en LGMD1B pueden ocurrir)
Tipos
El "LGMD D" La familia es autosómica dominante y la familia "LGMD R" La familia es autosómica recesiva. La distrofia muscular de cinturas se explica en términos de gen, locus, OMIM y tipo de la siguiente manera:
| Nombre | Herencia | Nombre antiguo | OMIM | Gene | Gene también implicado en: | Notas |
|---|---|---|---|---|---|---|
| LGMD D1 DNAJB6-related | Autosómica dominante | LGMD1D | 603511 | DNAJB6 | ||
| LGMD D2 NPT03-related | LGMD1F | 608423 | NPTO3 | |||
| LGMD D3 HNRNPDL-related | LGMD1G | 609115 | HNRPDL | |||
| LGMD D4 calpain3-related | LGMD1I | 618129 | CAPN3 | LGMD R1 | También se conoce como "capainopatía dominante autosómica". | |
| Miopatía de Bethlem 1
colágeno 6 relacionados | LGMD D5 | 158810 | COL6A1, COL6A2, COL6A3 | muscular congénita distrofia, LGMD R22 | ||
| LGMD R1 calpain3-related | Receptivo autosómico | LGMD2A | 253600 | CAPN3 | LGMD D4 | También se conoce como "capainopatía recesiva autosómica". |
| LGMD R2 dysferlin-related | LGMD2B | 253601 | DYSF | Miyoshi miopatía tipo 1 (MMD1 - 254130). | Una disferlinopatía | |
| LGMD R3 α-sarcoglycan-related | LGMD2D | 608099 | SGCA | sarcoglycanopathies | ||
| LGMD R4 β -sarcoglycan-related | LGMD2E | 604286 | SGCB | |||
| LGMD R5 γ -sarcoglycan-related | LGMD2C | 253700 | SGCG | |||
| LGMD R6 δ-sarcoglycan-related | LGMD2F | 601287 | SGCD | |||
| LGMD R7 Telethonin-related | LGMD2G | 601954 | TCAP | |||
| LGMD R8 TRIM 32-relacionado | LGMD2H | 254110 | TRIM32 | |||
| LGMD R9 FKRP-related | LGMD2I | 607155 | FKRP | Distrofia muscular congénita | Una distrocidad α | |
| LGMD R10 Titin-related | LGMD2J | 608807 | TTN | Miopatía congénita | ||
| LGMD R11 POMT1 | LGMD2K | 609308 | POMT1 | Distrofia muscular congénita | Una distrocidad α | |
| LGMD R12 anoctamin5-related | LGMD2L | 611307 | ANO5 | Miyoshi miopatía tipo 3 (MMD3 - 613319) | ||
| LGMD R13 Fukutin-related | LGMD2M | 611588 | FKTN | Distrofia muscular congénita | Una distrocidad α | |
| LGMD R14 POMT2-related | LGMD2N | 607439 | POMT2 | Distrofia muscular congénita | Una distrocidad α | |
| LGMD R15 POMGnT1 | LGMD2O | 606822 | POMGNT1 | Distrofia muscular congénita | Una distrocidad α | |
| LGMD R16 α-dystroglycan-related | LGMD2P | 613818 | DAG1 | Distrofia muscular congénita | Una distrocidad α | |
| LGMD R17 plectin-related | LGMD2Q | 613723 | PLEC1 | |||
| LGMD R18 TRAPPC11-related | LGMD2S | 615356 | TRAPPC11 | |||
| LGMD R19 GMPPB-related | LGMD2T | 615352 | GMPPB | Distrofia muscular congénita | Una distrocidad α | |
| LGMD R20 ISPD | LGMD2U | 616052 | ISPD | Distrofia muscular congénita | Una distrocidad α | |
| LGMD R21 POGLUT1-related | LGMD2Z | 617232 | POGLUT1 | |||
| LGMD R22 colágeno 6 relacionado | Bethlem miopatía recesiva | COL6A1, COL6A2, COL6A3 | Distrofia muscular congénita, LGMD D5 | |||
| LGMD R23 laminin α2-related | distrofia muscular relacionada con la α2 | 156225 | LAMA2 | Distrofia muscular congénita | ||
| LGMD R24 POMGNT2-related | Distrofia muscular relacionada con POMGNT2 | 618135 | POMGNT2 | Distrofia muscular congénita | Una distrocidad α | |
| LGMD R25 | LGMD2X | POPDC1 | ||||
| LGMD R26 | POPDC3 | |||||
| LGMD R27 | JAG2 | |||||
| LGMD R(número pendiente) | PYROXD1 |
Criterios LGMD
Para que una entidad patológica se clasifique como LGMD, se deben cumplir los siguientes criterios:
- genética, con un patrón de herencia identificable como dominante autosómico, recesivo autosómico, digenico o poligénico.
- relativamente selectivo para el músculo esquelético
- la implicación muscular predominantemente proximal
- caminar independiente se logra en un punto de vida
- cinase sérico elevado
- pérdida de fibra muscular
- cambios distróficos en la histología muscular
- cambios degenerativos en la imagen médica
- patología del estadio final vista en los músculos más afectados
- descritas en al menos dos familias no relacionadas
Diferencial
Muchas enfermedades pueden manifestarse de manera similar a la LGMD. Las distrofinopatías, incluida la distrofia muscular de Duchenne, la distrofia muscular de Becker y la distrofinopatía que se manifiesta en mujeres portadoras, pueden presentarse de manera similar a la LGMD. La distrofia muscular facioescapulohumeral puede aparecer de manera similar, especialmente cuando respeta los músculos faciales. También en el diferencial se encuentran las distrofias musculares de Emery-Dreifuss, la enfermedad de Pompe, los síndromes miasténicos congénitos de aparición tardía y las neuropatías motoras hereditarias de predominio proximal.
Tratamiento

Existen pocos estudios que corroboren la eficacia del ejercicio para la distrofia muscular de cinturas. Sin embargo, los estudios han demostrado que el ejercicio puede, de hecho, dañar los músculos de forma permanente debido a la intensa contracción muscular. Es posible que se requiera fisioterapia para mantener la mayor fuerza muscular y flexibilidad de las articulaciones posible. Se pueden utilizar calibradores para mantener la movilidad y la calidad de vida. Se requiere atención cuidadosa a la salud pulmonar y cardíaca; los corticosteroides en individuos LGMD 2C-F muestran cierta mejoría. Además, las personas pueden seguir la administración que sigue:
- Terapia ocupacional
- Terapia respiratoria
- Terapia de habla
- No debe perseguirse el anticuerpo neutralizador a la miostatina
Las sarcoglicanopatías podrían posiblemente ser susceptibles de terapia génica.
Pronóstico
En términos del pronóstico de la distrofia muscular de cinturas y extremidades en su forma más leve, los individuos afectados tienen una fuerza y función muscular casi normal. La LGMD no suele ser una enfermedad mortal, aunque eventualmente puede debilitar el corazón y los músculos respiratorios, provocando enfermedades o la muerte debido a trastornos secundarios.
Epidemiología
La prevalencia mínima de distrofia muscular de cinturas y extremidades, como grupo, probablemente oscila entre 2,27 y 10 por 100.000 (1:44.000 a 1:10.000). La LGMD es la cuarta distrofia muscular más común, después de las distrofinopatías, las distrofias miotónicas y la distrofia muscular facioescapulohumeral. La prevalencia de LGMD individuales, según se ha estudiado en los Estados Unidos, en orden descendente, son aquellas debidas a la mutación de 1) calpaína, 2) disferlina, 3) colágeno VI, 4) sarcoglicanos, 5) anoctamina 5 y 6) fukutina- proteína relacionada. En Euroasia las mutaciones CAPN3 son la causa más común de LGMD, sin embargo en el norte de Europa las mutaciones en FKRP también son muy comunes. Es difícil calcular la prevalencia mundial incluso de los tipos de LGMD más comunes, debido al efecto fundador que provoca variaciones en la prevalencia según la región. Los tipos menos comunes son muy raros y a menudo solo se describen en regiones limitadas del mundo.
Historia
El término 'distrofia muscular de cinturas' se publicó en 1954 y describía un grupo de afecciones heterogéneas que los médicos observaron como distintas de la distrofia muscular de Duchenne, la distrofia muscular facioescapulohumeral y la distrofia miotónica. La genética de las LGMD comenzó a comprenderse a finales del siglo XX, lo que llevó al Centro Neuromuscular Europeo (ENMC) a establecer un consenso sobre la clasificación de las LGMD en 1995. El esquema de clasificación en ese momento denotaba las LGMD autosómicas dominantes como "LGMD1" 39; y LGMD autosómicas recesivas como 'LGMD2.' Se añadió una letra a los nombres de las LGMD según el orden de descubrimiento de la mutación genética causal. Cuando se estableció LGMD2Z, surgió la pregunta de qué letra asignar al próximo LGMD2 descubierto. Con esta cuestión, entre otros motivos, la ENMC estableció un nuevo consenso sobre la clasificación y definición de LGMD en 2017. Con la nueva definición, varias enfermedades fueron eliminadas de la categoría LGMD:
| Nombre actual | Nombre antiguo | OMIM | Gene | Locus | Razón de la exclusión |
|---|---|---|---|---|---|
| Myofibrillar myopathy | LGMD1A | 159000 | TTID | Debilidad distal | |
| Emery–Dreifuss muscular dystrophy (EDMD) | LGMD1B | 159001 | LMNA | Fenotipo EDMD y implicación cardíaca significativa | |
| Rippling muscular disease | LGMD1C | 607801 | CAV3 | Principalmente caracterizado por la maduración muscular y el dolor | |
| Myofibrillar myopathy | LGMD1E | 601419 | DES | Debilidad distal y implicación cardíaca significativa | |
| No confirmado | LGMD1H | 613530 | 3p25.1–p23 | Aún no se establece como una enfermedad |
Investigación
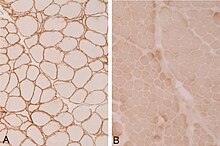
Existe una variedad de investigaciones en curso dirigidas a diversas formas de distrofia muscular de cinturas y extremidades. Entre los tratamientos que se cree que son prometedores se encuentra la terapia génica, que consiste en la introducción de material genético, a menudo una copia de un gen sano, en las células.
Según una revisión de Bengtsson et al. Algunos éxitos con las terapias génicas mediadas por AAV (para diferentes trastornos) han aumentado el interés de los investigadores, y CRISPR/Cas9 y la omisión de exones ayudan a lograr estos objetivos terapéuticos. Las distrofias musculares de cinturas y extremidades tienen muchos tipos diferentes que se deben a diferentes mutaciones genéticas. LGMD2D es causada por una mutación en el gen α-sarcoglicano. El tratamiento futuro podría realizarse mediante terapia génica mediante vectores adenoasociados recombinantes.
Según una revisión realizada por Straub y otros, hay varias cuestiones de investigación que deben abordarse: la rareza de la enfermedad, la escasa comprensión del mecanismo de LGMD R y la ausencia de cohortes de pacientes, todo lo cual contribuye a la falta de biomarcadores para LGMD. La revisión continúa afirmando que se han utilizado modelos animales para LGMD R para analizar medicamentos terapéuticos. Además, aunque se ha utilizado la prednisona y ha tenido efectos positivos en los individuos afectados por LGMD2, todavía no hay evidencia de su eficacia en ensayos controlados con placebo.
Contenido relacionado
Enfermedad de von Willebrand
Músculo flexor superficial de los dedos
Vena porta
