Disociación (química)
Disociación en química es un proceso general en el que las moléculas (o compuestos iónicos como sales o complejos) se separan o dividen en otras cosas como átomos, iones o radicales, generalmente de forma reversible. manera. Por ejemplo, cuando un ácido se disuelve en agua, un enlace covalente entre un átomo electronegativo y un átomo de hidrógeno se rompe mediante fisión heterolítica, lo que da un protón (H+) y un ion negativo. La disociación es lo opuesto a la asociación o la recombinación.
Constante de disociación
Para disociaciones reversibles en un equilibrio químico
- <math alttext="{displaystyle {ce {AB A + B}}}" xmlns="http://www.w3.org/1998/Math/MathML">AB↽ ↽ − − − − ⇀ ⇀ A+B{displaystyle {ce {} {cH00} {cH00}} {cH00}}}<img alt="{displaystyle {ce {AB A + B}}}" aria-hidden="true" class="mwe-math-fallback-image-inline mw-invert" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/ca781635db7d44d700981e14923abd056816ccce" style="vertical-align: -0.505ex; width:14.266ex; height:2.843ex;"/>
la constante de disociación Kd es la relación entre compuestos disociados y no disociados
- Kd=[A][B][AB]{displaystyle K_{d}=mathrm {frac {[A][B]}}
donde los corchetes indican las concentraciones de equilibrio de las especies.
Grado de disociación
El grado de disociación α α {displaystyle alpha } es la fracción de moléculas de soluto originales que han disociado. Generalmente se indica por el símbolo griego α. Más exactamente, el grado de disociación se refiere a la cantidad de soluto disociado en iones o radicales por topo. En caso de ácidos y bases muy fuertes, el grado de disociación estará cerca de 1. Los ácidos y bases menos poderosos tendrán menor grado de disociación. Hay una relación simple entre este parámetro y el factor van 't Hoff i{displaystyle i}. Si la sustancia del soluto se disocia en n{displaystyle n} iones, entonces
- i=1+α α ()n− − 1){displaystyle i=1+alpha (n-1)}
Por ejemplo, para la siguiente disociación
- <math alttext="{displaystyle {ce {KCl K+ + Cl-}}}" xmlns="http://www.w3.org/1998/Math/MathML">KCl↽ ↽ − − − − ⇀ ⇀ K++Cl− − {displaystyle {ce {cH00}}}<img alt="{displaystyle {ce {KCl K+ + Cl-}}}" aria-hidden="true" class="mwe-math-fallback-image-inline mw-invert" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/921f3fac39323b13d213f00e25d523f34244e032" style="vertical-align: -0.505ex; width:18.776ex; height:2.843ex;"/>
As n=2{displaystyle n=2}, tendríamos que i=1+α α {displaystyle i=1+alpha }.
Sales
La disociación de sales por solvatación en una solución, como el agua, significa la separación de aniones y cationes. La sal se puede recuperar mediante evaporación del disolvente.
Un electrolito se refiere a una sustancia que contiene iones libres y puede usarse como medio conductor de electricidad. La mayor parte del soluto no se disocia en un electrolito débil, mientras que en un electrolito fuerte una proporción mayor de soluto se disocia para formar iones libres.
Un electrolito débil es una sustancia cuyo soluto existe en solución principalmente en forma de moléculas (que se dice que están "no disociadas"), con sólo una pequeña fracción en forma de iones. El simple hecho de que una sustancia no se disuelva fácilmente no la convierte en un electrolito débil. Ácido acético (CH3COOH) y amonio (NH+4) son buenos ejemplos. El ácido acético es extremadamente soluble en agua, pero la mayor parte del compuesto se disuelve en moléculas, lo que lo convierte en un electrolito débil. Las bases débiles y los ácidos débiles son generalmente electrolitos débiles. En una solución acuosa habrá algo de CH3COOH y algo de CH3COO− y H+.
Un electrolito fuerte es un soluto que existe en solución completamente o casi completamente como iones. De nuevo, la fuerza de un electrolito se define como el porcentaje de soluto que es iones, en lugar de moléculas. Cuanto mayor sea el porcentaje, más fuerte será el electrolito. Así, incluso si una sustancia no es muy soluble, pero se disocia completamente en iones, la sustancia se define como un electrolito fuerte. La lógica similar se aplica a un electrolito débil. Los ácidos fuertes y las bases son buenos ejemplos, como HCl y H2Así que...4. Todos ellos existirán como iones en un medio acuoso.
Gases
El grado de disociación en los gases se indica con el símbolo α, donde α se refiere al porcentaje de moléculas de gas que se disocian. Varias relaciones entre Kp y α existen dependiendo de la estequiometría de la ecuación. El ejemplo del tetróxido de dinitrógeno (N2O4) que se disocia en dióxido de nitrógeno (NO2).
Si la concentración inicial de tetroxido dinitrógeno es 1 mole por litro, esto disminuirá por α en el equilibrio dando, por la estoquiometría, α topos de NO2. La constante del equilibrio (en términos de presión) es dada por la ecuación
donde p representa la presión parcial. Por lo tanto, a través de la definición de presión parcial y usando pT para representar la presión total y x para representar la fracción molar;
El número total de moles en equilibrio es (1 – α) + 2α, lo que equivale a 1 + α. Por lo tanto, sustituyendo las fracciones molares con valores reales en términos de α y simplificando;
Esta ecuación está de acuerdo con el principio de Le Chatelier. Kp permanecerá constante con la temperatura. La adición de presión al sistema aumentará el valor de pT, por lo que α debe disminuir para mantener Kp constante. De hecho, aumentar la presión del equilibrio favorece un desplazamiento hacia la izquierda favoreciendo la formación de tetróxido de dinitrógeno (ya que en este lado del equilibrio hay menos presión ya que la presión es proporcional al número de moles), disminuyendo así el grado de disociación α.
Ácidos en solución acuosa
La reacción de un ácido en un disolvente acuoso se describe a menudo como una disociación
- <math alttext="{displaystyle {ce {HA H+ + A-}}}" xmlns="http://www.w3.org/1998/Math/MathML">HA↽ ↽ − − − − ⇀ ⇀ H++A− − {displaystyle {ce {fnMicrosoft Sans Serif} H+ + A-}}<img alt="{displaystyle {ce {HA H+ + A-}}}" aria-hidden="true" class="mwe-math-fallback-image-inline mw-invert" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/f7495efc7639cfaaeed95f8c49fd6d6c7a34a55e" style="vertical-align: -0.505ex; width:17.482ex; height:2.843ex;"/>
donde HA es un ácido protónico como el ácido acético, CH3COOH. La doble flecha significa que se trata de un proceso de equilibrio, en el que la disociación y la recombinación ocurren al mismo tiempo. Esto implica que la constante de disociación ácida
- Ka=[H+][A− − ][HA]{displaystyle K_{ce {}} {fn}} {fnK}}} {fn0}}}}} {fn}}}} {fn}}} {fn}} {fn}}}} {fn}}} {fn}}}}}}}} {f}}}}}}}} {f}}}}} {f}}}}}}}}}}}
Sin embargo, la teoría ácido-base de Brønsted-Lowry proporciona una descripción más explícita, que especifica que el protón H+ no existe como tal en solución, sino que es aceptado por (unido a) una molécula de agua para formar el ion hidronio H3O+.
Por lo tanto, la reacción se puede escribir como
- <math alttext="{displaystyle {ce {HA + H2O H3O+ + A-}}}" xmlns="http://www.w3.org/1998/Math/MathML">HA+H2O↽ ↽ − − − − ⇀ ⇀ H3O++A− − {displaystyle {ce {HA + H2O = {}}}<img alt="{displaystyle {ce {HA + H2O H3O+ + A-}}}" aria-hidden="true" class="mwe-math-fallback-image-inline mw-invert" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/93058825f1589984306033f18d1cbfe9c8721f2b" style="vertical-align: -1.005ex; width:27.791ex; height:3.343ex;"/>
y mejor descrito como una ionización o formación de iones (para el caso en que el HA no tiene carga neta). La constante de equilibrio es entonces
- Ka=[H3O+][A− − ][HA]{displaystyle K_{ce [A]={ce {fnMicroc {cH_{3}O^{+} ¿Qué?
Donde [H2O]{displaystyle {ce {}}}} no se incluye porque en solución diluida el solvente es esencialmente un líquido puro con una actividad termodinámica de uno.
Ka recibe varios nombres: constante de disociación, constante de ionización ácida, constante de acidez o constante de ionización. Sirve como indicador de la fuerza del ácido: los ácidos más fuertes tienen un valor Ka más alto (y un pKa valor).
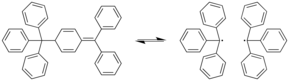
Fragmentación
La fragmentación de una molécula puede tener lugar mediante un proceso de heterólisis u homólisis.
Receptores
Los receptores son proteínas que se unen a pequeños ligandos. La constante de disociación Kd se utiliza como indicador de la afinidad del ligando por el receptor. Cuanto mayor sea la afinidad del ligando por el receptor, menor será el valor de Kd (y mayor será el valor de pKd valor).

![{displaystyle K_{d}=mathrm {frac {[A][B]}{[AB]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f2858088b9c087e2c80db047a8f4c1939242460b)









![{displaystyle K_{ce {a}}={ce {frac {[H^{+}][A^{-}]}{[HA]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2336c8a3765ce089428093d9cdc295e264635dee)
![{displaystyle K_{ce {a}}={ce {frac {[H_{3}O^{+}][A^{-}]}{[HA]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/118a77c4dd2a3573219844c4435c9a442315e5a0)
![{displaystyle {ce {[H_2O]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f5fa7eafbdbd79211efe80b9ff1d841656328040)