Dioxido de cloro
dióxido de cloro es un compuesto químico con la fórmula ClO2 que existe como un gas de color verde amarillento por encima de los 11 °C, un líquido de color marrón rojizo entre los 11 °C y -59 °C, y como cristales de color naranja brillante por debajo de -59 °C. Generalmente se maneja como una solución acuosa. Se utiliza comúnmente como blanqueador. Desarrollos más recientes han ampliado sus aplicaciones en el procesamiento de alimentos y como desinfectante.
Estructura y unión
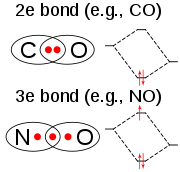


La molécula ClO2 tiene un número impar de electrones de valencia y, por tanto, es un radical paramagnético. Es un "ejemplo inusual de una molécula de electrones impares que es estable hacia la dimerización" (el óxido nítrico es otro ejemplo).
En 1933, Lawrence O. Brockway, un estudiante graduado de Linus Pauling, propuso una estructura que involucraba un enlace de tres electrones y dos enlaces simples. Sin embargo, Pauling en su Química General muestra un doble enlace con un oxígeno y un enlace sencillo más un enlace de tres electrones con el otro. La estructura del enlace de valencia se representaría como el híbrido de resonancia descrito por Pauling. El enlace de tres electrones representa un enlace que es más débil que el doble enlace. En la teoría de los orbitales moleculares, esta idea es común si el tercer electrón se coloca en un orbital antienlazante. Trabajos posteriores han confirmado que el orbital molecular ocupado más alto es de hecho un orbital antienlazante incompletamente lleno.

La estructura cristalina del ClO2 es ortorrómbica y muestra la simetría del grupo espacial Pbca.
Preparación
El dióxido de cloro fue preparado por primera vez en 1811 por Sir Humphry Davy.
El dióxido de cloro es un compuesto que puede descomponerse violentamente cuando se separa de sustancias diluyentes. Como resultado, a menudo se prefieren los métodos de preparación que implican producir soluciones del mismo sin pasar por una etapa de fase gaseosa.
Oxidación del clorito
En el laboratorio, el ClO2 se puede preparar mediante oxidación de clorito de sodio con cloro:
Tradicionalmente, el dióxido de cloro para aplicaciones de desinfección se ha elaborado a partir de clorito de sodio o mediante el método de clorito e hipoclorito de sodio:
o el método de clorito de sodio y ácido clorhídrico:
o el método clorito-ácido sulfúrico:
Los tres métodos pueden producir dióxido de cloro con un alto rendimiento de conversión de clorito. A diferencia de los otros procesos, el método de clorito y ácido sulfúrico no contiene cloro, aunque requiere un 25% más de clorito para producir una cantidad equivalente de dióxido de cloro. Alternativamente, el peróxido de hidrógeno puede usarse eficientemente en aplicaciones a pequeña escala.
La adición de ácido sulfúrico o cualquier ácido fuerte a las sales de clorato produce dióxido de cloro.
Reducción de clorato
En el laboratorio, el dióxido de cloro también se puede preparar mediante la reacción de clorato de potasio con ácido oxálico:
o con ácido oxálico y sulfúrico:
Más del 95% del dióxido de cloro producido hoy en el mundo se obtiene mediante la reducción del clorato de sodio, para su uso en el blanqueo de pulpa. Se produce con alta eficacia en una solución ácida fuerte con un agente reductor adecuado como metanol, peróxido de hidrógeno, ácido clorhídrico o dióxido de azufre. Las tecnologías modernas se basan en metanol o peróxido de hidrógeno, ya que estas sustancias químicas permiten la mejor economía y no coproducen cloro elemental. La reacción general se puede escribir como:
Como ejemplo típico, se cree que la reacción del clorato de sodio con ácido clorhídrico en un solo reactor se produce a través de la siguiente ruta:
que da la reacción general
La ruta de producción comercialmente más importante utiliza metanol como agente reductor y ácido sulfúrico para la acidez. Dos ventajas de no utilizar procesos basados en cloruro son que no se forma cloro elemental y que el sulfato de sodio, un químico valioso para la fábrica de pulpa, es un subproducto. Estos procesos basados en metanol proporcionan una alta eficiencia y pueden ser muy seguros.
La variante del proceso que utiliza clorato de sodio, peróxido de hidrógeno y ácido sulfúrico se ha utilizado cada vez más desde 1999 para el tratamiento de agua y otras aplicaciones de desinfección a pequeña escala, ya que produce un producto sin cloro con una alta eficiencia, superior al 95 %.
Otros procesos
También se puede producir dióxido de cloro muy puro mediante electrólisis de una solución de clorito:
Se puede producir dióxido de cloro gaseoso de alta pureza (7,7% en aire o nitrógeno) mediante el método gas-sólido, que hace reaccionar cloro gaseoso diluido con clorito de sodio sólido:
Propiedades de manejo
A presiones parciales superiores a 10 kPa (1,5 psi) (o concentraciones en fase gaseosa superiores al 10 % del volumen en aire a temperatura ambiente), el ClO2 puede descomponerse explosivamente en cloro y oxígeno. La descomposición puede iniciarse por luz, puntos calientes, reacciones químicas o golpes de presión. Por lo tanto, el dióxido de cloro nunca se maneja como gas puro, sino que casi siempre se maneja en una solución acuosa en concentraciones entre 0,5 y 10 gramos por litro. Su solubilidad aumenta a temperaturas más bajas, por lo que es común utilizar agua fría (5 °C, 41 °F) cuando se almacena en concentraciones superiores a 3 gramos por litro. En muchos países, como Estados Unidos, el dióxido de cloro no puede transportarse en ninguna concentración y, en cambio, casi siempre se produce in situ. En algunos países, las soluciones de dióxido de cloro con una concentración inferior a 3 gramos por litro pueden transportarse por tierra, pero son relativamente inestables y se deterioran rápidamente.
Usos
El dióxido de cloro se utiliza para el blanqueo de pulpa de madera y para la desinfección (llamada cloración) del agua potable municipal, el tratamiento de agua en aplicaciones de petróleo y gas, la desinfección en la industria alimentaria, el control microbiológico en torres de enfriamiento y el blanqueo de textiles. Como desinfectante, es eficaz incluso en bajas concentraciones debido a sus cualidades únicas.
Blanqueamiento
A veces se utiliza dióxido de cloro para blanquear pulpa de madera en combinación con cloro, pero se utiliza solo en secuencias de blanqueo ECF (sin cloro elemental). Se utiliza a pH moderadamente ácido (3,5 a 6). El uso de dióxido de cloro minimiza la cantidad de compuestos organoclorados producidos. El dióxido de cloro (tecnología ECF) es actualmente el método de blanqueo más importante a nivel mundial. Aproximadamente el 95% de toda la pulpa kraft blanqueada se elabora utilizando dióxido de cloro en secuencias de blanqueo ECF.
Se ha utilizado dióxido de cloro para blanquear la harina.
Tratamiento de agua
La planta de tratamiento de agua de las Cataratas del Niágara, Nueva York, utilizó por primera vez dióxido de cloro para el tratamiento del agua potable en 1944 para destruir los "compuestos fenólicos que producen sabor y olor". El dióxido de cloro se introdujo como desinfectante del agua potable a gran escala en 1956, cuando Bruselas, Bélgica, cambió el cloro por el dióxido de cloro. Su uso más común en el tratamiento del agua es como preoxidante antes de la cloración del agua potable para destruir las impurezas naturales del agua que, de otro modo, producirían trihalometanos al exponerse al cloro libre. Los trihalometanos son subproductos de desinfección sospechosos de ser cancerígenos asociados con la cloración de sustancias orgánicas naturales en el agua cruda. El dióxido de cloro también produce un 70% menos de halometanos en presencia de materia orgánica natural en comparación con cuando se utiliza cloro elemental o lejía.
El dióxido de cloro también es superior al cloro cuando se opera por encima de pH 7, en presencia de amoníaco y aminas, y para el control de biopelículas en sistemas de distribución de agua. El dióxido de cloro se utiliza en muchas aplicaciones de tratamiento de agua industrial como biocida, incluidas torres de enfriamiento, agua de proceso y procesamiento de alimentos.
El dióxido de cloro es menos corrosivo que el cloro y superior para el control de la bacteria Legionella. El dióxido de cloro es superior a otros métodos secundarios de desinfección del agua, ya que el dióxido de cloro no se ve afectado negativamente por el pH, no pierde eficacia con el tiempo (porque las bacterias no se volverán resistentes a él) y no se ve afectado negativamente por la sílice y los fosfatos., que son inhibidores de corrosión del agua potable comúnmente utilizados. En Estados Unidos, es un biocida registrado por la EPA.
Es más eficaz como desinfectante que el cloro en la mayoría de las circunstancias contra agentes patógenos transmitidos por el agua, como virus, bacterias y protozoos, incluidos los quistes de Giardia y los ooquistes de Cryptosporidium. yo>.
El uso de dióxido de cloro en el tratamiento del agua conduce a la formación del subproducto clorito, que actualmente está limitado a un máximo de 1 parte por millón en el agua potable en los EE. UU. Esta norma de la EPA limita el uso de dióxido de cloro en los EE. UU. a agua de calidad relativamente alta, porque esto minimiza la concentración de clorito, o al agua que va a ser tratada con coagulantes a base de hierro, porque el hierro puede reducir el clorito a cloruro. La Organización Mundial de la Salud también aconseja una dosificación de 1 ppm.
Uso en crisis públicas
El dióxido de cloro tiene muchas aplicaciones como oxidante o desinfectante. El dióxido de cloro se puede utilizar para desinfectar el aire y fue el principal agente utilizado en la descontaminación de edificios en los Estados Unidos después de los ataques con ántrax de 2001. Después del desastre del huracán Katrina en Nueva Orleans, Luisiana y la costa circundante del Golfo, se utilizó dióxido de cloro para erradicar el peligroso moho de las casas inundadas por las inundaciones.
Al abordar la pandemia de COVID-19, la Agencia de Protección Ambiental de EE. UU. ha publicado una lista de muchos desinfectantes que cumplen con sus criterios para su uso en medidas ambientales contra el coronavirus causante. Algunos se basan en clorito de sodio que se activa para formar dióxido de cloro, aunque en cada producto se utilizan diferentes formulaciones. Muchos otros productos en la lista de la EPA contienen hipoclorito de sodio, que tiene un nombre similar pero no debe confundirse con el clorito de sodio porque tienen modos de acción química muy diferentes.
Otros usos de la desinfección
Did you mean:Chlorine dioxide may be used as a fumigant treatment to "sanitizer#34; fruits such as blueberries, raspberries, and strawberries that develop molds and yeast.
Se puede utilizar dióxido de cloro para desinfectar las aves de corral rociándolas o sumergiéndolas después del sacrificio.
El dióxido de cloro se puede utilizar para la desinfección de endoscopios, como por ejemplo con el nombre comercial Tristel. También está disponible en un trío que consta de una limpieza previa con tensioactivo y un enjuague posterior con agua desionizada y un antioxidante de bajo nivel.
Se puede utilizar dióxido de cloro para controlar los mejillones cebra y quagga en las tomas de agua.
Did you mean:Chlorine dioxide was shown to be effective in bed bug eradication.
Para la purificación del agua durante el campamento, las tabletas desinfectantes que contienen dióxido de cloro son más efectivas contra los patógenos que las que usan lejía doméstica, pero generalmente cuestan más.
Otros usos
El dióxido de cloro se utiliza como oxidante para destruir fenoles en corrientes de aguas residuales y para controlar los olores en los depuradores de aire de plantas de subproductos animales (procesamiento). También está disponible para su uso como desodorante para automóviles y embarcaciones, en paquetes que generan dióxido de cloro y que se activan con agua y se dejan en la embarcación o automóvil durante la noche.
Problemas de seguridad en el agua y los suplementos
Los peligros potenciales con el dióxido de cloro incluyen envenenamiento y el riesgo de ignición espontánea o explosión al contacto con materiales inflamables.
El dióxido de cloro es tóxico y se requieren límites de exposición humana para garantizar su uso seguro. La Agencia de Protección Ambiental de Estados Unidos ha establecido un nivel máximo de 0,8 mg/L para dióxido de cloro en el agua potable. La Administración de Salud y Seguridad Ocupacional (OSHA), una agencia del Departamento de Trabajo de los Estados Unidos, ha establecido un límite de exposición permisible durante 8 horas de 0,1 ppm en el aire (0,3 mg/m3) para las personas que trabajan con dióxido de cloro.
El dióxido de cloro se ha comercializado de manera fraudulenta e ilegal como una cura ingerible para una amplia gama de enfermedades, incluido el autismo infantil y el coronavirus. Los niños a los que se les han administrado enemas de dióxido de cloro como supuesta cura para el autismo infantil han sufrido dolencias que ponen en peligro sus vidas. La Administración de Alimentos y Medicamentos de EE. UU. (FDA) ha declarado que la ingestión u otro uso interno de dióxido de cloro, fuera del enjuague bucal supervisado usando concentraciones diluidas, no tiene beneficios para la salud de ningún tipo y no debe usarse internamente por ningún motivo.
Pseudomedicina
El 30 de julio y el 1 de octubre de 2010, la Administración de Alimentos y Medicamentos de los Estados Unidos advirtió contra el uso del producto "Suplemento Mineral Milagroso", o "MMS", que cuando se prepara de acuerdo con según las instrucciones produce dióxido de cloro. MMS se ha comercializado como tratamiento para una variedad de afecciones, incluido el VIH, el cáncer, el autismo, el acné y, más recientemente, el COVID-19. Muchos se han quejado ante la FDA, informando reacciones potencialmente mortales e incluso la muerte. La FDA advirtió a los consumidores que el MMS puede causar daños graves a la salud y afirmó que ha recibido numerosos informes de náuseas, diarrea, vómitos intensos y presión arterial baja potencialmente mortal causada por la deshidratación. Esta advertencia se repitió por tercera vez el 12 de agosto de 2019 y por cuarta el 8 de abril de 2020, afirmando que ingerir MMS es tan peligroso como ingerir lejía e instando a los consumidores a no usarlos ni darles estos productos a sus hijos por ningún motivo., ya que no hay evidencia científica que demuestre que el dióxido de cloro tenga propiedades médicas beneficiosas.