Spiegeleisen
Spiegeleisen es una aleación de ferromanganeso que contiene aproximadamente un 15 % de manganeso y pequeñas cantidades de carbono y silicio. Spiegeleisen a... (leer más)
Dióxido de azufre (ortografía recomendada por la IUPAC) o dióxido de azufre (inglés tradicional de la Commonwealth) es el compuesto químico con la fórmula SO
2. Es un gas tóxico responsable del olor de los fósforos quemados. Se libera naturalmente por la actividad volcánica y se produce como subproducto de la extracción de cobre y la quema de combustibles fósiles que contienen azufre.
SO2 es una molécula doblada con un grupo puntual de simetría C2v. Un enfoque de la teoría del enlace de valencia considerando solo los orbitales s y p describiría el enlace en términos de resonancia entre dos estructuras de resonancia.
El enlace azufre-oxígeno tiene un orden de enlace de 1,5. Existe apoyo para este enfoque simple que no invoca la participación orbital d. En términos de formalismo de conteo de electrones, el átomo de azufre tiene un estado de oxidación de +4 y una carga formal de +1.
El dióxido de azufre se encuentra en la Tierra y existe en concentraciones muy pequeñas y en la atmósfera a aproximadamente 1 ppm.
En otros planetas, el dióxido de azufre se puede encontrar en varias concentraciones, siendo la más importante la atmósfera de Venus, donde es el tercer gas atmosférico más abundante con 150 ppm. Allí, reacciona con el agua para formar nubes de ácido sulfúrico, y es un componente clave del ciclo de azufre atmosférico global del planeta y contribuye al calentamiento global. Ha sido implicado como un agente clave en el calentamiento de Marte primitivo, con estimaciones de concentraciones en la atmósfera inferior de hasta 100 ppm, aunque solo existe en pequeñas cantidades. Tanto en Venus como en Marte, como en la Tierra, se cree que su fuente principal es volcánica. La atmósfera de Io, un satélite natural de Júpiter, tiene un 90% de dióxido de azufre y se cree que también existen trazas en la atmósfera de Júpiter. El Telescopio Espacial James Webb ha observado la presencia de dióxido de azufre en el exoplaneta WASP 39-b, donde se forma a través de la fotoquímica en la atmósfera del planeta.
Como hielo, se cree que existe en abundancia en las lunas galileanas, como hielo sublimado o escarcha en el hemisferio posterior de Io, y en la corteza y el manto de Europa, Ganímedes y Calisto, posiblemente también en forma líquida. y reacciona fácilmente con el agua.
El dióxido de azufre se produce principalmente para la fabricación de ácido sulfúrico (consulte el proceso de contacto). En los Estados Unidos, en 1979, se utilizaron de esta forma 23,6 millones de toneladas métricas (26 millones de toneladas cortas estadounidenses) de dióxido de azufre, en comparación con 150 000 toneladas métricas (165 347 toneladas cortas estadounidenses) utilizadas para otros fines. La mayor parte del dióxido de azufre se produce por la combustión de azufre elemental. También se produce algo de dióxido de azufre al tostar pirita y otros minerales de sulfuro en el aire.
El dióxido de azufre es el producto de la quema de azufre o de la quema de materiales que contienen azufre:
Para ayudar a la combustión, se rocía azufre licuado (140-150 °C, 284-302 °F) a través de una boquilla atomizadora para generar finas gotas de azufre con una gran superficie. La reacción es exotérmica y la combustión produce temperaturas de 1000 a 1600 °C (1832 a 2912 °F). La cantidad significativa de calor producido se recupera mediante la generación de vapor que posteriormente se puede convertir en electricidad.
La combustión de sulfuro de hidrógeno y compuestos organosulfurados procede de manera similar. Por ejemplo:
La tostación de minerales sulfurados como la pirita, la esfalerita y el cinabrio (sulfuro de mercurio) también libera SO2:
Una combinación de estas reacciones es responsable de la mayor fuente de dióxido de azufre, las erupciones volcánicas. Estos eventos pueden liberar millones de toneladas de SO2.
El dióxido de azufre también puede ser un subproducto en la fabricación de cemento de silicato de calcio; CaSO4 se calienta con coque y arena en este proceso:
Hasta la década de 1970, este proceso producía cantidades comerciales de ácido sulfúrico y cemento en Whitehaven, Inglaterra. Al mezclarse con esquisto o marga y tostarse, el sulfato libera gas de dióxido de azufre, utilizado en la producción de ácido sulfúrico, la reacción también produce silicato de calcio, un precursor en la producción de cemento.
A escala de laboratorio, la acción del ácido sulfúrico concentrado caliente sobre virutas de cobre produce dióxido de azufre.
La reacción inversa ocurre con la acidificación:
Los sulfitos resultan por la acción de la base acuosa sobre el anhídrido sulfuroso:
El dióxido de azufre es un agente reductor suave pero útil. Es oxidado por halógenos para dar los haluros de sulfurilo, como el cloruro de sulfurilo:
El dióxido de azufre es el agente oxidante del proceso Claus, que se realiza a gran escala en las refinerías de petróleo. Aquí, el dióxido de azufre se reduce con sulfuro de hidrógeno para dar azufre elemental:
La oxidación secuencial del dióxido de azufre seguida de su hidratación se utiliza en la producción de ácido sulfúrico.
El dióxido de azufre es uno de los pocos gases ácidos comunes pero reductores. Se vuelve rosa tornasol húmedo (siendo ácido), luego blanco (debido a su efecto blanqueador). Puede identificarse burbujeando a través de una solución de dicromato, cambiando la solución de naranja a verde (Cr3+ (aq)). También puede reducir los iones férricos a ferrosos.
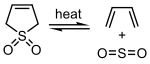
El dióxido de azufre puede reaccionar con ciertos 1,3-dienos en una reacción queletrópica para formar sulfonas cíclicas. Esta reacción se explota a escala industrial para la síntesis de sulfolano, que es un disolvente importante en la industria petroquímica.
El dióxido de azufre se puede unir a los iones metálicos como ligando para formar complejos de dióxido de azufre metálico, normalmente cuando el metal de transición se encuentra en el estado de oxidación 0 o +1. Se reconocen muchos modos de enlace (geometrías) diferentes, pero en la mayoría de los casos, el ligando es monodentado, unido al metal a través de azufre, que puede ser plano o piramidal η1. Como ligando η1-SO2 (S-bond planar), el dióxido de azufre funciona como una base de Lewis usando el par solitario en S. SO2 funciona como un ácido de Lewis en su modo de enlace η1-SO2 (piramidal unido a S) con metales y en sus aductos 1:1 con bases de Lewis como la dimetilacetamida y trimetilamina. Cuando se une a bases de Lewis, los parámetros ácidos de SO2 son EA = 0,51 y EA = 1,56.
El uso general y dominante del dióxido de azufre es la producción de ácido sulfúrico.
El dióxido de azufre es un intermediario en la producción de ácido sulfúrico, se convierte en trióxido de azufre y luego en oleum, que se convierte en ácido sulfúrico. El dióxido de azufre para este propósito se produce cuando el azufre se combina con el oxígeno. El método de convertir el dióxido de azufre en ácido sulfúrico se denomina proceso de contacto. Varios miles de millones de kilogramos se producen anualmente para este propósito.
El dióxido de azufre se usa a veces como conservante para albaricoques secos, higos secos y otras frutas secas, debido a sus propiedades antimicrobianas y su capacidad para prevenir la oxidación, y se denomina E220 cuando se usa de esta manera en Europa. Como conservante, mantiene el aspecto colorido de la fruta y evita que se pudra. También se añade a la melaza sulfurada. El sulfito sublimado se enciende y se quema en un espacio cerrado con los frutos. Esto generalmente se hace al aire libre. Las frutas se pueden sulfurar sumergiéndolas en bisulfito de sodio, sulfito de sodio o metabisulfito de sodio.
Los romanos utilizaron por primera vez el dióxido de azufre en la elaboración del vino, cuando descubrieron que quemar velas de azufre dentro de recipientes de vino vacíos los mantiene frescos y sin olor a vinagre.
Sigue siendo un compuesto importante en la elaboración del vino y se mide en partes por millón (ppm) en el vino. Está presente incluso en los llamados vinos no sulfurados en concentraciones de hasta 10 mg/L. Sirve como antibiótico y antioxidante, protegiendo el vino del deterioro por bacterias y oxidación, un fenómeno que conduce al oscurecimiento del vino y a la pérdida de sabores específicos de la variedad. Su acción antimicrobiana también ayuda a minimizar la acidez volátil. Los vinos que contienen dióxido de azufre suelen estar etiquetados con "que contienen sulfitos".
El dióxido de azufre existe en el vino en forma libre y ligada, y las combinaciones se denominan SO2 total. La unión, por ejemplo, al grupo carbonilo del acetaldehído, varía según el vino en cuestión. La forma libre existe en equilibrio entre el SO2 molecular (como un gas disuelto) y el ion bisulfito, que a su vez está en equilibrio con el ion sulfito. Estos equilibrios dependen del pH del vino. Un pH más bajo cambia el equilibrio hacia el SO2 molecular (gaseoso), que es la forma activa, mientras que a un pH más alto se encuentra más SO2 en las formas inactivas de sulfito y bisulfito. El SO2 molecular es activo como antimicrobiano y antioxidante, y esta es también la forma que puede percibirse como un olor acre en niveles altos. Los vinos con concentraciones de SO2 totales inferiores a 10 ppm no requieren "contiene sulfitos" en la etiqueta por las leyes de EE. UU. y la UE. El límite superior de SO2 total permitido en el vino en los EE. UU. es de 350 ppm; en la UE es de 160 ppm para vinos tintos y de 210 ppm para vinos blancos y rosados. En bajas concentraciones, el SO2 es casi indetectable en el vino, pero en concentraciones de SO2 libres superiores a 50 ppm, el SO2 se vuelve evidente en el olor. y sabor a vino.
SO2 es también un compuesto muy importante en el saneamiento de bodegas. Las bodegas y el equipo deben mantenerse limpios, y debido a que no se puede usar lejía en una bodega debido al riesgo de contaminación por corcho, se usa comúnmente una mezcla de SO2, agua y ácido cítrico para limpiar y desinfectar. equipo. El ozono (O3) ahora se usa mucho para desinfectar bodegas debido a su eficacia y porque no afecta al vino ni a la mayoría de los equipos.
El dióxido de azufre también es un buen reductor. En presencia de agua, el dióxido de azufre es capaz de decolorar las sustancias. En concreto, es un blanqueador reductor útil para papeles y materiales delicados como la ropa. Este efecto blanqueador normalmente no dura mucho tiempo. El oxígeno en la atmósfera reoxida los tintes reducidos, restaurando el color. En el tratamiento de aguas residuales municipales, el dióxido de azufre se usa para tratar las aguas residuales cloradas antes de su liberación. El dióxido de azufre reduce el cloro libre y combinado a cloruro.
El dióxido de azufre es bastante soluble en agua, tanto por espectroscopia IR como Raman; el ácido sulfuroso hipotético, H2SO3, no está presente en ninguna medida. Sin embargo, tales soluciones muestran espectros del ion de sulfito de hidrógeno, HSO3−, por reacción con agua, y de hecho es el agente reductor real presente:
A principios del siglo XX, el dióxido de azufre se usaba en Buenos Aires como fumigante para matar ratas que portaban la bacteria Yersinia pestis, que causa la peste bubónica. La aplicación fue exitosa y la aplicación de este método se extendió a otras áreas de América del Sur. En Buenos Aires, donde estos aparatos eran conocidos como Sulfurozador, pero luego también en Río de Janeiro, Nueva Orleans y San Francisco, las máquinas de tratamiento de anhídrido sulfuroso fueron sacadas a la calle para permitir extensas campañas de desinfección, con resultados efectivos.
El dióxido de azufre o su base conjugada bisulfito se produce biológicamente como un intermediario tanto en los organismos reductores de sulfato como en las bacterias que oxidan el azufre. El papel del dióxido de azufre en la biología de los mamíferos aún no se comprende bien. El dióxido de azufre bloquea las señales nerviosas de los receptores de estiramiento pulmonares y suprime el reflejo de inflación de Hering-Breuer.
Se considera que el dióxido de azufre endógeno juega un papel fisiológico significativo en la regulación de la función cardiaca y de los vasos sanguíneos, y el metabolismo aberrante o deficiente del dióxido de azufre puede contribuir a varias enfermedades cardiovasculares diferentes, como hipertensión arterial, aterosclerosis, hipertensión arterial pulmonar y estenocardia
Se demostró que en niños con hipertensión arterial pulmonar debida a cardiopatías congénitas el nivel de homocisteína es mayor y el nivel de dióxido de azufre endógeno es menor que en niños control normales. Además, estos parámetros bioquímicos se correlacionaron fuertemente con la gravedad de la hipertensión arterial pulmonar. Los autores consideraron que la homocisteína es uno de los marcadores bioquímicos útiles de la gravedad de la enfermedad y que el metabolismo del dióxido de azufre es uno de los objetivos terapéuticos potenciales en esos pacientes.
También se ha demostrado que el dióxido de azufre endógeno reduce la tasa de proliferación de las células del músculo liso endotelial en los vasos sanguíneos, al reducir la actividad de MAPK y activar la adenilil ciclasa y la proteína quinasa A. La proliferación de las células del músculo liso es uno de los mecanismos importantes de la remodelación hipertensiva. de los vasos sanguíneos y su estenosis, por lo que es un importante mecanismo patogénico en la hipertensión arterial y la aterosclerosis.
El dióxido de azufre endógeno en bajas concentraciones provoca vasodilatación dependiente del endotelio. En concentraciones más altas, provoca una vasodilatación independiente del endotelio y tiene un efecto inotrópico negativo sobre la función del gasto cardíaco, lo que reduce de manera efectiva la presión arterial y el consumo de oxígeno del miocardio. Los efectos vasodilatadores y broncodilatadores del dióxido de azufre están mediados por canales de calcio dependientes de ATP y canales de calcio de tipo L (dihidropiridina). El dióxido de azufre endógeno también es un potente agente antiinflamatorio, antioxidante y citoprotector. Disminuye la presión arterial y retarda la remodelación hipertensiva de los vasos sanguíneos, especialmente el engrosamiento de su íntima. También regula el metabolismo de los lípidos.
El dióxido de azufre endógeno también disminuye el daño miocárdico, causado por la hiperestimulación adrenérgica del isoproterenol, y fortalece la reserva de defensa antioxidante del miocardio.
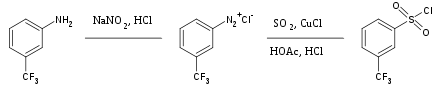
El dióxido de azufre es un solvente inerte versátil ampliamente utilizado para disolver sales altamente oxidantes. También se usa ocasionalmente como fuente del grupo sulfonilo en síntesis orgánica. El tratamiento de sales de aril diazonio con dióxido de azufre y cloruro cuproso produce el correspondiente cloruro de aril sulfonilo, por ejemplo:
Como resultado de su basicidad de Lewis muy baja, a menudo se usa como solvente/diluyente a baja temperatura para superácidos como el ácido mágico (FSO3H/SbF5), lo que permite observar espectroscópicamente especies altamente reactivas como el catión terc-butilo a baja temperatura (aunque los carbocationes terciarios reaccionan con SO2 por encima de unos –30 °C, e incluso se deben usar solventes menos reactivos como SO2ClF a estas temperaturas más altas).
Al ser fácilmente condensado y poseer un alto calor de evaporación, el dióxido de azufre es un material candidato para refrigerantes. Antes del desarrollo de los clorofluorocarbonos, el dióxido de azufre se usaba como refrigerante en los refrigeradores domésticos.
La ingeniería climática ha propuesto inyecciones de dióxido de azufre en la estratosfera. El efecto de enfriamiento sería similar al observado después de la gran erupción explosiva del Monte Pinatubo en 1991. Sin embargo, esta forma de geoingeniería tendría consecuencias regionales inciertas en los patrones de lluvia, por ejemplo, en las regiones monzónicas.

El dióxido de azufre es un componente notable en la atmósfera, especialmente después de las erupciones volcánicas. Según la Agencia de Protección Ambiental de los Estados Unidos (EPA), la cantidad de dióxido de azufre liberado en los EE. UU. por año fue:
| Año | SO2 |
|---|---|
| 1970 | 31.161.000 toneladas cortas (28,3 toneladas) |
| 1980 | 25,905.000 toneladas cortas (23,5 toneladas) |
| 1990 | 23,678.000 toneladas cortas (21,5 toneladas) |
| 1996 | 18.859.000 toneladas cortas (17.1 Mt) |
| 1997 | 19,363.000 toneladas cortas (17,6 toneladas) |
| 1998 | 19.491.000 toneladas cortas (17,7 Mt) |
| 1999 | 18,867.000 toneladas cortas (17,1 Mt) |
El dióxido de azufre es un importante contaminante del aire y tiene un impacto significativo en la salud humana. Además, la concentración de dióxido de azufre en la atmósfera puede influir en la idoneidad del hábitat para las comunidades vegetales, así como para la vida animal. Las emisiones de dióxido de azufre son un precursor de la lluvia ácida y las partículas atmosféricas. Debido en gran parte al Programa de Lluvia Ácida de la EPA de los EE. UU., los EE. UU. han tenido una reducción del 33 % en las emisiones entre 1983 y 2002. Esta mejora se debió en parte a la desulfuración de los gases de combustión, una tecnología que permite que el SO2 para unirse químicamente en centrales eléctricas que queman carbón o petróleo que contiene azufre. En particular, el óxido de calcio (cal) reacciona con el dióxido de azufre para formar sulfito de calcio:
La oxidación aeróbica del CaSO3 da CaSO4, anhidrita. La mayor parte del yeso vendido en Europa proviene de la desulfuración de gases de combustión.
Para controlar las emisiones de azufre, se han desarrollado docenas de métodos con eficiencias relativamente altas para la instalación de centrales eléctricas de carbón.
El azufre se puede eliminar del carbón durante la combustión mediante el uso de piedra caliza como material de lecho en la combustión de lecho fluidizado.
El azufre también se puede eliminar de los combustibles antes de quemarlos, evitando la formación de SO2 cuando se quema el combustible. El proceso Claus se utiliza en refinerías para producir azufre como subproducto. El proceso Stretford también se ha utilizado para eliminar el azufre del combustible. También se pueden utilizar procesos redox que utilizan óxidos de hierro, por ejemplo, Lo-Cat o Sulferox.
Un análisis encontró que 18 centrales eléctricas de carbón en los Balcanes occidentales emitieron dos veces y media más dióxido de azufre que las 221 centrales de carbón en la UE juntas.
Los aditivos de combustible, como los aditivos de calcio y el carboxilato de magnesio, pueden usarse en motores marinos para reducir la emisión de gases de dióxido de azufre a la atmósfera.
En 2006, China era el mayor contaminador de dióxido de azufre del mundo, con emisiones estimadas en 2005 de 25 490 000 toneladas cortas (23,1 Mt). Esta cantidad representa un aumento del 27 % desde 2000 y es aproximadamente comparable con las emisiones de EE. UU. en 1980.
La exposición incidental al dióxido de azufre es rutinaria, p. el humo de los fósforos, el carbón y los combustibles que contienen azufre.
El dióxido de azufre es levemente tóxico y puede ser peligroso en altas concentraciones. La exposición a largo plazo a bajas concentraciones también es problemática. Una revisión sistemática de 2011 concluyó que la exposición al dióxido de azufre está asociada con el parto prematuro.
En 2008, la Conferencia Estadounidense de Higienistas Industriales Gubernamentales redujo el límite de exposición a corto plazo a 0,25 partes por millón (ppm). En EE. UU., la OSHA fijó el PEL en 5 ppm (13 mg/m3) como promedio ponderado en el tiempo. También en los EE. UU., NIOSH fijó el IDLH en 100 ppm. En 2010, la EPA "revisó el SO2 NAAQS primario al establecer un nuevo estándar de una hora a un nivel de 75 partes por billón (ppb). La EPA revocó los dos estándares primarios existentes porque no brindarían protección adicional para la salud pública dado un estándar de una hora a 75 ppb."
En los Estados Unidos, el Centro para la Ciencia en el Interés Público enumera los dos conservantes de alimentos, el dióxido de azufre y el bisulfito de sodio, como seguros para el consumo humano, excepto para ciertas personas asmáticas que pueden ser sensibles a ellos, especialmente en grandes cantidades.. Los síntomas de sensibilidad a los agentes sulfitadores, incluido el dióxido de azufre, se manifiestan como problemas respiratorios potencialmente mortales a los pocos minutos de la ingestión. Los sulfitos también pueden causar síntomas en personas no asmáticas, a saber, dermatitis, urticaria, sofocos, hipotensión, dolor abdominal y diarrea, e incluso anafilaxia potencialmente mortal.
Tabla de propiedades térmicas y físicas del dióxido de azufre líquido saturado:
| Temperatura (°C) | Densidad (kg/m^3) | Calor específico (kJ/kg K) | Viscosidad cinemática (m^2/s) | Conductividad (W/m K) | Difusividad térmica (m^2/s) | Número de Prandtl | Módulo a granel (K^-1) |
| -50 | 1560.84 | 1.3595 | 4.84E-07 | 0.242 | 1.14E-07 | 4.24 | - |
| -40 | 1536.81 | 1.3607 | 4.24E-07 | 0,235 | 1.13E-07 | 3.74 | - |
| -30 | 1520.64 | 1.3616 | 3.71E-07 | 0.23 | 1.12E-07 | 3.31 | - |
| -20 | 1488.6 | 1.3624 | 3.24E-07 | 0.225 | 1.11E-07 | 2.93 | - |
| -10 | 1463.61 | 1.3628 | 2.88E-07 | 0.218 | 1.10E-07 | 2.62 | - |
| 0 | 1438.46 | 1.3636 | 2.57E-07 | 0.211 | 1.08E-07 | 2.38 | - |
| 10 | 1412.51 | 1.3645 | 2.32E-07 | 0.204 | 1.07E-07 | 2.18 | - |
| 20 | 1386.4 | 1.3653 | 2.10E-07 | 0,199 | 1.05E-07 | 2 | 1.94E-03 |
| 30 | 1359.33 | 1.3662 | 1.90E-07 | 0.192 | 1.04E-07 | 1.83 | - |
| 40 | 1329.22 | 1.3674 | 1.73E-07 | 0.185 | 1.02E-07 | 1.7 | - |
| 50 | 1299.1 | 1.3683 | 1.62E-07 | 0.177 | 9.99E-08 | 1.61 | - |
Spiegeleisen es una aleación de ferromanganeso que contiene aproximadamente un 15 % de manganeso y pequeñas cantidades de carbono y silicio. Spiegeleisen a... (leer más)
Nafta es una mezcla de hidrocarburos líquidos inflamables. Es una fracción del petróleo crudo que se encuentra bajo... (leer más)
Potasa incluye varias sales extraídas y fabricadas que contienen potasio en forma soluble en agua. El nombre deriva de pot ash, cenizas de plantas o cenizas... (leer más)