Dímero (química)
Un dímero () (di-, "dos" + -mer, "partes&# 34;) es un oligómero formado por dos monómeros unidos por enlaces que pueden ser fuertes o débiles, covalentes o intermoleculares. Los dímeros también tienen implicaciones significativas en la química de polímeros; química inorgánica y bioquímica.
El término homodímero se utiliza cuando las dos moléculas son idénticas (por ejemplo, A–A) y heterodímero cuando no lo son (por ejemplo, A–B). El reverso de la dimerización a menudo se llama disociación. Cuando dos iones de carga opuesta se asocian en dímeros, se los denomina pares de Bjerrum, en honor a Niels Bjerrum.
Dímeros no covalentes
Los ácidos carboxílicos anhidros forman dímeros mediante enlaces de hidrógeno del hidrógeno ácido y el oxígeno del carbonilo. Por ejemplo, el ácido acético forma un dímero en la fase gaseosa, donde las unidades monoméricas se mantienen unidas por enlaces de hidrógeno. En condiciones especiales, la mayoría de las moléculas que contienen OH forman dímeros, p. el dímero de agua.
Los excímeros y los exciplejos son estructuras excitadas con una vida útil corta. Por ejemplo, los gases nobles no forman dímeros estables, pero sí forman los excímeros Ar2*, Kr2* y Xe2* bajo Estimulación eléctrica y de alta presión.
Dímeros covalentes
Los dímeros moleculares a menudo se forman por la reacción de dos compuestos idénticos, por ejemplo: 2A → A−A. En este ejemplo, el monómero "A" se dice que se dimeriza para dar el dímero "A−A". Un ejemplo es un diaminocarbeno, que se dimeriza para dar un tetraaminoetileno:
- (R2N)2C=C(NR2)2}}}" xmlns="http://www.w3.org/1998/Math/MathML">2C()NR2)2restablecimiento restablecimiento ()R2N)2C=C()NR2)2{displaystyle {ce {2 C(NR2)2 - Conf(R2N)2C=C(NR2)2}}
(R2N)2C=C(NR2)2}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/2737a0e92968a543ee16582bb5644e29cd072ebf" style="vertical-align: -1.005ex; width:35.602ex; height:3.009ex;"/>
Los carbenos son altamente reactivos y forman enlaces fácilmente.
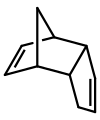
El diciclopentadieno es un dímero asimétrico de dos moléculas de ciclopentadieno que han reaccionado en una reacción de Diels-Alder para dar el producto. Al calentarse, se "agrieta" (sufre una reacción retro-Diels-Alder) para dar monómeros idénticos:
- 2 C5H6}}}" xmlns="http://www.w3.org/1998/Math/MathML">C10H12restablecimiento restablecimiento 2C5H6{displaystyle {ce {C10H12] 2 C5H6}}}
2 C5H6}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/6992f79c1ec67f8bbc12ec16f4df8f33a00d54ee" style="vertical-align: -1.005ex; width:19.349ex; height:2.843ex;"/>
Muchos elementos no metálicos se presentan como dímeros: hidrógeno, nitrógeno, oxígeno y los halógenos (es decir, flúor, cloro, bromo y yodo). Los gases nobles pueden formar dímeros unidos por enlaces de van der Waals, como el dihelio o el diargón. El mercurio se presenta como un catión de mercurio (I) (Hg2+2), formalmente un ion dimérico. Otros metales pueden formar una proporción de dímeros en su fase de vapor. Los dímeros metálicos conocidos incluyen dilitio (Li2), disodio ( Na2), dipotásico (K2), dirubidio (Rb2) y dicaesio (Cs2). Dichos dímeros elementales son moléculas diatómicas homonucleares.
Muchas moléculas orgánicas pequeñas, sobre todo el formaldehído, forman fácilmente dímeros. El dímero de formaldehído (CH2O) es el dioxetano ( C2H4O2 ).
El borano (BH3) se presenta como el dímero diborano (B2H6), debido a la alta acidez de Lewis del centro de boro.
Química de polímeros
En el contexto de los polímeros, "dímero" también se refiere al grado de polimerización 2, independientemente de la estequiometría o de las reacciones de condensación.
Un caso en el que esto es aplicable es con los disacáridos. Por ejemplo, la celobiosa es un dímero de glucosa, aunque la reacción de formación produce agua:
- C12H22O11 + H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">2C6H12O6restablecimiento restablecimiento C12H22O11+H2O{displaystyle {ce {2 C6H12O6 - titulada C12H22O11 + H2O}}
C12H22O11 + H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/9e0bc0f77f6073d357dd8e19f6e294c75df60df8" style="vertical-align: -1.005ex; width:34.163ex; height:2.843ex;"/>
Aquí, el dímero resultante tiene una estequiometría diferente del par inicial de monómeros.
Los disacáridos no necesitan estar compuestos por los mismos monosacáridos para ser considerados dímeros. Un ejemplo es la sacarosa, un dímero de fructosa y glucosa, que sigue la misma ecuación de reacción que se presentó anteriormente.
Los aminoácidos también pueden formar dímeros, que se denominan dipéptidos. Un ejemplo es la glicilglicina, que consta de dos moléculas de glicina unidas por un enlace peptídico. Otros ejemplos incluyen el aspartamo y la carnosina.
Dímeros inorgánicos
Dímeros del grupo 13
Boranes
El diborano (B2H6) es un ejemplo clásico de dímero inorgánico. El borano no existe solo como BH3, aunque a menudo se escribe de esa manera. B2H6 existe como una estructura donde dos átomos de hidrógeno unen los dos átomos de boro. Los enlaces B-H puente tienen un orden de enlace más bajo de lo que se esperaría para un enlace B-H regular (son más bajos en el orden de enlace que los enlaces B-H terminales). Esto se explica porque el enlace tiene tres centros pero solo dos electrones, "enlace banana", en lugar del típico enlace simple con dos centros y dos electrones.
Aluminio
Los complejos de organoaluminio pueden existir como monómeros o dímeros según el volumen estérico de los grupos unidos. Por ejemplo, el metilo o el etilaluminio existe como dímero, pero cuando se agrega un grupo más voluminoso, el complejo existe como monómero, como el trimesitilaluminio.
Dímeros bioquímicos
Dímeros de pirimidina
Los dímeros de pirimidina (también conocidos como dímeros de timina) se forman por una reacción fotoquímica a partir de bases de ADN de pirimidina cuando se exponen a la luz ultravioleta. Este entrecruzamiento provoca mutaciones en el ADN, que pueden ser cancerígenos y causar cánceres de piel. Cuando los dímeros de pirimidina están presentes, pueden bloquear las polimerasas, disminuyendo la funcionalidad del ADN hasta que se repare.
Dímeros de proteínas
Los dímeros de proteínas surgen de la interacción entre dos proteínas que pueden interactuar aún más para formar oligómeros más grandes y complejos. Por ejemplo, la tubulina se forma por la dimerización de α-tubulina y β-tubulina y este dímero puede polimerizarse más para formar microtúbulos. Para las proteínas simétricas, el complejo proteico más grande se puede descomponer en subunidades proteicas idénticas más pequeñas, que luego se dimerizan para disminuir el código genético requerido para producir la proteína funcional.
Receptores acoplados a proteína G
Como la familia de receptores más grande y diversa dentro del genoma humano, los receptores acoplados a proteína G (GPCR) se han estudiado ampliamente, con estudios recientes que respaldan su capacidad para formar dímeros. Los dímeros de GPCR incluyen tanto homodímeros como heterodímeros formados a partir de miembros relacionados de la familia de GPCR. Si bien no todos, algunos GPCR requieren dimerización para funcionar, como el receptor GABAB, lo que enfatiza la importancia de los dímeros en los sistemas biológicos.
Receptor tirosina quinasa
Al igual que los receptores acoplados a proteína G, la dimerización es esencial para que las tirosina quinasas receptoras (RTK) realicen su función en la transducción de señales, lo que afecta a muchos procesos celulares diferentes. Los RTK normalmente existen como monómeros, pero experimentan un cambio conformacional al unirse al ligando, lo que les permite dimerizarse con los RTK cercanos. La dimerización activa los dominios de cinasa citoplásmica que son responsables de la transducción de señales adicional.