Dihidroxilación asimétrica de Sharpless
La dihidroxilación asimétrica de Sharpless (también llamada bishidroxilación de Sharpless) es la reacción química de un alqueno con tetróxido de osmio en presencia de un ligando de quinina quiral para formar un diol vecinal.. La reacción se ha aplicado a alquenos de prácticamente todas las sustituciones, a menudo se obtienen enantioselectividades altas, con el resultado quiral controlado por la elección de dihidroquinidina (DHQD) frente a dihidroquinina (DHQ) como ligando. Las reacciones de dihidroxilación asimétrica también son muy selectivas para el sitio y proporcionan productos derivados de la reacción del doble enlace más rico en electrones del sustrato.
Es una práctica común realizar esta reacción utilizando una cantidad catalítica de tetróxido de osmio, que después de la reacción se regenera con reoxidantes como el ferricianuro de potasio o el N-óxido de N-metilmorfolina. Esto reduce drásticamente la cantidad necesaria del tetróxido de osmio altamente tóxico y muy costoso. Estos cuatro reactivos están disponibles comercialmente premezclados ("AD-mix"). La mezcla que contiene (DHQ)2-PHAL se llama AD-mix-α, y la mezcla que contiene (DHQD)2-PHAL se llama AD-mix-β.
Estos dioles quirales son importantes en la síntesis orgánica. La introducción de quiralidad en reactivos no quirales mediante el uso de catalizadores quirales es un concepto importante en la síntesis orgánica. Esta reacción fue desarrollada principalmente por K. Barry Sharpless basándose en la ya conocida dihidroxilación racémica de Upjohn, por la que recibió una parte del Premio Nobel de Química de 2001.
Antecedentes
La dihidroxilación de alquenos por tetróxido de osmio es un método antiguo y extremadamente útil para la funcionalización de olefinas. Sin embargo, dado que los reactivos de osmio (VIII) como el tetróxido de osmio (OsO4) son caros y extremadamente tóxicos, se ha vuelto deseable desarrollar variantes catalíticas de esta reacción. Algunos oxidantes terminales estequiométricos que se han empleado en estas reacciones catalíticas incluyen clorato de potasio, peróxido de hidrógeno (hidroxilación de Milas), N-óxido de N-metilmorfolina (NMO, dihidroxilación de Upjohn), hidroperóxido de terc-butilo (tBHP), y ferricianuro de potasio (K3Fe(CN)6). K. Barry Sharpless fue el primero en desarrollar una dihidroxilación de alquenos enantioselectiva confiable y general, denominada dihidroxilación asimétrica de Sharpless (SAD). Los niveles bajos de OsO4 se combinan con un oxidante de ferricianuro estequiométrico en presencia de ligandos nitrogenados quirales para crear un entorno asimétrico alrededor del oxidante.
Mecanismo de reacción
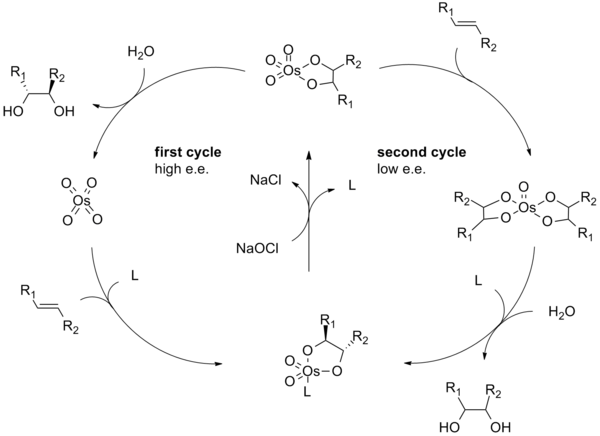
El mecanismo de reacción de la dihidroxilación de Sharpless comienza con la formación del complejo ligando-tetróxido de osmio (2). Una cicloadición [3+2] con el alqueno (3) da el intermedio cíclico 4. La hidrólisis básica libera el diol (5) y el osmato reducido (6). La metanosulfonamida (CH3SO2NH2) ha sido identificada como un catalizador para acelerar este paso del ciclo catalítico y si se usa con frecuencia como un aditivo para permitir que los sustratos de alqueno no terminal reaccionen de manera eficiente a 0 °C. Finalmente, el oxidante estequiométrico regenera el complejo tetróxido de osmio-ligando (2).
El mecanismo de la dihidroxilación asimétrica de Sharpless se ha estudiado exhaustivamente y se ha identificado un posible ciclo catalítico secundario (ver más abajo). Si el intermedio de éster de osmilato se oxida antes de que se disocie, entonces se forma un complejo de osmio (VIII)-diol que luego puede dihidroxilar otro alqueno. Las dihidroxilaciones que resultan de esta vía secundaria generalmente sufren enantioselectividades más bajas que las que resultan de la vía primaria. A continuación se muestra un esquema que muestra esta vía catalítica secundaria. Esta ruta secundaria puede suprimirse usando una concentración molar más alta de ligando.
Debate [2+2] contra [3+2]
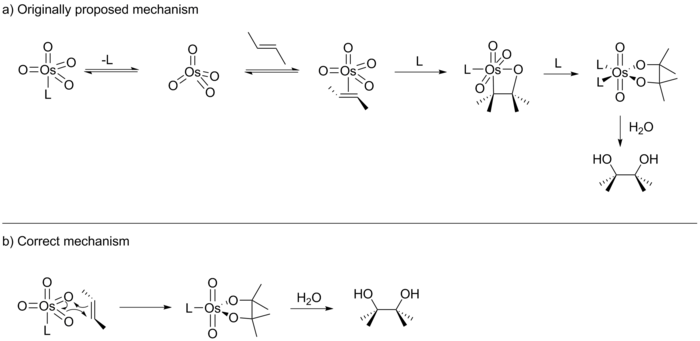
En su informe original, Sharpless sugirió que la reacción procedía mediante una cicloadición [2+2] de OsO4 en el alqueno para dar un intermedio de osmaoxetano (ver más abajo). Este intermediario luego sufriría una inserción migratoria 1,1- para formar un éster de osmilato que después de la hidrólisis daría el diol correspondiente. En 1989, E. J. Corey publicó una variante ligeramente diferente de esta reacción y sugirió que lo más probable es que la reacción procediera mediante una cicloadición [3+2] de OsO4 con el alqueno para generar directamente el éster de osmilato. La sugerencia de Corey se basó en un estudio computacional previo realizado por Jorgensen y Hoffmann que determinó que la vía de reacción [3+2] era la vía de menor energía. Además, Corey razonó que las repulsiones estéricas en el intermedio octaédrico desfavorecerían la vía [2+2].
Los siguientes diez años vieron numerosas publicaciones tanto de Corey como de Sharpless, cada una apoyando su propia versión del mecanismo. Si bien estos estudios no pudieron distinguir entre las dos vías de ciclación propuestas, lograron arrojar luz sobre el mecanismo de otras maneras. Por ejemplo, Sharpless proporcionó evidencia de que la reacción se desarrolla a través de un mecanismo gradual. Además, tanto Sharpless como Corey demostraron que el catalizador activo posee un bolsillo de unión quiral en forma de U. Corey también demostró que el catalizador obedece a la cinética de Michaelis-Menten y actúa como un bolsillo enzimático con un preequilibrio. En la edición de febrero de 1997 del Journal of the American Chemical Society, Sharpless publicó los resultados de un estudio (un análisis de Hammett) que, según él, respaldaba una ciclación [2+2] sobre una [3+2]. Sin embargo, en la edición de octubre del mismo año, Sharpless también publicó los resultados de otro estudio realizado en colaboración con Ken Houk y Singleton que proporcionó evidencia concluyente del mecanismo [3+2]. Así, Sharpless se vio obligado a conceder el debate de una década.
Estructura catalizadora
La evidencia cristalográfica ha demostrado que el catalizador activo posee una especie de osmio pentacoordinada contenida en un bolsillo de unión en forma de U. El ligando nitrogenado mantiene a OsO4 en un entorno quiral haciendo que el acercamiento de un lado de la olefina esté estéricamente impedido mientras que el otro no lo está.
Sistemas Catalíticos
Se han desarrollado numerosos sistemas catalíticos y modificaciones para el SAD. A continuación se ofrece una breve descripción de los diversos componentes del sistema catalítico:
- Oxidante catalítico: Esto es siempre OsO4, sin embargo ciertos aditivos pueden coordinarse al osmio(VIII) y modificar sus propiedades electrónicas. OsO4 a menudo se genera in situ de K2OsO2(OH)4 (una especie Os(VI)) debido a preocupaciones de seguridad.
- Auxiliar Chiral: Esto suele ser algún tipo de cinchona alkaloid.
- Stoichiometric Oxidant:
- Los peroxidos fueron uno de los primeros oxidantes estoquiométricos que se utilizaron en este ciclo catalítico; ver la hidroxilación de Milas. Los inconvenientes de los peróxidos incluyen problemas de quimioselectividad.
- Trialkylammonium Los óxidos N, como la NMO, como en la reacción de Upjohn, y el óxido de N trimetilalina.
- Ferricianuro de potasio (K3Fe(CN)6) es el oxidante estoichiométrico más utilizado para la reacción, y es el oxidante que viene en los preparativos AD-mix disponibles comercialmente.
- Aditivo:
- Ácido cítrico: Osmium tetroxide es un oxidante electrofílico y como tal reacciona lentamente con olefinas con deficiencia de electrones. Se ha encontrado que la tasa de oxidación de las olefinas con deficiencia de electrones puede acelerarse manteniendo el pH de la reacción ligeramente ácido. Por otro lado, un pH alto puede aumentar la tasa de oxidación de las olefinas internas, y también aumentar el exceso enantiomérico (por ejemplo) para la oxidación de las olefinas terminales.
Regioselectividad
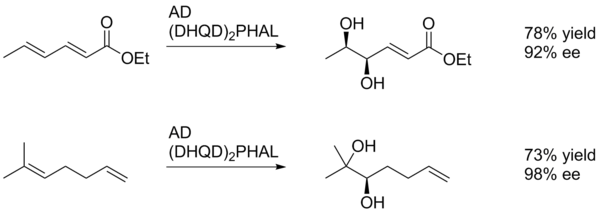
En general, la dihidroxilación asimétrica de Sharpless favorece la oxidación del alqueno más rico en electrones (esquema 1).
En este ejemplo, el triste da el diol del alqueno más cercano al grupo para-metoxibenzoil (retirado de electrones), aunque con bajo rendimiento. Esto probablemente se deba a la capacidad del anillo de arilo para interactuar favorablemente con el sitio activo del catalizador a través de la apilamiento π. De esta manera, el sustituyente de arilo puede actuar como un grupo de dirección.
Estereoselectividad
La diastereoselectividad de SAD se establece principalmente por la elección del ligando (es decir, AD-mix-α versus AD-mix-β), sin embargo, factores como la quiralidad preexistente en el sustrato o los grupos funcionales vecinos también pueden desempeñar un papel.. En el ejemplo que se muestra a continuación, el sustituyente para-metoxibenzoílo sirve principalmente como fuente de volumen estérico para permitir que el catalizador diferencie las dos caras del alqueno.
A menudo es difícil obtener una alta diastereoselectividad en alquenos disustituidos cis cuando ambos extremos de la olefina tienen entornos estéricos similares.
Contenido relacionado
Constante de disociación ácida
Seda
Efecto Baker-Nathan