Diferenciación celular
La diferenciación celular es el proceso en el que una célula madre cambia de un tipo a otro diferenciado. Por lo general, la célula cambia a un tipo más especializado. La diferenciación ocurre varias veces durante el desarrollo de un organismo multicelular a medida que cambia de un cigoto simple a un sistema complejo de tejidos y tipos de células. La diferenciación continúa en la edad adulta a medida que las células madre adultas se dividen y crean células hijas completamente diferenciadas durante la reparación de tejidos y durante la renovación celular normal. Se produce cierta diferenciación en respuesta a la exposición al antígeno. La diferenciación cambia drásticamente el tamaño, la forma, el potencial de membrana, la actividad metabólica y la capacidad de respuesta de una célula a las señales. Estos cambios se deben en gran medida a modificaciones altamente controladas en la expresión génica y son el estudio de la epigenética. Con algunas excepciones, la diferenciación celular casi nunca implica un cambio en la secuencia de ADN en sí. Sin embargo, la composición metabólica se altera bastante dramáticamente donde las células madre se caracterizan por abundantes metabolitos con estructuras altamente insaturadas cuyos niveles disminuyen con la diferenciación. Así, diferentes células pueden tener características físicas muy diferentes a pesar de tener el mismo genoma.
Un tipo especializado de diferenciación, conocido como diferenciación terminal, es importante en algunos tejidos, incluido el sistema nervioso de los vertebrados, el músculo estriado, la epidermis y el intestino. Durante la diferenciación terminal, una célula precursora que anteriormente era capaz de dividirse deja permanentemente el ciclo celular, desmantela la maquinaria del ciclo celular y, a menudo, expresa una variedad de genes característicos de la función final de la célula (p. ej., miosina y actina para una célula muscular). La diferenciación puede continuar después de la diferenciación terminal si la capacidad y las funciones de la célula sufren cambios adicionales.
Entre las células en división, existen múltiples niveles de potencia celular, que es la capacidad de la célula para diferenciarse en otros tipos de células. Una mayor potencia indica un mayor número de tipos de células que se pueden derivar. Una célula que puede diferenciarse en todos los tipos de células, incluido el tejido placentario, se conoce como totipotente. En los mamíferos, solo el cigoto y los blastómeros posteriores son totipotentes, mientras que en las plantas, muchas células diferenciadas pueden volverse totipotentes con técnicas de laboratorio simples. Una célula que puede diferenciarse en todos los tipos de células del organismo adulto se conoce como pluripotente. Estas células se denominan células meristemáticas en plantas superiores y células madre embrionarias en animales, aunque algunos grupos informan de la presencia de células pluripotentes adultas. La expresión inducida por virus de cuatro factores de transcripción Oct4, Sox2, c-Myc y Klf4 (factores Yamanaka) es suficiente para crear células pluripotentes (iPS) a partir de fibroblastos adultos. Una célula multipotente es aquella que puede diferenciarse en múltiples tipos de células diferentes, pero estrechamente relacionadas. Las células oligopotentes están más restringidas que las multipotentes, pero aún pueden diferenciarse en unos pocos tipos de células estrechamente relacionadas. Finalmente, las células unipotentes pueden diferenciarse en un solo tipo de célula, pero son capaces de autorrenovarse. En citopatología, el nivel de diferenciación celular se utiliza como medida de la progresión del cáncer. "Grado" es un marcador de cuán diferenciada es una célula en un tumor.
Tipos de células de mamíferos
Tres categorías básicas de células componen el cuerpo de los mamíferos: células germinales, células somáticas y células madre. Cada una de las aproximadamente 37,2 billones (3,72 x 1013) de células en un ser humano adulto tiene su propia copia o copias del genoma, excepto ciertos tipos de células, como los glóbulos rojos, que carecen de núcleo en su forma totalmente diferenciada. estado. La mayoría de las células son diploides; tienen dos copias de cada cromosoma. Estas células, llamadas células somáticas, constituyen la mayor parte del cuerpo humano, como las células de la piel y los músculos. Las células se diferencian para especializarse en diferentes funciones.
Las células de la línea germinal son cualquier línea de células que dan lugar a gametos (óvulos y espermatozoides) y, por lo tanto, son continuas a través de las generaciones. Las células madre, por otro lado, tienen la capacidad de dividirse por períodos indefinidos y dar lugar a células especializadas. Se describen mejor en el contexto del desarrollo humano normal.
El desarrollo comienza cuando un espermatozoide fertiliza un óvulo y crea una sola célula que tiene el potencial de formar un organismo completo. En las primeras horas después de la fecundación, esta célula se divide en células idénticas. En los humanos, aproximadamente cuatro días después de la fertilización y después de varios ciclos de división celular, estas células comienzan a especializarse, formando una esfera hueca de células, llamada blastocisto. El blastocisto tiene una capa externa de células, y dentro de esta esfera hueca hay un grupo de células llamado masa celular interna. Las células de la masa celular interna pasan a formar prácticamente todos los tejidos del cuerpo humano. Aunque las células de la masa celular interna pueden formar prácticamente todos los tipos de células que se encuentran en el cuerpo humano, no pueden formar un organismo. Estas células se denominan pluripotentes.
Las células madre pluripotentes se especializan aún más en células progenitoras multipotentes que luego dan lugar a células funcionales. Los ejemplos de células madre y progenitoras incluyen:
- Células gliales radiales (células neuronales embrínicas) que dan lugar a neuronas excitatorias en el cerebro fetal a través del proceso de neurogénesis.
- Células hematopoyéticas (células madre adultas) de la médula ósea que dan lugar a glóbulos rojos, glóbulos blancos y plaquetas.
- Células madre mesenquimal (células madre adultas) de la médula ósea que dan lugar a células estromales, células grasas y tipos de células óseas
- Células epiteliales (células progenitores) que dan lugar a los diversos tipos de células de la piel
- Celdas satelitales musculares (células de progenitor) que contribuyen al tejido muscular diferenciado.
Se crea una vía guiada por las moléculas de adhesión celular que consta de cuatro aminoácidos, arginina, glicina, asparagina y serina, a medida que el blastómero celular se diferencia de la blástula de una sola capa a las tres capas primarias de células germinales en mamíferos, a saber, el ectodermo, el mesodermo y el endodermo (enumerados desde el más distal (exterior) al proximal (interior)). El ectodermo acaba formando la piel y el sistema nervioso, el mesodermo forma los huesos y el tejido muscular, y el endodermo forma los tejidos de los órganos internos.
Desdiferenciación

La desdiferenciación, o integración, es un proceso celular que a menudo se observa en formas de vida más basales, como gusanos y anfibios, en el que una célula diferenciada parcial o terminalmente vuelve a una etapa de desarrollo anterior, generalmente como parte de un proceso regenerativo. La desdiferenciación también ocurre en las plantas. Las células en cultivo celular pueden perder propiedades que tenían originalmente, como la expresión de proteínas, o cambiar de forma. Este proceso también se denomina desdiferenciación.
Algunos creen que la desdiferenciación es una aberración del ciclo de desarrollo normal que resulta en cáncer, mientras que otros creen que es una parte natural de la respuesta inmune que los humanos pierden en algún momento como resultado de la evolución.
Se ha descubierto una pequeña molécula denominada reversina, un análogo de la purina, que ha demostrado que induce la desdiferenciación en los miotubos. Estas células desdiferenciadas podrían volver a diferenciarse en osteoblastos y adipocitos.
Mecanismos
Cada tipo de célula especializada en un organismo expresa un subconjunto de todos los genes que constituyen el genoma de esa especie. Cada tipo de célula se define por su patrón particular de expresión génica regulada. La diferenciación celular es, por lo tanto, una transición de una célula de un tipo de célula a otro e implica un cambio de un patrón de expresión génica a otro. La diferenciación celular durante el desarrollo puede entenderse como el resultado de una red reguladora de genes. Un gen regulador y sus módulos reguladores en cis son nodos en una red reguladora de genes; reciben entrada y crean salida en otra parte de la red. El enfoque de biología de sistemas para la biología del desarrollo enfatiza la importancia de investigar cómo interactúan los mecanismos de desarrollo para producir patrones predecibles (morfogénesis). Sin embargo, recientemente se ha propuesto una visión alternativa. Basado en la expresión génica estocástica, la diferenciación celular es el resultado de un proceso selectivo darwiniano que ocurre entre las células. En este marco, las redes de proteínas y genes son el resultado de procesos celulares y no su causa.
Si bien los procesos moleculares conservados evolutivamente están involucrados en los mecanismos celulares subyacentes a estos interruptores, en las especies animales estos son muy diferentes de los mecanismos reguladores de genes bien caracterizados de las bacterias, e incluso de los de los animales' parientes unicelulares más cercanos. Específicamente, la diferenciación celular en animales depende en gran medida de condensados biomoleculares de proteínas reguladoras y secuencias de ADN potenciadoras.
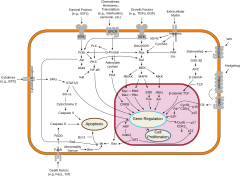
La diferenciación celular suele estar controlada por la señalización celular. Muchas de las moléculas señalizadoras que transmiten información de una célula a otra durante el control de la diferenciación celular se denominan factores de crecimiento. Aunque los detalles de las vías de transducción de señales específicas varían, estas vías a menudo comparten los siguientes pasos generales. Un ligando producido por una célula se une a un receptor en la región extracelular de otra célula, induciendo un cambio conformacional en el receptor. La forma del dominio citoplasmático del receptor cambia y el receptor adquiere actividad enzimática. El receptor luego cataliza reacciones que fosforilan otras proteínas, activándolas. Una cascada de reacciones de fosforilación finalmente activa un factor de transcripción latente o proteína del citoesqueleto, lo que contribuye al proceso de diferenciación en la célula diana. Las células y los tejidos pueden variar en competencia, su capacidad para responder a señales externas.
La inducción de señales se refiere a las cascadas de eventos de señalización, durante los cuales una célula o tejido envía señales a otra célula o tejido para influir en su destino de desarrollo. Yamamoto y Jeffery investigaron el papel del cristalino en la formación de ojos en peces que habitan en cuevas y en la superficie, un ejemplo sorprendente de inducción. A través de trasplantes recíprocos, Yamamoto y Jeffery descubrieron que la vesícula del cristalino de los peces de superficie puede inducir el desarrollo de otras partes del ojo en los peces que habitan en cuevas y en la superficie, mientras que la vesícula del cristalino de los peces que habitan en cuevas no puede.
Otros mecanismos importantes se incluyen en la categoría de divisiones celulares asimétricas, divisiones que dan lugar a células hijas con distintos destinos de desarrollo. Las divisiones celulares asimétricas pueden ocurrir debido a determinantes citoplasmáticos maternos expresados asimétricamente o debido a la señalización. En el primer mecanismo, se crean distintas células hijas durante la citocinesis debido a una distribución desigual de moléculas reguladoras en la célula madre; el citoplasma distinto que hereda cada célula hija da como resultado un patrón distinto de diferenciación para cada célula hija. Un ejemplo bien estudiado de formación de patrones por divisiones asimétricas es el patrón del eje del cuerpo en Drosophila. Las moléculas de ARN son un tipo importante de señal de control de diferenciación intracelular. La base molecular y genética de las divisiones celulares asimétricas también se ha estudiado en algas verdes del género Volvox, un sistema modelo para estudiar cómo los organismos unicelulares pueden evolucionar a organismos multicelulares. En Volvox carteri, las 16 células del hemisferio anterior de un embrión de 32 células se dividen asimétricamente y cada una produce una célula hija grande y una pequeña. El tamaño de la célula al final de todas las divisiones celulares determina si se convierte en una célula germinal especializada o somática.
Control epigenético
Dado que cada célula, independientemente del tipo celular, posee el mismo genoma, la determinación del tipo celular debe ocurrir al nivel de la expresión génica. Si bien la regulación de la expresión génica puede ocurrir a través de elementos reguladores cis y trans, incluidos los promotores y potenciadores de un gen, surge el problema de cómo se mantiene este patrón de expresión durante numerosas generaciones de división celular. Resulta que los procesos epigenéticos desempeñan un papel crucial en la regulación de la decisión de adoptar el destino de una célula madre, progenitora o madura. Esta sección se centrará principalmente en las células madre de mamíferos.
En la biología de sistemas y el modelado matemático de las redes reguladoras de genes, se predice que la determinación del destino celular exhibe ciertas dinámicas, como la convergencia del atractor (el atractor puede ser un punto de equilibrio, un ciclo límite o un atractor extraño) u oscilatorio.
Importancia del control epigenético
La primera pregunta que se puede hacer es el alcance y la complejidad del papel de los procesos epigenéticos en la determinación del destino celular. Una respuesta clara a esta pregunta se puede ver en el artículo de 2011 de Lister R, et al. sobre programación epigenómica aberrante en células madre pluripotentes inducidas por humanos. Dado que se cree que las células madre pluripotentes inducidas (iPSC) imitan a las células madre embrionarias en sus propiedades pluripotentes, deberían existir pocas diferencias epigenéticas entre ellas. Para probar esta predicción, los autores realizaron un perfil del genoma completo de los patrones de metilación del ADN en varias células madre embrionarias humanas (ESC), iPSC y líneas de células progenitoras.
Las células adiposas femeninas, los fibroblastos pulmonares y los fibroblastos del prepucio se reprogramaron en un estado pluripotente inducido con los genes OCT4, SOX2, KLF4 y MYC. Se compararon los patrones de metilación del ADN en ESC, iPSC y células somáticas. Lister R, et al. observaron una semejanza significativa en los niveles de metilación entre las células embrionarias y pluripotentes inducidas. Alrededor del 80% de los dinucleótidos CG en ESC y iPSC estaban metilados, lo mismo ocurría con solo el 60% de los dinucleótidos CG en células somáticas. Además, las células somáticas poseían niveles mínimos de metilación de citosina en dinucleótidos no CG, mientras que las células pluripotentes inducidas poseían niveles de metilación similares a los de las células madre embrionarias, entre 0,5 y 1,5 %. Por lo tanto, de acuerdo con sus respectivas actividades transcripcionales, los patrones de metilación del ADN, al menos a nivel genómico, son similares entre ESC e iPSC.
Sin embargo, al examinar los patrones de metilación más de cerca, los autores descubrieron 1175 regiones de metilación diferencial de dinucleótidos CG entre al menos una línea celular ES o iPS. Al comparar estas regiones de metilación diferencial con regiones de metilación de citosina en las células somáticas originales, el 44-49 % de las regiones metiladas diferencialmente reflejaron patrones de metilación de las respectivas células somáticas progenitoras, mientras que el 51-56 % de estas regiones eran diferentes tanto a las células progenitoras y líneas celulares embrionarias. La diferenciación inducida in vitro de las líneas iPSC vio la transmisión del 88 % y el 46 % de las regiones metiladas diferencialmente hiper e hipometiladas, respectivamente.
Dos conclusiones son fácilmente evidentes a partir de este estudio. Primero, los procesos epigenéticos están fuertemente involucrados en la determinación del destino celular, como se ve en los niveles similares de metilación de citosina entre las células madre pluripotentes y embrionarias inducidas, de acuerdo con sus respectivos patrones de transcripción. En segundo lugar, los mecanismos de reprogramación (y por extensión, diferenciación) son muy complejos y no se pueden duplicar fácilmente, como se ve por el número significativo de regiones metiladas diferencialmente entre las líneas celulares ES e iPS. Ahora que se han establecido estos dos puntos, podemos examinar algunos de los mecanismos epigenéticos que se cree que regulan la diferenciación celular.
Mecanismos de regulación epigenética
Factores pioneros (Oct4, Sox2, Nanog)
Tres factores de transcripción, OCT4, SOX2 y NANOG, los dos primeros de los cuales se utilizan en la reprogramación de células madre pluripotentes inducidas (iPSC), junto con Klf4 y c-Myc, están altamente expresados en células madre embrionarias indiferenciadas y son necesarios para el mantenimiento de su pluripotencialidad. Se cree que logran esto a través de alteraciones en la estructura de la cromatina, como la modificación de histonas y la metilación del ADN, para restringir o permitir la transcripción de genes diana. Si bien están altamente expresados, sus niveles requieren un equilibrio preciso para mantener la pluripotencia, cuya perturbación promoverá la diferenciación hacia diferentes linajes en función de cómo cambien los niveles de expresión génica. Se ha demostrado que la regulación diferencial de los niveles de Oct-4 y SOX2 precede a la selección del destino de la capa germinal. Los niveles elevados de Oct4 y los niveles reducidos de Sox2 promueven un destino mesendodérmico, con Oct4 suprimiendo activamente genes asociados con un destino ectodérmico neuronal. De manera similar, los niveles elevados de Sox2 y los niveles reducidos de Oct4 promueven la diferenciación hacia un destino ectodérmico neural, con Sox2 inhibiendo la diferenciación hacia un destino mesendodérmico. Independientemente de que las células del linaje se diferencien hacia abajo, la supresión de NANOG se ha identificado como un requisito previo necesario para la diferenciación.
Complejo represivo de Polycomb (PRC2)
En el ámbito del silenciamiento génico, el complejo represivo 2 de Polycomb, una de las dos clases de la familia de proteínas del grupo Polycomb (PcG), cataliza la dimetilación y la trimetilación de la histona H3 lisina 27 (H3K27me2/me3). Al unirse al nucleosoma marcado con H3K27me2/3, PRC1 (también un complejo de proteínas de la familia PcG) cataliza la monoubiquitinilación de la histona H2A en la lisina 119 (H2AK119Ub1), bloqueando la actividad de la ARN polimerasa II y provocando la supresión transcripcional. Las células ES knockout para PcG no se diferencian de manera eficiente en las tres capas germinales, y la eliminación de los genes PRC1 y PRC2 conduce a una mayor expresión de genes afiliados al linaje y a una diferenciación no programada. Presumiblemente, los complejos PcG son responsables de la represión transcripcional de los genes que promueven la diferenciación y el desarrollo.
Proteínas del grupo tritórax (TrxG)
Alternativamente, al recibir señales de diferenciación, las proteínas PcG se reclutan para los promotores de los factores de transcripción de pluripotencia. Las células ES deficientes en PcG pueden comenzar la diferenciación pero no pueden mantener el fenotipo diferenciado. Simultáneamente, los genes promotores de la diferenciación y el desarrollo son activados por los reguladores de la cromatina del grupo Trithorax (TrxG) y pierden su represión. Las proteínas TrxG se reclutan en regiones de alta actividad transcripcional, donde catalizan la trimetilación de la histona H3 lisina 4 (H3K4me3) y promueven la activación de genes a través de la acetilación de histonas. Los complejos PcG y TrxG participan en una competencia directa y se cree que son funcionalmente antagónicos, creando en la diferenciación y loci que promueven el desarrollo lo que se denomina un "dominio bivalente" y hacer que estos genes sean sensibles a una rápida inducción o represión.
Metilación del ADN
La regulación de la expresión génica se logra aún más a través de la metilación del ADN, en la que la metilación de los residuos de citosina en los dinucleótidos CpG mediada por la ADN metiltransferasa mantiene la represión hereditaria al controlar la accesibilidad del ADN. La mayoría de los sitios CpG en las células madre embrionarias no están metilados y parecen estar asociados con nucleosomas portadores de H3K4me3. Tras la diferenciación, una pequeña cantidad de genes, incluidos OCT4 y NANOG, se metilan y sus promotores se reprimen para evitar su expresión adicional. Consistentemente, las células madre embrionarias deficientes en la metilación del ADN entran rápidamente en apoptosis tras la diferenciación in vitro.
Posicionamiento de nucleosomas
Si bien la secuencia de ADN de la mayoría de las células de un organismo es la misma, los patrones de unión de los factores de transcripción y los patrones de expresión génica correspondientes son diferentes. En gran medida, las diferencias en la unión de los factores de transcripción están determinadas por la accesibilidad a la cromatina de sus sitios de unión a través de la modificación de histonas y/o factores pioneros. En particular, es importante saber si un nucleosoma cubre o no un sitio de unión genómico dado. Esto se puede determinar mediante un ensayo de inmunoprecipitación de cromatina (ChIP).
Acetilación y metilación de histonas
Las interacciones entre el ADN y el nucleosoma se caracterizan por dos estados: fuertemente unidas por los nucleosomas y transcripcionalmente inactivas, denominadas heterocromatina, o débilmente unidas y generalmente, aunque no siempre, transcripcionalmente activas, denominadas eucromatina. Los procesos epigenéticos de metilación y acetilación de histonas y sus procesos inversos de desmetilación y desacetilación explican principalmente estos cambios. Los efectos de la acetilación y la desacetilación son más predecibles. Un grupo acetilo se agrega o se elimina de los residuos de lisina cargados positivamente en las histonas mediante enzimas denominadas histona acetiltransferasas o histona desactilasas, respectivamente. El grupo acetilo evita la asociación de la lisina con la columna vertebral del ADN cargada negativamente. La metilación no es tan sencilla, ya que ni la metilación ni la desmetilación se correlacionan consistentemente con la activación o la represión de genes. Sin embargo, se ha demostrado repetidamente que ciertas metilaciones activan o reprimen genes. La trimetilación de la lisina 4 en la histona 3 (H3K4Me3) está asociada con la activación de genes, mientras que la trimetilación de la lisina 27 en la histona 3 reprime los genes.
En células madre
Durante la diferenciación, las células madre cambian sus perfiles de expresión génica. Estudios recientes han implicado un papel para el posicionamiento de nucleosomas y las modificaciones de histonas durante este proceso. Hay dos componentes de este proceso: apagar la expresión de genes de células madre embrionarias (ESC) y la activación de genes de destino celular. Se cree que la desmetilasa 1 específica de lisina (KDM1A) evita el uso de regiones potenciadoras de genes de pluripotencia, lo que inhibe su transcripción. Interactúa con el complejo Mi-2/NuRD (remodelación de nucleosomas e histona desacetilasa), dando un ejemplo en el que la metilación y la acetilación no son procesos discretos y mutuamente excluyentes, sino entrelazados.
Papel de la señalización en el control epigenético
Una pregunta final que se debe hacer se refiere al papel de la señalización celular para influir en los procesos epigenéticos que gobiernan la diferenciación. Tal papel debería existir, ya que sería razonable pensar que la señalización extrínseca puede conducir a la remodelación epigenética, al igual que puede conducir a cambios en la expresión génica a través de la activación o represión de diferentes factores de transcripción. Se dispone de pocos datos directos sobre las señales específicas que influyen en el epigenoma, y la mayor parte del conocimiento actual sobre el tema consiste en especulaciones sobre posibles reguladores candidatos de la remodelación epigenética. Primero discutiremos varios candidatos principales que se cree que están involucrados en la inducción y el mantenimiento de las células madre embrionarias y su progenie diferenciada, y luego pasaremos a un ejemplo de vías de señalización específicas en las que existe evidencia más directa de su papel en el cambio epigenético.
El primer candidato principal es la vía de señalización Wnt. La vía Wnt está involucrada en todas las etapas de diferenciación, y el ligando Wnt3a puede sustituir la sobreexpresión de c-Myc en la generación de células madre pluripotentes inducidas. Por otro lado, la interrupción de la β-catenina, un componente de la vía de señalización de Wnt, conduce a una disminución de la proliferación de progenitores neurales.
Los factores de crecimiento comprenden el segundo grupo principal de candidatos a reguladores epigenéticos de la diferenciación celular. Estos morfógenos son cruciales para el desarrollo e incluyen proteínas morfogenéticas óseas, factores de crecimiento transformantes (TGF) y factores de crecimiento de fibroblastos (FGF). Se ha demostrado que los TGF y los FGF mantienen la expresión de OCT4, SOX2 y NANOG mediante la señalización aguas abajo a las proteínas Smad. El agotamiento de los factores de crecimiento promueve la diferenciación de las ESC, mientras que los genes con cromatina bivalente pueden volverse más restrictivos o permisivos en su transcripción.
Varias otras vías de señalización también se consideran candidatas principales. Los factores inhibidores de la leucemia de citoquinas están asociados con el mantenimiento de las ESC de ratón en un estado indiferenciado. Esto se logra a través de la activación de la vía Jak-STAT3, que se ha demostrado que es necesaria y suficiente para mantener la pluripotencialidad de ESC del ratón. El ácido retinoico puede inducir la diferenciación de ESC humanos y de ratón, y la señalización de Notch está involucrada en la proliferación y autorrenovación de las células madre. Finalmente, Sonic hedgehog, además de su papel como morfógeno, promueve la diferenciación de células madre embrionarias y la autorrenovación de células madre somáticas.
El problema, por supuesto, es que la candidatura de estas vías de señalización se dedujo principalmente sobre la base de su papel en el desarrollo y la diferenciación celular. Si bien la regulación epigenética es necesaria para impulsar la diferenciación celular, ciertamente no es suficiente para este proceso. La modulación directa de la expresión génica a través de la modificación de los factores de transcripción juega un papel clave que debe distinguirse de los cambios epigenéticos hereditarios que pueden persistir incluso en ausencia de las señales ambientales originales. Actualmente, solo existen unos pocos ejemplos de vías de señalización que conducen a cambios epigenéticos que alteran el destino celular, y nos centraremos en uno de ellos.
La expresión de Shh (Sonic hedgehog) aumenta la producción de BMI1, un componente del complejo PcG que reconoce H3K27me3. Esto ocurre de manera dependiente de Gli, ya que Gli1 y Gli2 son efectores aguas abajo de la vía de señalización de Hedgehog. En cultivo, Bmi1 interviene en la capacidad de la vía Hedgehog para promover la autorrenovación de células madre mamarias humanas. Tanto en humanos como en ratones, los investigadores demostraron que Bmi1 se expresa en gran medida en la proliferación de precursores de células granulares cerebelosas inmaduras. Cuando se eliminó Bmi1 en ratones, se produjo un deterioro del desarrollo del cerebelo, lo que provocó reducciones significativas en la masa cerebral posnatal junto con anomalías en el control motor y el comportamiento. Un estudio separado mostró una disminución significativa en la proliferación de células madre neurales junto con una mayor proliferación de astrocitos en ratones sin Bmi.
Un modelo alternativo de diferenciación celular durante la embriogénesis es que la información posicional se basa en la señalización mecánica del citoesqueleto mediante ondas de diferenciación embrionaria. La señal mecánica luego se transduce epigenéticamente a través de sistemas de transducción de señales (de los cuales forman parte moléculas específicas como Wnt) para dar como resultado una expresión génica diferencial.
En resumen, el papel de la señalización en el control epigenético del destino celular en los mamíferos se desconoce en gran medida, pero existen distintos ejemplos que indican la probable existencia de otros mecanismos de este tipo.
Efecto de la elasticidad de la matriz
Para cumplir el propósito de regenerar una variedad de tejidos, se sabe que los tallos adultos migran de sus nichos, se adhieren a nuevas matrices extracelulares (MEC) y se diferencian. La ductilidad de estos microambientes es única para diferentes tipos de tejidos. La ECM que rodea el cerebro, los músculos y los tejidos óseos varía de blanda a rígida. La transducción de las células madre en estos tipos de células no está dirigida únicamente por señales de quimiocinas y señalización de célula a célula. La elasticidad del microambiente también puede afectar la diferenciación de las células madre mesenquimales (MSC que se originan en la médula ósea). Cuando las MSC se colocan en sustratos de la misma rigidez que la MEC del cerebro, el músculo y el hueso, las MSC adquieren las propiedades de esas células respectivas. tipos La detección de matriz requiere que la célula tire contra la matriz en las adherencias focales, lo que activa un mecanotransductor celular para generar una señal para saber qué fuerza se necesita para deformar la matriz. Para determinar los actores clave en la especificación de linaje impulsada por la elasticidad de la matriz en las MSC, se imitaron diferentes microentornos de matriz. A partir de estos experimentos, se concluyó que las adherencias focales de las MSC eran el mecanotransductor celular que detectaba las diferencias de elasticidad de la matriz. Las isoformas de miosina IIa-c no musculares generan las fuerzas en la célula que conducen a la señalización de marcadores de compromiso tempranos. La miosina IIa no muscular genera la menor fuerza que aumenta a la miosina IIc no muscular. También hay factores en la célula que inhiben la miosina II no muscular, como la blebbistatina. Esto hace que la célula sea efectivamente ciega a la matriz circundante. Los investigadores han obtenido cierto éxito en la inducción de propiedades similares a las de las células madre en las células HEK 239 proporcionando una matriz blanda sin el uso de factores de difusión. Las propiedades de las células madre parecen estar relacionadas con la tensión en las células. red de actina. Un mecanismo identificado para la diferenciación inducida por matriz son las proteínas inducidas por tensión, que remodelan la cromatina en respuesta al estiramiento mecánico. La vía RhoA también está implicada en este proceso.
Historia evolutiva
Un protista, probablemente holozoario, Bicellum brasieri de mil millones de años con dos tipos de células, muestra que la evolución de la multicelularidad diferenciada, posiblemente pero no necesariamente de linajes animales, ocurrió al menos hace 1 Hace miles de millones de años y posiblemente principalmente en lagos de agua dulce en lugar del océano.
Contenido relacionado
Anís
Regeneración
THC (desambiguación)