Dietilamina
La dietilamina es un compuesto orgánico con la fórmula (CH3CH2)2NH. Es una amina secundaria. Es un líquido inflamable, débilmente alcalino, miscible con la mayoría de los solventes. Es un líquido incoloro, pero las muestras comerciales suelen tener un color marrón debido a las impurezas. Tiene un fuerte olor parecido al amoníaco.
Producción y usos
La reacción catalizada por alúmina produce dietilamina a partir de etanol y amoníaco. La dietilamina se obtiene junto con la etilamina y la trietilamina. La producción anual de las tres etilaminas se estimó en 2000 en 80.000.000 kg.
La dietilamina se utiliza en la producción del inhibidor de corrosión N,N-dietilaminoetanol, mediante reacción con óxido de etileno. También es un precursor de una amplia variedad de otros productos comerciales. También se utiliza a veces en la producción ilícita de LSD.
Química Orgánica
La dietilamina, la amina secundaria más abundante y líquida a temperatura ambiente, se ha utilizado ampliamente en síntesis química. Sus reacciones ilustran el patrón observado para muchas otras dialquilaminas. Participa en reacciones de Mannich que implican la instalación de sustituyentes dietilaminometilo. La alquilación da la amina terciaria. Con cloruro de trimetilsililo, reacciona para dar la sililamida.
Estructura supramolecular
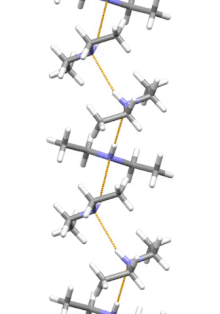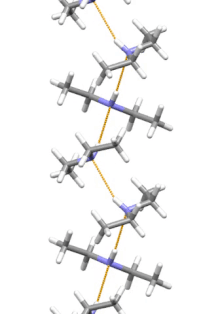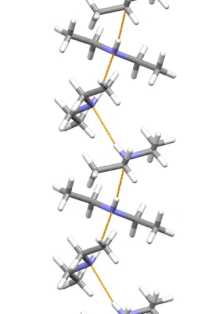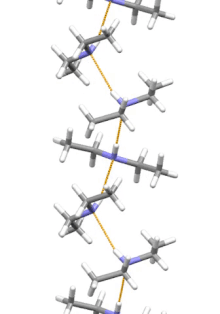
La dietilamina es la molécula más pequeña y simple que presenta una hélice supramolecular como su agregado de menor energía. Otras moléculas de tamaño similar que forman enlaces de hidrógeno prefieren estructuras cíclicas.
Seguridad
La dietilamina tiene baja toxicidad, pero el vapor provoca un deterioro transitorio de la visión.
Referencias
- ^ Índice de Merck, 12a edición, 3160
- ^ Nomenclatura de Química Orgánica: IUPAC Recomendaciones y Nombres Preferentes 2013 (Libro Azul). Cambridge: The Royal Society of Chemistry. 2014. p. 671. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. "#0209". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b "Diethylamine". Inmediatamente peligrosas para las concentraciones de vida o salud (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke (2005). "Amines, Aliphatic". Enciclopedia de Ullmann de Química Industrial. Weinheim: Wiley-VCH. doi:10.1002/14356007.a02_001. ISBN 978-3527306732.
{{cite encyclopedia}}: CS1 maint: múltiples nombres: lista de autores (link) - ^ Shulgin, Alexander. "Erowid Online Books:"TIHKAL" - #26 LSD-25". www.erowid.org. Retrieved 12 de agosto 2019.
- ^ Charles E. Maxwell (1943). "β-Diethylaminomethylacetophenone Hydrochloride". Sintetías orgánicas. 23: 30. doi:10.15227/orgsyn.023.0030.
- ^ C. F. H. Allen y J. A. VanAllan (1947). "Diethylaminoacetonitrile". Sintetías orgánicas. 27: 20. doi:10.15227/orgsyn.027.0020.
- ^ Alfred L. Wilds, Robert M. Nowak, Kirtland E. McCaleb (1957). "1-Diethylamino-3-Butanone". Sintetías orgánicas. 37: 18. doi:10.15227/orgsyn.037.0018.
{{cite journal}}: CS1 maint: múltiples nombres: lista de autores (link) - ^ W. W. Hartman (1934). "β-Diethylaminoethyl Alcohol". Sintetías orgánicas. 14: 28. doi:10.15227/orgsyn.014.0028.
- ^ W. J. Middleton, E. M. Bingham (1977). "Diethylaminosulfur Trifluoride". Sintetías orgánicas. 57: 50. doi:10.15227/orgsyn.057.0050.
- ^ Felix Hanke; Chloe J. Pugh; Ellis F. Kay; Joshua B. Taylor; Stephen M. Todd; Craig M. Robertson; Benjamin J. Slater; Alexander Steiner (2018). "El helix supramolecular más simple". Comunicaciones químicas. 54 (47): 6012–6015. doi:10.1039/C8CC03295E. PMID 29796532.
Enlaces externos
- hoja de datos sobre las sustancias peligrosas
- CDC - NIOSH Pocket Guide to Chemical Hazards