Diagrama de Walsh
Los diagramas de Walsh, a menudo llamados diagramas de coordenadas angulares o diagramas de correlación, son representaciones de energías de enlace orbital calculadas de una molécula frente a una coordenada de distorsión (ángulos de enlace), que se utilizan para hacer predicciones rápidas sobre las geometrías de moléculas pequeñas. Al trazar el cambio en los niveles orbitales moleculares de una molécula en función del cambio geométrico, los diagramas de Walsh explican por qué las moléculas son más estables en ciertas configuraciones espaciales (por ejemplo, por qué el agua adopta una conformación doblada).
Una aplicación importante de los diagramas de Walsh es explicar la regularidad en la estructura observada para moléculas relacionadas que tienen números idénticos de electrones de valencia (p. ej., por qué el H 2 O y el H 2 S se ven similares), y explicar cómo las moléculas alteran sus geometrías según su número de electrones. electrones o cambios de estado de espín. Además, los diagramas de Walsh se pueden usar para predecir distorsiones de la geometría molecular a partir del conocimiento de cómo el LUMO (orbital molecular desocupado más bajo) afecta al HOMO (orbital molecular más alto ocupado) cuando la molécula experimenta una perturbación geométrica.
La regla de Walsh para predecir las formas de las moléculas establece que una molécula adoptará una estructura que mejor proporcione la mayor estabilidad para su HOMO. Si un cambio estructural particular no perturba el HOMO, el orbital molecular ocupado más cercano gobierna la preferencia por la orientación geométrica.
Historia
Los diagramas de Walsh fueron presentados por primera vez por AD Walsh, un profesor de química británico en la Universidad de Dundee, en una serie de diez artículos en un número del Journal of the Chemical Society. Aquí, pretendía racionalizar las formas que adoptan las moléculas poliatómicas tanto en estado fundamental como en estado excitado, aplicando las aportaciones teóricas de Mulliken. Específicamente, Walsh calculó y explicó el efecto de los cambios en la forma de una molécula sobre la energía de los orbitales moleculares. Los diagramas de Walsh son una ilustración de tal dependencia, y sus conclusiones son lo que se conoce como las "reglas de Walsh".
En sus publicaciones, Walsh demostró a través de múltiples ejemplos que la geometría que adopta una molécula en su estado fundamental depende principalmente del número de sus electrones de valencia. Él mismo reconoció que este concepto general no era novedoso, pero explicó que los nuevos datos de los que disponía permitían ampliar y perfeccionar las generalizaciones anteriores. También señaló que Mulliken había intentado previamente construir un diagrama de correlación para los posibles orbitales de una molécula poliatómica en dos configuraciones nucleares diferentes, e incluso había tratado de usar este diagrama para explicar formas y espectros de moléculas en sus estados fundamental y excitado. Sin embargo, Mulliken no pudo explicar las razones de las subidas y bajadas de ciertas curvas con aumentos en el ángulo, por lo que Walsh afirmó que "su diagrama era empírico o se basaba en cálculos no publicados".
Visión general
Walsh originalmente construyó sus diagramas trazando lo que describió como "energías de enlace orbital" versus ángulos de enlace. No está claro lo que Walsh realmente describía con este término; algunos creen que, de hecho, se refería a los potenciales de ionización, sin embargo, esto sigue siendo un tema de debate. En cualquier caso, el concepto general que presentó fue que la energía total de una molécula es igual a la suma de todas las "energías de enlace orbital" en esa molécula. Por tanto, a partir del conocimiento de la estabilización o desestabilización de cada uno de los orbitales por una alteración del ángulo de enlace molecular, se puede predecir el ángulo de enlace de equilibrio para un estado particular de la molécula. Los orbitales que interactúan para estabilizar una configuración (p. ej., Lineal) pueden superponerse o no en otra configuración (p. ej., Bent), por lo que una geometría será calculablemente más estable que la otra.
Por lo general, los orbitales centrales (1s para B, C, N, O, F y Ne) se excluyen de los diagramas de Walsh porque tienen una energía tan baja que no experimentan un cambio significativo por variaciones en el ángulo de enlace. Solo se consideran los orbitales de valencia. Sin embargo, se debe tener en cuenta que algunos de los orbitales de valencia a menudo están desocupados.
Generación de diagramas de Walsh
Al preparar un diagrama de Walsh, primero se debe optimizar la geometría de una molécula, por ejemplo, utilizando el método Hartree-Fock (HF) para aproximar la función de onda del estado fundamental y la energía del estado fundamental de un sistema cuántico de muchos cuerpos. A continuación, se realizan energías de un solo punto para una serie de geometrías desplazadas de la geometría de equilibrio determinada anteriormente. Las energías de punto único (SPE) son cálculos de las superficies de energía potencial de una molécula para una disposición específica de los átomos en esa molécula. Al realizar estos cálculos, las longitudes de enlace permanecen constantes (en valores de equilibrio) y solo el ángulo de enlace debe modificarse de su valor de equilibrio. El cálculo de un solo punto para cada geometría se puede trazar frente al ángulo de enlace para producir el diagrama de Walsh representativo.
Estructura de un diagrama de Walsh
Moléculas AH 2
Para el sistema molecular AH 2 más simple, Walsh produjo el primer diagrama de correlación angular trazando las curvas de energía orbital ab initio para los orbitales moleculares canónicos mientras cambiaba el ángulo de enlace de 90° a 180°. A medida que se distorsiona el ángulo de enlace, la energía de cada uno de los orbitales se puede seguir a lo largo de las líneas, lo que permite una rápida aproximación de la energía molecular en función de la conformación. Todavía no está claro si la ordenada de Walsh considera o no la repulsión nuclear, y esto sigue siendo un tema de debate. Un resultado de predicción típico para el agua es un ángulo de enlace de 90°, que ni siquiera se acerca al valor derivado experimental de 104°. En el mejor de los casos, el método es capaz de diferenciar entre una molécula doblada y una lineal.
Este mismo concepto se puede aplicar a otras especies, incluidas las moléculas AB 2 y BAC sin hidruro, las moléculas HAB y HAAH, las moléculas con hidruro tetraatómico (AH 3), las moléculas sin hidruro tetraatómicas (AB), las moléculas H 2 AB, el acetaldehído, las moléculas pentaatómicas (CH3I), moléculas hexatómicas (etileno) y benceno.
Reactividad
Los diagramas de Walsh junto con la teoría de orbitales moleculares también se pueden utilizar como herramienta para predecir la reactividad. Al generar un Diagrama de Walsh y luego determinar el HOMO/LUMO de esa molécula, se puede determinar cómo es probable que reaccione la molécula. En el siguiente ejemplo, se predice la acidez de Lewis de moléculas AH 3 como BH 3 y CH 3.
Seis moléculas de AH 3 de electrones deben tener una conformación plana. Puede verse que el HOMO, 1e', del AH 3 plano se desestabiliza al doblar los enlaces AH para formar una forma piramidal, debido a la interrupción del enlace. El LUMO, que se concentra en un centro atómico, es un buen aceptor de electrones y explica el carácter ácido de Lewis de BH 3 y CH 3.
Los diagramas de correlación de Walsh también se pueden utilizar para predecir niveles de energía orbitales moleculares relativos. La distorsión de los átomos de hidrógeno del plano CH 3 al tetraédrico CH 3 -Nu provoca una estabilización del orbital de enlace C-Nu, σ.
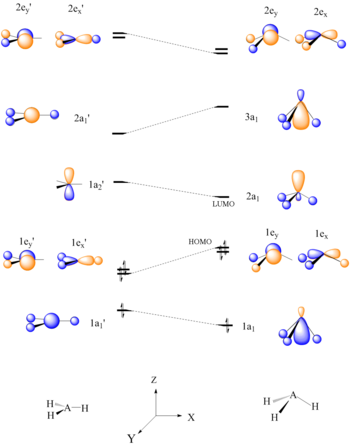 Un diagrama de Walsh para una molécula plana AH 3 Un diagrama de Walsh para una molécula plana AH 3 |  Diagrama de interacción orbital para la adición nucleófila a CH 3 Diagrama de interacción orbital para la adición nucleófila a CH 3 |
Otros diagramas de correlación
Otros diagramas de correlación son los diagramas de Tanabe-Sugano y los diagramas de Orgel.
Contenido relacionado
Botella de Mariotte
Coloide
Ácido bórico