Diagrama de Jablonski

En espectroscopia molecular, un diagrama de Jablonski es un diagrama que ilustra los estados electrónicos y, a menudo, los niveles de vibración de una molécula, y también las transiciones entre ellos. Los estados están ordenados verticalmente por energía y agrupados horizontalmente por multiplicidad de espín. Las transiciones no radiativas se indican con flechas onduladas y las transiciones radiativas con flechas rectas. Los estados vibratorios fundamentales de cada estado electrónico se indican con líneas gruesas, los estados vibratorios más altos con líneas más delgadas. El diagrama lleva el nombre del físico polaco Aleksander Jabłoński, quien lo propuso por primera vez en 1933.
Transiciones
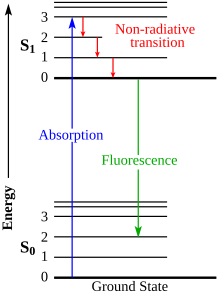
Cuando una molécula absorbe un fotón, la energía del fotón se convierte y aumenta el nivel de energía interna de la molécula. Asimismo, cuando una molécula excitada libera energía, puede hacerlo en forma de fotón. Dependiendo de la energía del fotón, esto podría corresponder a un cambio en los niveles de energía vibratoria, electrónica o rotacional. Los cambios entre estos niveles se denominan "transiciones" y se trazan en el diagrama de Jablonski.
Las transiciones radiativas implican la absorción o la emisión de un fotón. Como se mencionó anteriormente, estas transiciones se indican con flechas sólidas con sus colas en el nivel de energía inicial y sus puntas en el nivel de energía final.
Las transiciones no radiativas surgen a través de varios mecanismos diferentes, todos etiquetados de manera diferente en el diagrama. La relajación del estado excitado a su nivel vibratorio más bajo se llama relajación vibratoria. Este proceso implica la disipación de energía de la molécula a su entorno y, por lo tanto, no puede ocurrir en moléculas aisladas.
Un segundo tipo de transición no radiativa es la conversión interna (IC), que ocurre cuando un estado vibratorio de un estado excitado electrónicamente puede acoplarse a un estado vibratorio de un estado electrónico inferior. Posteriormente, la molécula podría relajarse aún más mediante la relajación vibratoria.
Un tercer tipo es el cruce entre sistemas (ISC); esta es una transición a un estado con una multiplicidad de espín diferente. En moléculas con un gran acoplamiento entre órbita y espín, el cruce entre sistemas es mucho más importante que en moléculas que exhiben sólo un acoplamiento entre órbita y espín pequeño. A ISC le puede seguir fosforescencia.
Contenido relacionado
Ley de Fick
Fuerza nuclear débil
Dalton (unidad)
Fuerza nuclear fuerte
Cátodo