Diagrama de ellingham
Un diagrama de Ellingham es un gráfico que muestra la dependencia de la temperatura de la estabilidad de los compuestos. Este análisis se utiliza generalmente para evaluar la facilidad de reducción de óxidos y sulfuros metálicos. Estos diagramas fueron construidos por primera vez por Harold Ellingham en 1944. En metalurgia, el diagrama de Ellingham se utiliza para predecir la temperatura de equilibrio entre un metal, su óxido y el oxígeno y, por extensión, las reacciones de un metal con azufre, nitrógeno y otros compuestos nocivos. -rieles. Los diagramas son útiles para predecir las condiciones bajo las cuales un mineral se reducirá a su metal. El análisis es de naturaleza termodinámica e ignora la cinética de reacción. Por lo tanto, los procesos que el diagrama de Ellingham predice que serán favorables aún pueden ser lentos.
Termodinámica
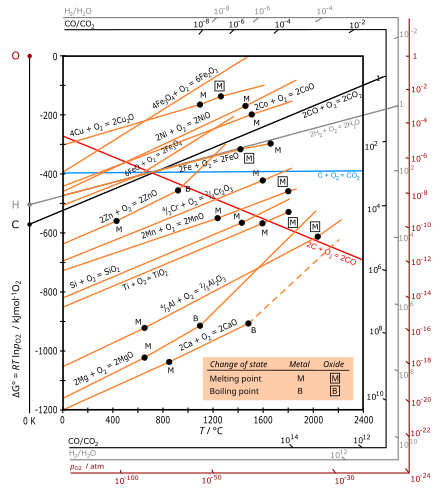
Los diagramas de Ellingham son una forma gráfica particular del principio de que la viabilidad termodinámica de una reacción depende del signo de ΔG, el cambio de energía libre de Gibbs, que es igual a ΔH. − TΔS, donde ΔH es el cambio de entalpía y ΔS es el cambio de entropía.
El diagrama de Ellingham representa el cambio de energía libre de Gibbs (ΔG) para cada reacción de oxidación en función de la temperatura. Para comparar diferentes reacciones, todos los valores de ΔG se refieren a la reacción de la misma cantidad de oxígeno, elegida como un mol de O (1⁄2 mol O
2) de algunos autores y un topo O
>2 por otros. El diagrama mostrado se refiere a 1 mol O
2, de modo que, por ejemplo. la línea para la oxidación del cromo muestra ΔG para la reacción 4⁄ 3 Cr(s) + O
2(g) → 2⁄3 Cr
2O
>3 (s), que es 2⁄3< /span> de la energía de formación de Gibbs molar ΔGf°(Cr
2O
3, s).
En los rangos de temperatura comúnmente utilizados, el metal y el óxido están en un estado condensado (sólido o líquido), y el oxígeno es un gas con una entropía molar mucho mayor. Para la oxidación de cada metal, la contribución dominante al cambio de entropía (Δ)S) es la eliminación de 1.2 mol O
2, por lo que ΔS es negativo y aproximadamente igual para todos los metales. La pendiente de las parcelas es por lo tanto positivo para todos los metales, con ΔG cada vez más negativo con menor temperatura, y las líneas para todos los óxidos metálicos son aproximadamente paralelas. Dado que estas reacciones son exotérmicas, siempre se vuelven factibles a temperaturas inferiores. A una temperatura suficientemente alta, el signo de ΔG puede invertir (ser positivo) y el óxido puede reducir espontáneamente al metal, como se muestra en Ag y Cu.
Para la oxidación del carbono, la línea roja es para la formación de CO: C(s) + 1.2 O
2g) → CO(g) con un aumento en el número de topos de gas, que conduce a un Δ positivoS y una pendiente negativa. La línea azul para la formación de CO2 es aproximadamente horizontal, ya que la reacción C(s) + O
2g) → CO2g) deja sin cambios el número de topos de gas para que ΔS es pequeño.
Como con cualquier predicción de reacción química basada en pura termodinámica terrenos, una reacción espontánea puede ser muy lenta si una o más etapas en la vía de reacción tienen energías de activación muy altas EA.
Si hay dos metales presentes, se deben considerar dos equilibrios. Se formará el óxido con el ΔG más negativo y el otro óxido se reducirá.
Características del diagrama
- Las curvas en los diagramas Ellingham para la formación de óxidos metálicos son básicamente líneas rectas con una pendiente positiva. La pendiente es proporcional a ΔS, que es aproximadamente constante con temperatura.
- Cuanto menor sea la posición de una línea de metal en el diagrama Ellingham, mayor es la estabilidad de su óxido. Por ejemplo, la línea de Al (oxidación de aluminio) se encuentra debajo de la de Fe (formación de Fe) Fe
2O
3) significa que el óxido de aluminio es más estable que el óxido de hierro(III). - Estabilidad de óxidos metálicos disminuye con aumento de temperatura. óxidos altamente inestables como Ag
2O y HgO se somete fácilmente a descomposición térmica. - La formación de energía libre de dióxido de carbono (CO)2) es casi independiente de la temperatura, mientras que la del monóxido de carbono (CO) tiene pendiente negativa y cruza el CO2 línea cerca de 700 °C. Según la reacción de Boudouard, el monóxido de carbono es el óxido dominante del carbono a temperaturas más altas (sobre 700 °C), y cuanto más alta sea la temperatura (sobre 700 °C) más efectiva es el carbono reductor (agente reductor).
- Si se comparan las curvas de dos metales a una temperatura determinada, el metal con la menor energía libre Gibbs de oxidación en el diagrama reducirá el óxido con la mayor energía libre de formación de Gibbs. Por ejemplo, el aluminio metálico puede reducir el óxido de hierro al hierro metálico, siendo el aluminio oxidado al óxido de aluminio. (Esta reacción se emplea en la termita.)
- Cuanto mayor sea la diferencia entre las dos líneas, mayor será la eficacia del agente de reducción correspondiente a la línea inferior.
- La intersección de dos líneas implica un equilibrio de oxidación-reducción. Reducción mediante un reductor dado es posible a temperaturas superiores al punto de intersección donde el ΔG line of that reductant is lower on the diagram than that of the metallic xide to be reduced. En el punto de intersección el cambio de energía libre para la reacción es cero, por debajo de esta temperatura es positivo y el óxido metálico es estable en la presencia del reductor, mientras que por encima del punto de intersección la energía Gibbs es negativa y el óxido se puede reducir.
Agentes reductores
En los procesos industriales, la reducción de óxidos metálicos suele realizarse mediante una reacción carbotérmica, utilizando carbono como agente reductor. El carbono está disponible a bajo precio en forma de carbón, que puede convertirse en coque. Cuando el carbono reacciona con el oxígeno forma los óxidos gaseosos monóxido de carbono y dióxido de carbono, por lo que la termodinámica de su oxidación es diferente a la de los metales: su oxidación tiene un ΔG más negativo con las temperaturas más altas (por encima 700 ºC). Por tanto, el carbono puede servir como agente reductor. Utilizando esta propiedad, la reducción de metales se puede realizar como una doble reacción redox a una temperatura relativamente baja.
Uso de diagramas Ellingham
La principal aplicación de los diagramas de Ellingham es en la industria metalúrgica extractiva, donde ayuda a seleccionar el mejor agente reductor para diversos minerales en el proceso de extracción, purificación y fijación de leyes para la fabricación de acero. También ayuda a guiar la purificación de metales, especialmente la eliminación de oligoelementos. El proceso de reducción directa para producir hierro se basa firmemente en la guía de los diagramas de Ellingham, que muestran que el hidrógeno por sí solo puede reducir los óxidos de hierro al metal.
Agente reductor de hematites
En la fundición de mineral de hierro, la hematita se reduce en la parte superior del horno, donde la temperatura está en el rango de 600 a 700 °C. El diagrama de Ellingham indica que en este rango el monóxido de carbono actúa como un agente reductor más fuerte que el carbono ya que el proceso
- 2 CO + O
2 → 2 CO2
tiene un cambio de energía libre más negativo que el proceso:
- 2 C + O
2 → 2 CO.
En la parte superior del alto horno, la hematita es reducida por CO (producido por la oxidación del coque en la parte inferior del alto horno, a una temperatura más alta) incluso en presencia de carbono, aunque esto se debe principalmente a la cinética. para el CO gaseoso que reacciona con el mineral son mejores.
No se puede utilizar agente reductor para óxido crómico-carbono
La curva de Ellingham para la reacción 2C(s) + O
2(g) → 2CO(g) desciende y cae por debajo de las curvas de todos los metales. Por tanto, el carbono normalmente puede actuar como agente reductor para todos los óxidos metálicos a temperaturas muy altas. Pero el cromo formado a estas temperaturas reacciona con el carbono para formar su carburo, lo que confiere propiedades indeseables al cromo metálico obtenido. Por lo tanto, para la reducción a alta temperatura del óxido crómico, no se puede utilizar carbono.
Proceso térmico de aluminio

La curva de Ellingham para el aluminio se encuentra por debajo de las curvas de la mayoría de los metales como el cromo, el hierro, etc. Este hecho indica que el aluminio se puede utilizar como agente reductor de los óxidos de todos estos metales. Este resultado se ilustra de la siguiente manera:
Las energías libres de formación de óxido de cromo (III) y óxido de aluminio por mol de oxígeno consumido son -541 kJ y -827 kJ respectivamente. Los procesos son:
| ()1) |
| ()2) |
La segunda ecuación menos la primera ecuación da:
| ()3) |
Así que el óxido de aluminio es más estable que el óxido de cromo (al menos a temperaturas normales, y de hecho todo el camino hasta las temperaturas de descomposición de los óxidos). Dado que el cambio de energía libre de Gibbs es negativo, el aluminio puede reducir el óxido de cromo.
En pirometalurgia, el aluminio se utiliza como agente reductor en el proceso aluminotérmico o proceso de termita para extraer cromo y manganeso mediante la reducción de sus óxidos.
Extensiones a otras reacciones en fase de gas
El concepto de trazar las energías libres de reacción de varios elementos con un reaccionante de la fase de gas puede extenderse más allá de las reacciones de oxidación. El documento original de Ellingham explícitamente a la reducción de oxígeno y azufre por procesos metalúrgicos, y previó el uso de estos diagramas para otros compuestos, incluyendo cloruros, carburos y sulfatos. El concepto es generalmente útil para estudiar la estabilidad comparativa de compuestos en una gama de presiones y temperaturas parciales. La construcción de un diagrama Ellingham es especialmente útil cuando se estudia la estabilidad de compuestos en presencia de un reductor. Los diagramas de Ellingham ya están disponibles para bromides, cloruros, fluoruros, hidratos, iodidos, nitridos, óxidos, sulfuros, selenides y dicurides.




