Diagrama de Davenport
En fisiología ácido-base, el diagrama de Davenport es una herramienta gráfica, desarrollada por Horace W. Davenport, que permite a un médico o investigador describir las concentraciones de bicarbonato en sangre y el pH de la sangre después de una alteración ácido-base respiratoria y/o metabólica. El diagrama representa una superficie tridimensional que describe todos los estados posibles de equilibrio químico entre dióxido de carbono gaseoso, bicarbonato acuoso y protones acuosos en la interfase fisiológicamente compleja de los alvéolos de los pulmones y los capilares alveolares. Aunque la superficie representada en el diagrama se determina experimentalmente, el diagrama de Davenport rara vez se utiliza en el ámbito clínico, pero permite al investigador visualizar los efectos de los cambios fisiológicos en la química ácido-base de la sangre. Para uso clínico existen dos innovaciones recientes: un diagrama ácido-base que proporciona descripciones de texto para las anomalías y una versión para grandes altitudes que proporciona descripciones de texto adecuadas para la altitud.
Derivación
Cuando una muestra de sangre se expone al aire, ya sea en los alvéolos de los pulmones o en un experimento de laboratorio in vitro, el dióxido de carbono del aire entra rápidamente en equilibrio con los derivados del dióxido de carbono y otras especies en la solución acuosa. La figura 1 ilustra las reacciones de equilibrio más importantes del dióxido de carbono en la sangre relacionadas con la fisiología ácido-base:
Tenga en cuenta que en esta ecuación, el sistema tampón HB/B representa todos los tampones distintos del bicarbonato presentes en la sangre, como la hemoglobina en sus diversos estados protonados y desprotonados. Debido a que en la sangre humana hay muchos tampones distintos del bicarbonato, el estado de equilibrio final alcanzado con cualquier pCO2 dado es muy complejo y no se puede predecir fácilmente utilizando solo la teoría. Al representar resultados experimentales, el diagrama de Davenport proporciona un enfoque simple para describir el comportamiento de este sistema complejo.
La figura 2 muestra un diagrama de Davenport tal como se representa comúnmente en los libros de texto y la literatura. Para entender cómo se debe interpretar el diagrama, es útil entender cómo se deriva en primer lugar. Considere el siguiente experimento. Se toma una pequeña muestra de sangre de un paciente sano y se coloca en una cámara en la que la presión parcial de dióxido de carbono (PCO2) se mantiene a 40 mmHg. Una vez que se alcanza el equilibrio, se miden el pH y la concentración de bicarbonato y se representan en un gráfico como en la figura 3.
A continuación, la PCO2 en la cámara se mantiene constante mientras se modifica el pH de la muestra de sangre, primero añadiendo un ácido fuerte y luego añadiendo una base fuerte. A medida que se varía el pH, se produce una curva de titulación para la muestra (Fig. 4). Observe que esta curva de titulación es válida solo a una PCO2 de 40 mmHg, porque la cámara se mantuvo a esta presión parcial durante todo el experimento.
A continuación, imaginemos que el experimentador obtiene una nueva muestra de sangre idéntica del mismo paciente. Sin embargo, en lugar de colocar la muestra en una cámara con una PCO2 de 40 mmHg, la cámara se restablece a una PCO2 de 60 mmHg. Después del equilibrio, se alcanza un nuevo punto, que indica un nuevo pH y una nueva concentración de bicarbonato (Fig. 5). Nótese que la concentración de bicarbonato en la nueva PCO2 más alta es mayor que en la primera medición, mientras que el pH ahora es menor. Ninguno de los resultados debería sorprender. El aumento de la PCO2 significa que la cantidad total de dióxido de carbono en el sistema ha aumentado. Debido a que el dióxido de carbono gaseoso está en equilibrio con los derivados del dióxido de carbono en la solución, las concentraciones de derivados del dióxido de carbono, incluido el bicarbonato, también deberían aumentar. La caída del pH tampoco es sorprendente, ya que la formación de una molécula de bicarbonato es concomitante con la liberación de un protón (ver Figura 1).
Si se repite este mismo experimento a distintas presiones parciales de dióxido de carbono, se obtendrá una serie de puntos. Se puede trazar una línea a través de estos puntos, llamada línea tampón (Fig. 6).
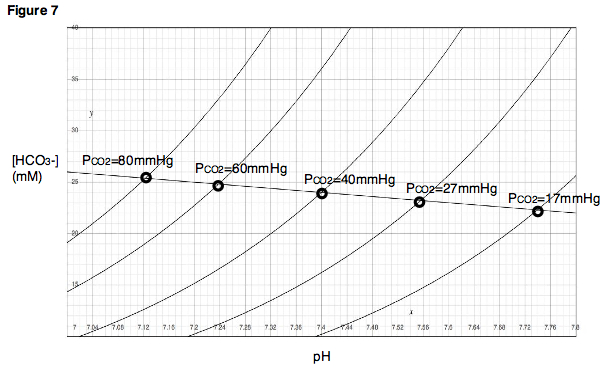
La línea de tampón se puede utilizar para predecir el resultado de variar la PCO2 dentro de un rango cercano a los puntos determinados experimentalmente. Además, para cada punto experimental, se puede realizar un experimento de titulación en el que se varía el pH mientras la PCO2 se mantiene constante, y se pueden generar curvas de titulación para cada una de las presiones parciales de dióxido de carbono (Fig. 7). En el diagrama de Davenport, estas curvas de titulación se denominan isopletas, porque se generan a una presión parcial fija de dióxido de carbono.
Un concepto clave para entender el diagrama de Davenport es observar que a medida que aumenta la PCO2, la magnitud del cambio resultante en el pH depende del poder amortiguador de los amortiguadores no bicarbonato presentes en la solución. Si hay presentes amortiguadores no bicarbonato fuertes, absorberán rápidamente la gran mayoría de los protones liberados por la formación de bicarbonato, y el pH cambiará muy poco para un aumento dado en la concentración de bicarbonato. El resultado será una línea amortiguadora con una pendiente muy pronunciada (Fig. 8). Por otro lado, si solo hay presentes amortiguadores no bicarbonato débiles (o si no hay ningún amortiguador no bicarbonato), se observará un cambio mucho mayor en el pH para un cambio dado en la concentración de bicarbonato, y la línea amortiguadora tendrá una pendiente más cercana a cero.
Resulta instructivo observar que la pendiente de la línea de bicarbonato nunca llegará a cero (es decir, nunca será horizontal) en condiciones de equilibrio, incluso en ausencia total de soluciones tampón que no sean de bicarbonato. Esto se debe a que la producción de protones resultante de un aumento de PCO2 es concomitante con la producción de iones de bicarbonato, como se mencionó anteriormente. Por lo tanto, una disminución del pH resultante de un aumento de PCO2 siempre debe ocurrir con un aumento mínimo de la concentración de bicarbonato. Del mismo modo, un aumento del pH por razones similares debe ocurrir con una disminución mínima de la concentración de bicarbonato.
Representación bidimensional de una superficie tridimensional
Recordemos que la relación representada en un diagrama de Davenport es una relación entre tres variables: PCO2, concentración de bicarbonato y pH. Por lo tanto, la figura 7 puede considerarse como un mapa topográfico, es decir, una representación bidimensional de una superficie tridimensional, donde cada isopleta indica una presión parcial o “altitud” diferente.
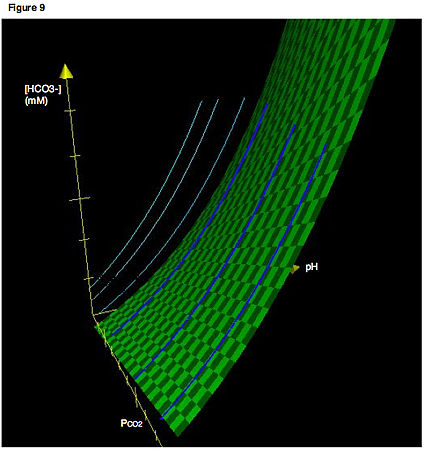
Una representación más precisa implicaría tres ejes. La Figura 9 muestra un diagrama de Davenport en tres dimensiones. Las líneas de color azul claro indican las isopletas tal como las encontraríamos normalmente, confinadas en un plano bidimensional. Las curvas de color azul oscuro muestran las ubicaciones reales de las isopletas en tres dimensiones. Por lo tanto, las líneas de color azul claro son simplemente las proyecciones de las isopletas en el espacio tridimensional sobre un plano bidimensional. Nuevamente, recuerde que una isopleta es simplemente una curva de titulación, es decir, el camino que se traza si se varía el pH mientras que la PCO2 se mantiene constante. La superficie verde describe todas las combinaciones de PCO2, [HCO3−] y pH que satisfacen el equilibrio del sistema. Todas las isopletas en sus orientaciones tridimensionales reales deben estar confinadas a esta superficie.
Un segundo concepto clave es que el movimiento a lo largo de una línea de amortiguación debe corresponder a un cambio en PCO2. Por lo tanto, al igual que las isopletas, la línea de amortiguación tal como se dibuja en un diagrama de Davenport típico (por ejemplo, Fig. 6) es en realidad la proyección de una línea existente en el espacio tridimensional sobre un plano bidimensional. Al igual que con las isopletas, las líneas de amortiguación en su orientación tridimensional real están confinadas a la superficie que representa los valores de PCO2, [HCO3−] y pH que satisfacen el equilibrio del sistema. En la figura 10, las líneas de color rojo oscuro son las líneas de amortiguación reales en el espacio tridimensional, mientras que las líneas de color rojo claro son las proyecciones de las líneas de amortiguación en un plano bidimensional. (Más adelante veremos cómo se pueden determinar múltiples líneas de amortiguación paralelas para un sistema determinado).
Trastornos respiratorios y metabólicos ácido-base
Una de las características más importantes del diagrama de Davenport es su utilidad para representar el movimiento desde un punto de la superficie de equilibrio a otro tras cambios en la respiración y/o el metabolismo. Pueden producirse cuatro cambios fundamentales que afecten al equilibrio ácido-base del organismo: acidosis respiratoria, alcalosis respiratoria, acidosis metabólica y alcalosis metabólica. Además, puede producirse simultáneamente una alteración respiratoria y metabólica, como la acidosis respiratoria seguida de un cambio compensatorio hacia la alcalosis metabólica.
Trastornos respiratorios
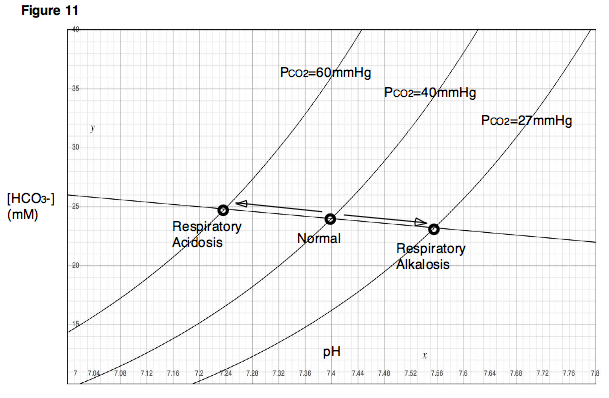
Para entender cómo los cambios en la respiración pueden afectar el pH de la sangre, considere los efectos de la ventilación en la PCO2 en los pulmones. Si una persona contuviera la respiración (o respirara muy lentamente, como en el caso de la depresión respiratoria), la sangre continuaría enviando dióxido de carbono a los alvéolos de los pulmones y la cantidad de dióxido de carbono en los pulmones aumentaría. Por otro lado, si una persona hiperventilara, entonces ingresaría aire fresco a los pulmones y el dióxido de carbono se expulsaría rápidamente. En el primer caso, debido a que el dióxido de carbono se acumula en los pulmones, la PCO2 alveolar se volvería muy alta. En el segundo caso, debido a que el dióxido de carbono sale rápidamente de los pulmones, la PCO2 alveolar sería muy baja. Obsérvese que estas dos situaciones, las de depresión respiratoria e hiperventilación, producen efectos que son inmediatamente análogos al experimento descrito anteriormente, en el que se variaron las presiones parciales de dióxido de carbono y se observaron los cambios resultantes en el pH. Como lo indica el diagrama de Davenport, la depresión respiratoria, que da como resultado una PCO2 alta, reducirá el pH sanguíneo. La hiperventilación tendrá los efectos opuestos. Una disminución del pH sanguíneo debido a la depresión respiratoria se llama acidosis respiratoria. Un aumento del pH sanguíneo debido a la hiperventilación se llama alcalosis respiratoria (Fig. 11).
Trastornos metabólicos
Los cambios en la composición metabólica de la sangre también pueden afectar el pH de la sangre. Nuevamente, recuerde que en nuestro experimento inicial, si se agrega un ácido fuerte o una base fuerte a la muestra de sangre, el pH y la concentración de bicarbonato cambiarán en consecuencia, lo que dará como resultado una curva de titulación. Los iones de hidróxido, por ejemplo, cuando se agregan a la solución, reaccionarán con los iones de hidrógeno libres y aumentarán el pH de la solución. Además, los iones de hidróxido extraerán protones del ácido carbónico en solución, lo que hará que aumente la concentración de bicarbonato. La nueva posición en el diagrama después de la adición de iones de hidróxido ya no se encuentra en nuestra línea tampón original. Sin embargo, si ahora se varía la PCO2 sin agregar más ácido fuerte o base fuerte a la solución, se puede determinar una nueva línea tampón que se encuentra por encima y aproximadamente paralela a la línea tampón original.
De manera similar, en un sistema fisiológico como un cuerpo vivo, la eliminación de protones, por ejemplo, al vomitar el contenido ácido del estómago, dará como resultado un aumento del pH y un aumento de la concentración de bicarbonato, llevando al sistema a una nueva línea tampón más alta. Esta alteración se denomina alcalosis metabólica (Fig. 12). Alternativamente, si se agregan protones al torrente sanguíneo en forma de metabolitos ácidos, como ocurre durante la cetoacidosis diabética, entonces el pH disminuirá, junto con la concentración de bicarbonato. Este tipo de alteración se denomina acidosis metabólica. En el caso de la acidosis metabólica, la nueva línea tampón se encuentra por debajo de la línea original.
Referencias
- ^ Grogono, Alan (1 abril 2019). "Los informes ácido-base necesitan una explicación de texto". Anestesiología. 130 4): 668 –669. doi:10.1097/ALN.0000000002628. Retrieved 1 de abril 2019.
- ^ Grogono, Alan (1 de enero de 2021). "Correcting Acid Base Interpretation for High Altitudes". Anestesiología. 134 1): 133 –135. doi:10.1097/ALN.0000000003581. Retrieved 1° de enero 2021.
- Davenport, Horace W. (1974). La ABC de la química de base ácida: Los elementos de la química fisiológica de los gases de sangre para estudiantes médicos y médicos (Sexta edición). Chicago: La Universidad de Chicago Press.
- Boron, Walter F. y Boulpaep, Emile L. (2003). Fisiología médica: un enfoque celular y molecular. Filadelfia: Saunders.