Desnitrificación
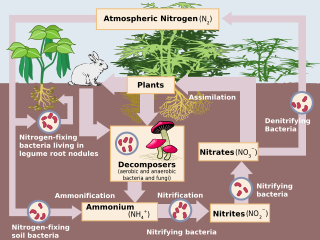
Desnitrificación es un proceso facilitado por microbios donde el nitrato (NO3-) se reduce y finalmente produce nitrógeno molecular (N2 ) a través de una serie de productos intermedios de óxido de nitrógeno gaseoso. Las bacterias anaeróbicas facultativas realizan la desnitrificación como un tipo de respiración que reduce las formas oxidadas de nitrógeno en respuesta a la oxidación de un donante de electrones, como la materia orgánica. Los aceptores de electrones de nitrógeno preferidos, en orden de mayor a menor termodinámicamente favorables, incluyen nitrato (NO3-), nitrito (NO2-). ), óxido nítrico (NO), óxido nitroso (N2O) dando como resultado finalmente la producción de dinitrógeno (N2) completando el ciclo del nitrógeno. Los microbios desnitrificantes requieren una concentración muy baja de oxígeno, inferior al 10%, así como C orgánico para obtener energía. Dado que la desnitrificación puede eliminar el NO3-, reduciendo su lixiviación a las aguas subterráneas, puede usarse estratégicamente para tratar aguas residuales o residuos animales con alto contenido de nitrógeno. La desnitrificación puede liberar N2O, que es una sustancia que agota la capa de ozono y un gas de efecto invernadero que puede tener una influencia considerable en el calentamiento global.
El proceso lo realizan principalmente bacterias heterótrofas (como Paracoccus denitrificans y varias pseudomonas), aunque también se han identificado desnitrificadores autótrofos (p. ej., Thiobacillus denitrificans). Los desnitrificadores están representados en todos los grupos filogenéticos principales. Generalmente varias especies de bacterias participan en la reducción completa de nitrato a N2 y se ha identificado más de una vía enzimática en el proceso de reducción. El proceso de desnitrificación no solo proporciona energía al organismo que realiza la reducción de nitrato a gas dinitrógeno, sino que también algunos ciliados anaeróbicos pueden usar endosimbiontes desnitrificantes para ganar energía similar al uso de mitocondrias en organismos que respiran oxígeno.
La reducción directa de nitrato a amonio, un proceso conocido como reducción disimilatoria de nitrato a amonio o DNRA, también es posible para organismos que tienen el gen nrf. Esto es menos común que la desnitrificación en la mayoría de los ecosistemas como medio de reducción de nitratos. Otros genes conocidos en microorganismos que desnitrifican incluyen nir (nitrito reductasa) y nos (óxido nitroso reductasa), entre otros; Los organismos identificados que tienen estos genes incluyen Alcaligenes faecalis, Alcaligenes xylosoxidans, muchos del género Pseudomonas, Bradyrhizobium japonicum, y Blastobacter denitrificans.
Descripción general
Medias reacciones
La desnitrificación generalmente se produce mediante alguna combinación de las siguientes semirreacciones, con la enzima que cataliza la reacción entre paréntesis:
- NO3− + 2 H+ + 2 e− → NO
2− + H2O (Nitrato reductasa) - NO
2− + 2 H+ + e− → NO + H2O (Nitrite reductase) - 2 NO + 2 H+ + 2 e− → N
2O + H2O (Reductasa de óxido nítrico) - N
2O + 2 H+ + 2 e− → N
2 + H2O (Nitrous-oxide reductase)
El proceso completo se puede expresar como una reacción redox neta equilibrada, donde el nitrato (NO3-) se reduce completamente a dinitrógeno (N2). sub>):
- 2 NO3− + 10 e− + 12 H+ → N2 + 6 H2O
Condiciones de desnitrificación
En la naturaleza, la desnitrificación puede tener lugar tanto en ecosistemas terrestres como marinos. Normalmente, la desnitrificación se produce en ambientes anóxicos, donde se agota la concentración de oxígeno disuelto y libremente disponible. En estas áreas, nitrato (NO3−) o nitrito (NO
>2< /span>-) se puede utilizar como aceptor de electrones terminal sustituto en lugar de oxígeno (O2), un aceptor de electrones energéticamente más favorable. El aceptor terminal de electrones es un compuesto que se reduce en la reacción al recibir electrones. Ejemplos de entornos anóxicos pueden incluir suelos, aguas subterráneas, humedales, depósitos de petróleo, rincones del océano mal ventilados y sedimentos del fondo marino.
Además, la desnitrificación también puede ocurrir en ambientes óxicos. Se puede observar una alta actividad de los desnitrificantes en las zonas intermareales, donde los ciclos de las mareas provocan fluctuaciones en la concentración de oxígeno en los sedimentos costeros arenosos. Por ejemplo, la especie bacteriana Paracoccus denitrificans participa en la desnitrificación en condiciones óxicas y anóxicas simultáneamente. Tras la exposición al oxígeno, las bacterias pueden utilizar óxido nitroso reductasa, una enzima que cataliza el último paso de la desnitrificación. Los desnitrificantes aeróbicos son principalmente bacterias Gram negativas del filo Proteobacteria. Las enzimas NapAB, NirS, NirK y NosZ se encuentran en el periplasma, un amplio espacio delimitado por la membrana citoplasmática y externa en las bacterias Gram-negativas.
La desnitrificación puede provocar una condición llamada fraccionamiento isotópico en el ambiente del suelo. Los dos isótopos estables del nitrógeno, 14N y 15N, se encuentran en los perfiles de sedimentos. Durante la desnitrificación se prefiere el isótopo de nitrógeno más ligero, 14N, dejando el isótopo de nitrógeno más pesado, 15N, en la materia residual. Esta selectividad conduce al enriquecimiento de 14N en la biomasa frente al 15N. Además, la abundancia relativa de 14N se puede analizar para distinguir la desnitrificación de otros procesos en la naturaleza.
Uso en el tratamiento de aguas residuales
La desnitrificación se utiliza comúnmente para eliminar el nitrógeno de las aguas residuales y municipales. También es un proceso instrumental en humedales artificiales y zonas ribereñas para la prevención de la contaminación de las aguas subterráneas con nitrato resultante del uso excesivo de fertilizantes agrícolas o residenciales. Los biorreactores de astillas de madera se han estudiado desde la década de 2000 y son eficaces para eliminar el nitrato de los escurrimientos agrícolas e incluso del estiércol.
La reducción en condiciones anóxicas también puede ocurrir mediante un proceso llamado oxidación anaeróbica de amonio (anammox):
- NH4+ + NO2− → N2 + 2 H2O
En algunas plantas de tratamiento de aguas residuales, se añaden al agua residual compuestos como metanol, etanol, acetato, glicerina o productos patentados para proporcionar una fuente de carbono y electrones para las bacterias desnitrificantes. La ecología microbiana de dichos procesos de desnitrificación diseñados está determinada por la naturaleza del donante de electrones y las condiciones operativas del proceso. Los procesos de desnitrificación también se utilizan en el tratamiento de aguas residuales industriales. Muchos tipos y diseños de biorreactores desnitrificantes están disponibles comercialmente para aplicaciones industriales, incluidos reactores electrobioquímicos (EBR), biorreactores de membrana (MBR) y biorreactores de lecho móvil (MBBR).
La desnitrificación aeróbica, realizada mediante desnitrificadores aeróbicos, puede ofrecer el potencial de eliminar la necesidad de tanques separados y reducir la producción de lodos. Existen requisitos de alcalinidad menos estrictos porque la alcalinidad generada durante la desnitrificación puede compensar en parte el consumo de alcalinidad en la nitrificación.
Desnitrificación no biológica
Existe una variedad de métodos no biológicos que pueden eliminar el nitrato. Estos incluyen métodos que pueden destruir compuestos de nitrógeno, como métodos químicos y electroquímicos, y aquellos que transfieren selectivamente nitrato a una corriente de desechos concentrados, como el intercambio iónico o la ósmosis inversa. La eliminación química del nitrato puede ocurrir mediante procesos de oxidación avanzados, aunque puede producir subproductos peligrosos. Los métodos electroquímicos pueden eliminar el nitrato mediante un voltaje aplicado a través de los electrodos, y la degradación generalmente ocurre en el cátodo. Los materiales catódicos eficaces incluyen metales de transición, metales de post-transición y semiconductores como el TiO2. Los métodos electroquímicos a menudo pueden evitar la necesidad de costosos aditivos químicos, pero su eficacia puede verse limitada por el pH y los iones presentes. La ósmosis inversa es muy eficaz para eliminar pequeños solutos cargados como el nitrato, pero también puede eliminar nutrientes deseables, crear grandes volúmenes de aguas residuales y requerir mayores presiones de bombeo. El intercambio iónico puede eliminar selectivamente el nitrato del agua sin grandes flujos de desechos, pero requiere regeneración y puede enfrentar desafíos con la absorción de iones no deseados.