Desmetilación
Desmetilación es el proceso químico que tiene como resultado la eliminación de un grupo metilo (CH3) de una molécula. Una forma común de desmetilación es el reemplazo de un grupo metilo por un átomo de hidrógeno, lo que resulta en una pérdida neta de un átomo de carbono y dos de hidrógeno.
La contrapartida de la desmetilación es la metilación.
En bioquímica
En los sistemas bioquímicos, el proceso de desmetilación es catalizado por desmetilasas. Estas enzimas oxidan los grupos N-metilo, que se encuentran en las histonas y en algunas formas de ADN:
- R2N-CH3 + O → R2N-H + CH2O
Una de estas familias de enzimas oxidativas es el citocromo P450. Las hidroxilasas dependientes de alfa-cetoglutarato son activas para la desmetilación del ADN, operando por una vía similar. Estas reacciones explotan el débil enlace C-H adyacente a las aminas.
En particular, las enzimas TET pueden desmetilar las 5-metilcitosinas del ADN, como se ilustra en la figura. Las enzimas TET son dioxigenasas de la familia de las hidroxilasas dependientes de alfa-cetoglutarato. Una enzima TET es una dioxigenasa dependiente de alfa-cetoglutarato (α-KG) que cataliza una reacción de oxidación al incorporar un solo átomo de oxígeno del oxígeno molecular (O2) en su sustrato, 5-metilcitosina en el ADN (5mC), para producir el producto 5-hidroximetilcitosina en el ADN. Esta conversión está acoplada con la oxidación del cosustrato α-KG a succinato y dióxido de carbono (ver figura).
El primer paso implica la unión de α-KG y 5-metilcitosina al sitio activo de la enzima TET. Cada una de las enzimas TET alberga un dominio catalítico central con un pliegue de hélice β de doble cadena que contiene los residuos de unión a metales cruciales que se encuentran en la familia de oxigenasas dependientes de Fe(II)/α-KG. α-KG se coordina como un ligando bidentado (conectado en dos puntos) al Fe(II) (ver figura), mientras que el 5mC está sostenido por una fuerza no covalente en las proximidades. El sitio activo de TET contiene un motivo de tríada altamente conservado, en el que el Fe(II) catalíticamente esencial está retenido por dos residuos de histidina y un residuo de ácido aspártico (ver figura). La tríada se une a una cara del centro Fe, dejando tres sitios lábiles disponibles para unirse a α-KG y O2 (ver figura). Luego, TET actúa para convertir la 5-metilcitosina en 5-hidroximetilcitosina, mientras que el α-cetoglutarato se convierte en succinato y CO2.
La desmetilación de algunos esteroles son pasos en la biosíntesis de testosterona y colesterol. Los grupos metilo se pierden como formato. Durante la embriogénesis en el ratón, alrededor de 20 millones de 5-metilcitosinas se desmetilan en un período de seis horas justo después de la fertilización de un óvulo por un espermatozoide para formar un cigoto.
En química orgánica
La desmetilación a menudo se refiere a la escisión de éteres, especialmente éteres de arilo, aunque hay algunas excepciones, como la N-desmetilación de aminas (p. ej., imipramina a desipramina).
Escisión de éteres metílicos
Los arilmetiléteres son omnipresentes en la lignina y en muchos compuestos derivados. La desmetilación de estos materiales ha sido objeto de mucho esfuerzo. La reacción normalmente requiere condiciones duras o reactivos duros. Por ejemplo, el éter metílico de la vainillina se puede eliminar calentándolo a cerca de 250 °C (482 °F) con una base fuerte. Los nucleófilos más fuertes, como los diorganofosfuros (LiPPh2), también escinden los éteres de arilo en condiciones más suaves. Otros nucleófilos fuertes que se han empleado incluyen sales de tiolato como EtSNa.
También se pueden utilizar condiciones ácidas. Históricamente, los éteres metílicos de arilo, incluidos productos naturales como la codeína (O-metilmorfina), se han desmetilado calentando la sustancia en clorhidrato de piridina fundido (punto de fusión 144 °C (291 °F)) a 180 a 220 °C (356 a 428 °F), a veces con exceso de cloruro de hidrógeno, en un proceso conocido como escisión del éter Zeisel-Prey. El análisis cuantitativo de los éteres metílicos aromáticos se puede realizar mediante la determinación argentométrica del cloruro de N-metilpiridinio formado. El mecanismo de esta reacción comienza con la transferencia de protones del ion piridinio al éter metílico de arilo, un paso muy desfavorable (K < 10–11) que explica las duras condiciones necesaria, dada la acidez mucho más débil del piridinio (pKa = 5,2) en comparación con el éter metílico de aril protonado (un ion arilmetiloxonio, pKa = –6,7 para arilo = Ph). A esto le sigue el ataque SN2 del ion arilmetiloxonio en el grupo metilo por el ion piridina o cloruro (según el sustrato) para dar el fenol libre y, en última instancia, el cloruro de N-metilpiridinio, ya sea directamente o mediante la subsiguiente transferencia de metilo de cloruro de metilo a piridina.
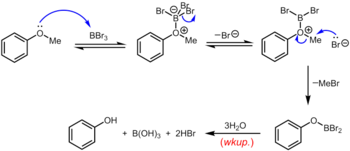
Otro método clásico (pero, nuevamente, duro) para la eliminación del grupo metilo de un éter metílico de arilo es calentar el éter a reflujo en una solución de bromuro de hidrógeno o yoduro de hidrógeno en ácido acético (punto de ebullición 118 °C (244 °F)) o ácido bromhídrico o yodhídrico concentrado. La escisión de los éteres por el ácido bromhídrico o yodhídrico procede por un mecanismo muy similar, en el que el HBr o el HI altamente ácidos sirven para protonar el éter, seguido por el desplazamiento por bromuro o yoduro, ambos excelentes nucleófilos. Un conjunto de condiciones ligeramente más suaves utiliza yoduro de ciclohexilo (CyI, 10,0 equiv) en N,N-dimetilformamida para generar una pequeña cantidad de yoduro de hidrógeno in situ. El tribromuro de boro, que se puede utilizar a temperatura ambiente o inferior, es un reactivo más especializado para la desmetilación de éteres metílicos de arilo. El mecanismo de desalquilación del éter procede a través de la formación reversible inicial de un aducto ácido-base de Lewis entre el BBr3 fuertemente ácido de Lewis y el éter básico de Lewis. Este aducto de Lewis puede disociarse reversiblemente para dar un catión dibromoboril oxonio y Br–. La ruptura del enlace éter se produce a través del subsiguiente ataque nucleofílico sobre las especies de oxonio por parte de Br– para producir un ariloxidibromoborano y bromuro de metilo. Una vez completada la reacción, el fenol se libera junto con el ácido bórico (H3BO3) y el ácido bromhídrico (ac. HBr) tras la hidrólisis del derivado de dibromoborano durante la fase acuosa. trabajo
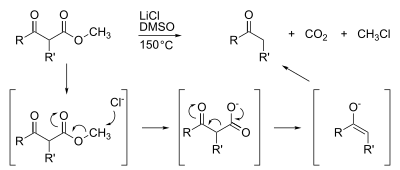
Los ésteres metílicos también son susceptibles a la desmetilación, que generalmente se logra mediante la saponificación. Las desmetilaciones altamente especializadas son abundantes, como la descarboxilación de Krapcho:
Se calentó una mezcla de anetol, KOH y alcohol en un autoclave. Aunque el producto de esta reacción era el anol esperado, Charles Dodds también descubrió un producto de dimerización altamente reactivo en las aguas madres llamado dianol.
N-desmetilación
LaN-desmetilación de las 3° aminas se realiza mediante la reacción de von Braun, que utiliza BrCN como reactivo para dar los derivados nor- correspondientes. Se desarrolló una variación moderna de la reacción de von Braun, en la que el cloroformiato de etilo reemplazó al BrCN. La preparación de Paxil a partir de arecolina es una aplicación de esta reacción, así como la síntesis de GSK-372,475, por ejemplo.
Contenido relacionado
Acridina
Cobre de berilio
Hidroxilisina