Depresor
Depresores, o depresores centrales, son fármacos que reducen los niveles de neurotransmisión, o deprimen o reducen la excitación o estimulación en diversas áreas del cerebro. A los depresores también se les conoce coloquialmente como "depresivos", ya que reducen el nivel de excitación cuando se toman. Los depresores no cambian el humor ni el estado mental de los demás. Estimulantes o "uppers" aumentan la función física o mental, por lo que la clase de fármacos opuesta a los depresores son los estimulantes, no los antidepresivos.
Los depresores se utilizan ampliamente en todo el mundo como medicamentos recetados y sustancias ilícitas. El alcohol es un depresor muy destacado. Cuando se utilizan depresores, los efectos suelen incluir ataxia, ansiolisis, alivio del dolor, sedación o somnolencia, deterioro cognitivo o de la memoria y, en algunos casos, euforia, disociación, relajación muscular, disminución de la presión arterial o del ritmo cardíaco, depresión respiratoria y efectos anticonvulsivos. Los depresores también actúan para producir anestesia. En ocasiones, el cannabis puede considerarse un depresor debido a uno de sus componentes, el cannabidiol. Se sabe que este último trata el insomnio, la ansiedad y los espasmos musculares, de forma similar a otros fármacos depresivos. Sin embargo, si bien el tetrahidrocannabinol, otro componente, puede ralentizar la función cerebral en un pequeño grado y reducir la reacción a los estímulos, generalmente se considera un estimulante y un agente psicoactivo principal que a veces puede causar ansiedad, pánico y psicosis. Otros depresores pueden incluir medicamentos como Xanax (una benzodiazepina) y varios opioides. Los gabapentinoides como la gabapentina y el baclofeno son depresores y tienen efectos anticonvulsivos y ansiolíticos. La mayoría de los anticonvulsivos como lamotrigina y fenitoína son depresores. Los carbamatos son depresores similares a los barbitúricos.
Los depresores ejercen sus efectos a través de varios mecanismos farmacológicos diferentes, los más destacados incluyen la facilitación del GABA y la inhibición de la actividad glutamatérgica o monoaminérgica. Otros ejemplos son las sustancias químicas que modifican las señales eléctricas dentro del cuerpo, las más destacadas son los bromuros y los bloqueadores de canales.
Indicaciones
Los depresores se utilizan con fines medicinales para aliviar los siguientes síntomas:
- Trastornos de ansiedad como:
- ansiedad generalizada
- ansiedad social
- Ataques de pánico
- Insomnio
- Trastorno obsesivo-compulsivo
- Incautaciones
- Convulsiones
- Depresión
- Dolor
Tipos

Alcohol
Una bebida alcohólica es una bebida que contiene alcohol (conocido formalmente como etanol), un anestésico que se ha utilizado como droga psicoactiva durante varios milenios. El etanol es la droga recreativa más antigua que todavía utiliza el ser humano. El etanol puede causar intoxicación por alcohol cuando se consume. Las bebidas alcohólicas se dividen en tres clases generales a efectos de imposición y regulación de la producción: cervezas, vinos y bebidas espirituosas (bebidas destiladas). Se consumen legalmente en la mayoría de los países del mundo. Más de 100 países tienen leyes que regulan su producción, venta y consumo.
La forma más común de medir la intoxicación con fines legales o médicos es a través del contenido de alcohol en sangre (también llamado concentración de alcohol en sangre o nivel de alcohol en sangre). Suele expresarse como porcentaje de alcohol en sangre en unidades de masa de alcohol por volumen de sangre, o masa de alcohol por masa de sangre, según el país. Por ejemplo, en América del Norte, un contenido de alcohol en sangre de 0,10 g/dL significa que hay 0,10 g de alcohol por cada dL de sangre (es decir, allí se utiliza masa por volumen).
Barbitúricos
Los barbitúricos son eficaces para aliviar las afecciones para las que están diseñados (insomnio, convulsiones). También se utilizan comúnmente para fines no aprobados, son físicamente adictivos y tienen un grave potencial de sobredosis. A finales de la década de 1950, cuando muchos pensaban que el costo social de los barbitúricos comenzaba a superar los beneficios médicos, se inició una búsqueda seria de un medicamento de reemplazo. La mayoría de las personas que todavía usan barbitúricos hoy en día lo hacen para prevenir las convulsiones o en forma suave para aliviar los síntomas de las migrañas.

Benzodiazepinas
Una benzodiazepina (a veces coloquialmente "benzo"; a menudo abreviada "BZD") es un fármaco cuya estructura química central es la fusión de un anillo de benceno y un anillo de diazepina. El primer fármaco de este tipo, el clordiazepóxido (Librium), fue descubierto accidentalmente por Leo Sternbach en 1955 y comercializado en 1960 por Hoffmann-La Roche, que también comercializa la benzodiazepina diazepam (Valium) desde 1963.
Las benzodiazepinas mejoran el efecto del neurotransmisor ácido gamma-aminobutírico (GABA) en el receptor GABAA, lo que produce propiedades sedantes, hipnóticas (inductoras del sueño), ansiolíticas (contra la ansiedad), anticonvulsivas y relajantes musculares; En la farmacología aplicada de dosis altas de muchas benzodiazepinas de acción más corta también se observan acciones amnésicas-disociativas. Estas propiedades hacen que las benzodiazepinas sean útiles para tratar la ansiedad, el insomnio, la agitación, las convulsiones, los espasmos musculares, la abstinencia de alcohol y como premedicación para procedimientos médicos o dentales. Las benzodiazepinas se clasifican en de acción corta, intermedia o prolongada. Para el tratamiento del insomnio se prefieren las benzodiazepinas de acción corta e intermedia; Se recomiendan benzodiazepinas de acción más prolongada para el tratamiento de la ansiedad.
En general, las benzodiazepinas son seguras y efectivas a corto plazo, aunque ocasionalmente se producen deterioros cognitivos y efectos paradójicos como agresión o desinhibición conductual. Una minoría reacciona a la inversa y en contra de lo que normalmente se esperaría. Por ejemplo, un estado de pánico puede empeorar considerablemente tras la ingesta de una benzodiazepina. El uso a largo plazo es controvertido debido a los efectos psicológicos y físicos adversos, la disminución de la eficacia, la dependencia física y el síndrome de abstinencia de benzodiazepinas, tras el uso prolongado. Debido a los efectos adversos asociados con el uso prolongado de benzodiazepinas, la abstinencia de las benzodiazepinas generalmente conduce a una mejor salud física y mental. Las personas mayores tienen un mayor riesgo de experimentar efectos adversos tanto a corto como a largo plazo.
Existe controversia sobre la seguridad de las benzodiazepinas durante el embarazo. Si bien no son teratógenos importantes, persiste la incertidumbre sobre si causan paladar hendido en un pequeño número de bebés y si se producen efectos neuroconductuales como resultado de la exposición prenatal; se sabe que causan síntomas de abstinencia en el recién nacido. Las benzodiazepinas se pueden tomar en sobredosis y pueden provocar una peligrosa pérdida del conocimiento profunda. Sin embargo, son mucho menos tóxicos que sus predecesores, los barbitúricos, y rara vez se produce la muerte cuando el único fármaco que se toma es una benzodiazepina; sin embargo, cuando se combina con otros depresores del sistema nervioso central, como el alcohol y los opiáceos, aumenta el potencial de toxicidad y sobredosis mortal. Las benzodiacepinas comúnmente se abusan y se toman en combinación con otras drogas adictivas. Además, todas las benzodiazepinas figuran en la lista de Beers, lo cual es importante en la práctica clínica.
Cannabis
El cannabis a menudo se considera en su propia categoría única o como un psicodélico suave. El compuesto químico tetrahidrocannabinol (THC), que se encuentra en el cannabis, tiene muchos efectos depresores, como relajación muscular, sedación, disminución del estado de alerta y cansancio. Al contrario de lo anterior, la activación del receptor CB1 por los cannabinoides provoca una inhibición del GABA, exactamente lo contrario de lo que hacen los depresores del sistema nervioso central.

Carbamatos
Los carbamatos son una clase de depresores o "tranquilizantes" que se sintetizan a partir de urea. Los carbamatos tienen efectos ansiolíticos, relajantes musculares, anticonvulsivos, hipnóticos, antihipertensivos y analgésicos. Tienen otros usos como temblores musculares, agitación y abstinencia de alcohol. Sus efectos relajantes musculares son útiles para torceduras, esguinces y lesiones musculares combinados con reposo, fisioterapia y otras medidas. Los efectos, la síntesis y el mecanismo de acción de los carbamatos son muy similares a los de los barbitúricos. Hay muchos tipos diferentes de carbamatos: algunos sólo producen efectos ansiolíticos e hipnóticos, mientras que otros sólo tienen efectos anticonvulsivos.
Los efectos secundarios de los carbamatos incluyen somnolencia, mareos, dolor de cabeza, diarrea, náuseas, flatulencia, insuficiencia hepática, mala coordinación, nistagmo, abuso, mareos, debilidad, nerviosismo, euforia, sobreestimulación y dependencia. Las reacciones adversas poco comunes pero potencialmente graves incluyen reacciones de hipersensibilidad como el síndrome de Stevens Johnson, toxicidad embriofetal, estupor y coma. Los carbamatos son fatales en caso de sobredosis, razón por la cual muchos han sido reemplazados por benzodiazepinas. No se recomienda el uso prolongado de la mayoría de los carbamatos como Carisoprodol, ya que se produce dependencia física y psicológica.
El meprobamato, que se metaboliza en carisoprodol, se lanzó al mercado en 1955. Rápidamente se convirtió en la primera droga psicotrópica de gran éxito en Estados Unidos, se hizo popular en Hollywood y ganó fama por sus efectos aparentemente milagrosos. Desde entonces se ha comercializado con más de 100 nombres comerciales, incluidos Amepromat, Quivet y Zirpon. El carisoprodol, que todavía se utiliza principalmente por sus efectos relajantes musculares, puede potencialmente abusar. Su mecanismo de acción es muy similar al de los barbitúricos, el alcohol, la metacualona y las benzodiazepinas. El carisoprodol modula alostéricamente y activa directamente el α1β2γ2 GABAAR (GABAA) humano en el sistema nervioso central, de forma similar a los barbitúricos. Esto hace que los canales de cloruro se abran, permitiendo que el cloruro ingrese a la neurona. Esto ralentiza la comunicación entre las neuronas y el sistema nervioso. A diferencia de las benzodiazepinas, que aumentan la frecuencia de apertura del canal de cloruro, el carisoprodol aumenta la duración de la apertura del canal cuando se une GABA. GABA es el principal neurotransmisor inhibidor del sistema nervioso, lo que provoca sus efectos depresores.
Los carbamatos son mortales en caso de sobredosis. Los síntomas son similares a los de una sobredosis de barbitúricos y normalmente incluyen dificultad para pensar, mala coordinación, disminución del nivel de conciencia y disminución del esfuerzo para respirar (depresión respiratoria). Es más probable que una sobredosis sea fatal cuando se mezcla con otro depresor que suprime la respiración.
La dependencia física y psicológica ocurre con el uso prolongado de carbamatos; particularmente carisoprodol. Hoy en día, el carisoprodol sólo se utiliza a corto plazo para los dolores musculares, especialmente los de espalda. La interrupción después de un uso prolongado podría ser muy intensa e incluso posiblemente fatal. La abstinencia puede parecerse a la abstinencia de barbitúricos, alcohol o benzodiazepinas, ya que todos tienen un mecanismo de acción similar. Los síntomas de interrupción incluyen confusión, desorientación, delirio, alucinaciones (auditivas y visuales), insomnio, disminución del apetito, ansiedad, agitación psicomotora, presión del habla, temblores, taquicardia y convulsiones, que podrían ser fatales.
Los carbamatos eran populares en la década de 1950 junto con los barbitúricos. Aunque se han ido eliminando poco a poco, principalmente debido a los riesgos de sobredosis y dependencia, todavía existen nuevos derivados. Entre ellos se encuentra el felbamato, un anticonvulsivo aprobado en 1993 y que se utiliza habitualmente en la actualidad. Es un modulador alostérico positivo para GABAA y bloquea la subunidad NR2B del receptor NMDA. Otros carbamatos bloquean los canales de sodio. El fenprobamato se utilizaba como ansiolítico y en ocasiones todavía se utiliza en Europa para anestesia general y para tratar calambres musculares y espasticidad. El metocarbamol es un medicamento popular que se conoce comúnmente como Robaxin y se vende sin receta en algunos países. Es un carbamato con efectos relajantes musculares. El tetrabamato es un fármaco controvertido que es una combinación de febarbamato, difebarbamato y fenobarbital. Se comercializa en Europa y se ha descontinuado en gran medida, pero no por completo. El 4 de abril de 1997, después de más de 30 años de uso debido a informes de hepatitis e insuficiencia hepática aguda, se restringió el uso del fármaco. El carisoprodol, conocido como "Soma", todavía se utiliza habitualmente hoy en día por sus efectos relajantes musculares. También se abusa de él con mucha frecuencia en todo el mundo. Es una sustancia de la Lista IV en los Estados Unidos. El famoso actor y artista marcial Bruce Lee murió debido a una reacción alérgica al meprobamato.
Aprobado
- Carisoprodol/Meprobamate/TybamateSoma/Miltown, Solacen) (musculo relajante, axiolítico, tranquilizante)
- DifebarbamateAtrium, Sevrium) (tranquilizer)
- EmylcamateStriatran) (anxiolítica y relajante muscular)
- EthinamateValamin, Valmid) (sedative-hypnotic)
- Febarbamate/Phenobamate (Phenobamato)Solium, Tymium) (anxiolítica y tranquilizante)
- FelbamateFelbatol) (anticonvulsivo)
- Hexapropymate (Merinax) (hipnotic-sedative)
- MebutamateCapla, Dormate) (anxiolítica, sedante, antihipertensiva)
- PhenprobamateGamaquil, Isotonil) (musculo relajante, sedante, axiolítica, anticonvulsivo, anestesia)
- Procymate (procymate)Equipax) (sedative, anxiolytic)
- StyramateSinaxamol.
- Tetrabamato (febarbamato, difebarbamato, fenobarbital) (Atrium, G Tril, Sevrium) (ansiedad, retiro de alcohol, temblores musculares, agitación, depresión)
Aunque un medicamento puede estar aprobado, eso no significa necesariamente que todavía se use en la actualidad.
No aprobado
- Carisbamato (anticonvulsivo)
- Clocental (hipnotic)
- Cyclarbamate (muscle relaxant and tranquilizer)
- Lorbamate (muscle relaxant and tranquilizer)
- Nisobamate (tranquilizer)
- Pentabamate (tranquilizer)
Gabapentinoides
Los gabapentinoides son una clase única y relativamente nueva de depresores que se unen selectivamente al sitio de la subunidad α2δ auxiliar (CACNA2D1 y CACNA2D2) de ciertos VDCC y, por lo tanto, actúan como inhibidores de los canales de calcio dependientes de voltaje que contienen la subunidad α2δ. α2δ recibe el sobrenombre de "receptor de gabapentina". En el potencial de membrana fisiológico o en reposo, los VDCC normalmente están cerrados. Se activan (abren) en potenciales de membrana despolarizados, que es la fuente de la actividad "activada por voltaje" epíteto. Los gabapentinoides se unen a los sitios α1 y α2 de la familia de subunidades α2δ. La gabapentina es el gabapentinoide prototípico. El α2δ se encuentra en los canales de calcio tipo L, los canales de calcio tipo N, los canales de calcio tipo P/Q y los canales de calcio tipo R en todo el sistema nervioso central y periférico. α2δ se encuentra en las neuronas presinápticas y afecta el tráfico y la cinética de los canales de calcio, inicia cascadas de señalización extracelular, expresión genética y promueve la sinaptogénesis excitatoria a través de la trombospondina 1. Los gabapentinoides no son bloqueadores directos de los canales; más bien, interrumpen la función reguladora de α2δ y sus interacciones con otras proteínas. La mayoría de los efectos de los gabapentinoides están mediados por los canales de calcio de tipo N y P/Q activados por alto voltaje. Los canales de calcio de tipo P/Q se encuentran principalmente en el cerebelo (neuronas de Purkinje), que pueden ser responsables del efecto adverso atáxico de los gabapentinoides, mientras que los canales de calcio de tipo N se encuentran en todo el sistema nervioso central y periférico. Los canales de calcio tipo N son los principales responsables de los efectos analgésicos de los gabapentinoides. La ziconotida, un péptido ω-conotoxina no gabapentinoide, se une a los canales de calcio de tipo N y tiene efectos analgésicos 1000 veces más fuertes que la morfina. Los gabapentinoides son selectivos para el sitio α2δ, pero no selectivos cuando se unen al complejo de canales de calcio. Actúan en el sitio α2δ para reducir la liberación de muchos neuroquímicos excitadores y pronociceptivos, incluidos el glutamato, la sustancia P, el péptido relacionado con el gen de la calcitonina (CGRP) y más.
Los gabapentinoides se absorben en los intestinos principalmente mediante el transportador grande de aminoácidos neutros 1 (LAT1, SLC7A5) y el transportador excitador de aminoácidos 3 (EAAT3). Son uno de los pocos medicamentos que utilizan estos transportadores de aminoácidos. Los gabapentinoides son estructuralmente similares a los aminoácidos de cadena ramificada L-leucina y L-isoleucina, los cuales también se unen al sitio α2δ. Los aminoácidos de cadena ramificada como la l-leucina, la l-isoleucina y la l-valina tienen muchas funciones en el sistema nervioso central. Modifican el transporte de grandes aminoácidos neutros (LNAA) en la barrera hematoencefálica y reducen la síntesis de neurotransmisores derivados de aminoácidos aromáticos, en particular la serotonina del triptófano y las catecolaminas de la tirosina y la fenilalanina. Esto puede ser relevante para la farmacología de los gabapentinoides.
La gabapentina fue diseñada por investigadores de Parke-Davis para ser un análogo del neurotransmisor GABA que podría cruzar más fácilmente la barrera hematoencefálica y fue descrita por primera vez en 1975 por Satzinger y Hartenstein. La gabapentina se aprobó por primera vez para la epilepsia, principalmente como tratamiento complementario de las convulsiones parciales. Los gabapentinoides son análogos de GABA, pero no se unen a los receptores GABA, no se convierten en GABA u otro agonista del receptor GABA in vivo, ni modulan directamente el transporte o el metabolismo de GABA. El fenibut y el baclofeno, dos compuestos estructuralmente relacionados, son excepciones, ya que actúan principalmente sobre el receptor GABA B. Se ha descubierto que la gabapentina, pero no la pregabalina, activa el canal de potasio dependiente de voltaje (KCNQ), lo que podría potenciar sus cualidades depresoras. A pesar de esto, los gabapentinoides imitan la actividad del GABA al inhibir la neurotransmisión. Los gabapentinoides impiden la llegada de los canales de calcio a la membrana celular e interrumpen las interacciones de α2δ con los receptores NMDA, los receptores AMPA, las neurexinas y las trombospondinas. Algunos bloqueadores de los canales de calcio de la clase de las dihidropiridinas se utilizan para la hipertensión y bloquean débilmente α2δ.
Los gabapentinoides tienen propiedades ansiolíticas, anticonvulsivas, antialodínicas, antinociceptivas y posiblemente relajantes musculares. La pregabalina y la gabapentina se utilizan en la epilepsia, principalmente en las crisis parciales (focales). Los gabapentinoides no son eficaces para las convulsiones generalizadas. También se utilizan para la neuralgia posherpética, el dolor neuropático asociado con la neuropatía diabética, la fibromialgia, el trastorno de ansiedad generalizada y el síndrome de piernas inquietas. La pregabalina y la gabapentina tienen muchos usos no autorizados, incluidos insomnio, abstinencia de alcohol y opioides, dejar de fumar, trastorno de ansiedad social, trastorno bipolar, trastorno por déficit de atención con hiperactividad, dolor crónico, sofocos, tinnutus, migrañas y más. El baclofeno se usa principalmente para el tratamiento de trastornos del movimiento espástico, especialmente en casos de lesión de la médula espinal, parálisis cerebral y esclerosis múltiple. Phenibut se utiliza en Rusia, Ucrania, Bielorrusia y Letonia para tratar la ansiedad y mejorar el sueño, como en el tratamiento del insomnio. También se utiliza para otras indicaciones, incluido el tratamiento de la astenia, la depresión, el alcoholismo, el síndrome de abstinencia de alcohol, el trastorno de estrés postraumático, la tartamudez, los tics, los trastornos vestibulares, la enfermedad de Ménière, los mareos, para la prevención del movimiento. enfermedades y para la prevención de la ansiedad antes o después de procedimientos quirúrgicos o pruebas de diagnóstico dolorosas. Phenibut, al igual que otros agonistas de GABA B, a veces los culturistas también lo utilizan para aumentar la hormona del crecimiento humano.
Reuters informó el 25 de marzo de 2010 que "Pfizer Inc violó una ley estadounidense contra el crimen organizado al promover indebidamente el medicamento para la epilepsia Neurontin (gabapentina). Según la Ley de organizaciones corruptas e influenciadas por mafiosos, la multa se triplica automáticamente, por lo que el hallazgo le costará a Pfizer 141 millones de dólares. El caso surge de una afirmación de Kaiser Foundation Health Plan Inc. de que "fueron engañados al creer que Neurontin era eficaz para el tratamiento no autorizado de migrañas, trastorno bipolar y otras afecciones". Pfizer argumentó que los médicos de Kaiser "todavía recomiendan el medicamento para esos usos", y que "el sitio web de la aseguradora también todavía incluye a Neurontin como un medicamento para el dolor neuropático".
En algunos casos, se abusa de los gabapentinoides y proporcionan efectos similares a los del alcohol, las benzodiazepinas y el ácido gamma-hidroxibutírico (GHB). La FDA colocó una advertencia de recuadro negro sobre Neurontin (gabapentina) y Lyrica (pregabalina) por problemas respiratorios graves. Mezclar gabapentinoides con opioides, benzodiazepinas, barbitúricos, GHB, alcohol o cualquier otro depresor es potencialmente mortal.
Los efectos secundarios comunes de los gabapentinoides incluyen somnolencia, mareos, debilidad, aumento del apetito, retención urinaria, dificultad para respirar, movimientos oculares involuntarios (nistagmo), problemas de memoria, movimientos espasmódicos incontrolables, alucinaciones auditivas, disfunción eréctil y convulsiones mioclónicas.
Una sobredosis de gabapentinoides generalmente consiste en somnolencia intensa, ataxia intensa, visión borrosa, dificultad para hablar, movimientos espasmódicos intensos e incontrolables y ansiedad. Como la mayoría de los anticonvulsivos, la pregabalina y la gabapentina tienen un mayor riesgo de pensamientos y conductas suicidas. Se sabe que los gabapentinoides, como todos los bloqueadores de los canales de calcio, causan angioedema. Tomarlos con un inhibidor de la ECA puede aumentar los efectos tóxicos de los gabapentinoides. También pueden mejorar el efecto de retención de líquidos de ciertos agentes antidiabéticos (tiazolidinedionas). No se sabe si causan agrandamiento gingival como otros bloqueadores de los canales de calcio. Los gabapentinoides se excretan por vía renal principalmente en su forma original. Los gabapentinoides pueden acumularse en el cuerpo cuando alguien tiene insuficiencia renal. Esto suele presentarse como mioclono y un estado mental alterado. No está claro si es seguro usar gabapentinoides durante el embarazo, y algunos estudios muestran daños potenciales.
Se produce dependencia física o fisiológica durante el uso prolongado de gabapentinoides. Después de una interrupción abrupta o rápida de pregabalina y gabapentina, las personas informan síntomas de abstinencia como insomnio, dolor de cabeza, náuseas, diarrea, síntomas similares a los de la gripe, ansiedad, depresión, dolor, hiperhidrosis, convulsiones, agitación psicomotora, confusión, desorientación y molestias gastrointestinales. La abstinencia aguda de baclofeno y fenibut también puede causar alucinaciones auditivas y visuales, así como psicosis aguda. La abstinencia de baclofeno puede ser más intensa si se administra por vía intratecal o durante períodos prolongados. Si se usa baclofeno o fenibut durante períodos prolongados, puede parecerse a una abstinencia intensa de benzodiazepinas, GHB o alcohol. Para minimizar los síntomas de abstinencia, el baclofeno o el fenibut se deben reducir gradualmente. La retirada brusca del fenibut o del baclofeno podría poner en peligro la vida debido a su mecanismo de acción. La abstinencia brusca puede provocar convulsiones de rebote y agitación intensa.
- Gabapentin (Neurontin)
- Gabapentin Enacarbil (Horizant, Regnite)
- Gabapentin Extended-Release (Gralise)
- Pregabalin (Lyrica)
- Phenibut (Anvifen, Fenibut, Noofen)
- Baclofen (Lioresal)
- Mirogabalin (Tarlige) (Sólo Japón)
No aprobado:
- Imagabalin
- Tolibut
- 4-Flurophenibut
- HSK16149
- Trans-4 y cis-4-[18F] fluorogabapentin (α2δ PET Imaging)
- 4-Methylpregabalin
- PD-217,014
- Atagabalin
- Arbaclofen
- Saclofen
Aminoácidos BCAA endógenos (no gabapentinoides), endógenos que se unen a α2δ):
- Calcio
- Isoleucine
- Leucine
- Valine
- Aspartate
Otros ligandos α2δ:
- Fenilalanina
- NP-118809
- Gababutin
- Ziconotide (Aprobado para el dolor)
- Ethanol
- Dextrothyroxine (Agonista de α2δ en lugar de inhibirlo)
- Ethioninie
- Suloctidil
- Terodiline
- Bepridil
Ácido gamma-hidroxibutírico
Ácido gamma-hidroxibutírico o "GHB" es un análogo de GABA que es un neurotransmisor natural y un fármaco depresor. También se encuentra de forma natural en pequeñas cantidades en algunas bebidas alcohólicas junto con el etanol. El GHB es la sustancia prototípica entre un par de moduladores del receptor de GHB.
El GHB se ha utilizado como anestésico general y como tratamiento para la cataplexia, la narcolepsia y el alcoholismo. La sal de sodio del GHB, el oxibato de sodio, se usa comúnmente hoy en día para la narcolepsia, la debilidad muscular repentina y la somnolencia diurna excesiva. Se vende bajo la marca Xyrem.
Como depresor, el GHB empeoraría la narcolepsia y la debilidad muscular. Pero en dosis bajas, el GHB afecta principalmente al receptor de GHB, un receptor excitador que libera dopamina y glutamato dando al GHB efectos estimulantes, lo opuesto a un depresor. Pero en grandes dosis, el GHB activa el receptor GABAB, un receptor inhibidor del sistema nervioso central, que domina los efectos excitadores, provocando así una depresión del sistema nervioso central. Algunos antipsicóticos son agonistas del receptor de GHB.
El GHB generalmente se puede encontrar en forma de sales de sodio, potasio, magnesio o calcio. Xywav es un medicamento que es una mezcla de todas las sales de GHB y se usa para tratar las mismas afecciones que Xyrem. Tanto Xywav como Xyrem están en la Lista III y tienen un recuadro negro de advertencia por sus efectos depresores del sistema nervioso central (hipoventilación y bradicardia) y por su alto potencial de abuso. La sobredosis de GHB es mortal con o sin mezclar otros depresores del SNC. La muerte por sobredosis de GHB suele ser causada por depresión respiratoria, convulsiones o coma.
El GHB se utiliza ilegalmente como intoxicante, afrodisíaco y para mejorar el rendimiento deportivo. Es una droga de discoteca popular en algunas partes del mundo debido a sus poderosos efectos afrodisíacos y eufóricos. Al igual que el fenibut y el baclofeno, los culturistas lo utilizan para aumentar la hormona del crecimiento humano debido a la activación de GABAB. También se ha informado que se ha utilizado como droga para violaciones en citas. Esto provocó que fuera una sustancia de Lista I en los Estados Unidos, Canadá y otros países. Xyrem, que es GHB en su forma de sodio, está en la Lista III en los Estados Unidos, Canadá y otros países.
En dosis bajas, el GHB se une principalmente al receptor de GHB y se une débilmente al receptor GABAB. El receptor de GHB es un receptor excitador acoplado a proteína G (GPCR). Su ligando endógeno es el GHB, ya que el GHB también es un neurotransmisor. También es un transportador de vitamina B2. La existencia de un receptor de GHB específico se predijo observando la acción del GHB y compuestos relacionados que actúan principalmente sobre el receptor GABAB, pero que también exhiben una variedad de efectos que no fueron producidos por el GABAB. actividad, por lo que se sospechaba que eran producidos por un receptor objetivo novedoso y en ese momento no identificado. En dosis más altas, las convulsiones son muy comunes. Se cree que esto está mediado por un aumento de la corriente de Na+/K+ y una mayor liberación de dopamina y glutamato. El GHB también puede provocar crisis de ausencia; Actualmente se desconoce el mecanismo, pero se cree que se debe a interacciones con el receptor GABAB. Se está investigando si el GHB endógeno es responsable de las convulsiones no convulsivas en humanos.
La abstinencia de GHB es muy intensa. La dependencia física se desarrolla rápidamente. También es muy adictivo psicológicamente. Comparte algunas similitudes con la retirada de gabapentinoides fenibut y baclofeno debido a la activación del receptor GABAB. Presenta un síndrome de abstinencia depresivo típico que imita la abstinencia de alcohol. Los síntomas incluyen delirio, temblor, ansiedad, taquicardia, insomnio, hipertensión, confusión, sudoración, agitación severa que puede requerir contención, alucinaciones auditivas y visuales y posiblemente muerte por convulsiones tónico-clónicas.[1]
El baclofeno y el fenibut son muy eficaces para la abstinencia y los pacientes los prefieren a las benzodiacepinas para el tratamiento de la abstinencia.
Moduladores del receptor de GHB:
Agonistas del receptor de GHB:
- Ácido gamma-hidroxibutíricoGHB)Xyrem)
- Oxibato de Calcio, Oxibato de Magnesio, Oxibato de Sodio (Xyrem), Oxibato de Potasio. Xywav es una mezcla de todas estas sales.
- Ácido 3-hidroxiciclopent-1-encarboxílico (Acido 3-hidroxiciclopente-1-enecarboxílico)HOCPCA)
- ácido γ-hidroxicrotónico, ácido trans-4-hidroxicrotónico (GHC, T-HCA)
- Amisulpride, Levosulpiride, Sulpiride, Sultopride Antipsicóticos ligandos de receptores GHB
- Ácido 3-ChloropropanoicoUMB66)
- Ácido 3-fenilpropyloxibutírico (Acido 3-fenilpropyloxibutírico)UMB72)
- Ácido 4-benciloxibutíricoUMB73)
- Ácido 4-hidroxi-4-naptilbutanoicoUMB86)
- 5-HydroxypentanoateUMB58)
- ácido gamma-(4-metoxibenzyl)-hidroxibutíricoNCS-435)
- 4-(4-chlorophenyl)-4-hidroxy-2-butanoic acid (NCS-356)
- Ácido 3-hidroxifenilacetico (acido)3-HPA)
- Catechin, Monastrol Moduladores alostericos positivos
Profármacos que se metabolizan en GHB:
- γ-Hydroxyvaleric acidGHV)
- gamma-Valerolactona, γ-Valerolactona (GVL) profármaco para GHV
- 1,4-Butanediol1,4-BD)
- 1,4-Acetato butanediolDABD)
- Ethyl acetoxy butanoate (Ethyl acetoxy butanoate)EAB)
- Ácido acebérico (Acido acebérico)Acetato GHB)
- gamma-Butyrolactone, γ-Butyrolactone ()GBL)
- 2-Furanone, γ-crotonolactone ()GCL)
- Gamma-Hydroxybutyraldehyde, γ-HydroxybutyraldehydeGHBAL)
- Gamma-Hydroxyvaleric acid, γ-Hydroxyvaleric acid (GHV)
Antagonistas del receptor de GHB:
- NCS-382
- Gabazine
Algunos moduladores de los receptores de GHB solo se unen al receptor de GHB, mientras que otros se unen tanto a los receptores de GHB como a los de GABAB
No benzodiazepinas
Las no benzodiazepinas, a veces denominadas fármacos Z, son una clase de depresores hipnóticos que se utilizan principalmente para tratar el insomnio y, a veces, la ansiedad.[2] Están estructuralmente relacionados con las benzodiazepinas. Modulan positivamente el sitio de las benzodiazepinas del receptor GABAA, el principal receptor inhibidor del sistema nervioso central, al igual que las benzodiazepinas, pero a nivel molecular no están relacionados estructuralmente.
Las no benzodiazepinas se unen a las benzodiazepinas del sitio del receptor GABAA para mantener abierto el canal de cloruro. Esto hace que el cloruro del área intercelular inunde la neurona. Dado que el cloruro tiene carga negativa, hace que la neurona descanse y deje de disparar. Esto produce un efecto relajante y depresivo en el sistema nervioso central.
Las sustancias no benzodiazepinas comunes, como el zolpidem y la zopiclona, son extremadamente efectivas para el insomnio, pero conllevan muchos riesgos y efectos secundarios. Las pastillas para dormir, incluida la zopiclona, se han asociado con un mayor riesgo de muerte.
Reacciones adversas como las siguientes: "alteración del gusto (algunos informan un sabor metálico); con menos frecuencia náuseas, vómitos, mareos, somnolencia, sequedad de boca, dolor de cabeza; raramente amnesia, confusión, depresión, alucinaciones, pesadillas; muy raramente también se informaron mareos, falta de coordinación, efectos paradójicos y sonambulismo. Algunos usuarios de medicamentos no benzodiacepínicos han caminado sonámbulos y han cometido asesinatos o han estado involucrados en accidentes automovilísticos. A diferencia de las benzodiazepinas, las no benzodiazepinas tienen riesgo de sufrir alucinaciones y sonambulismo. Al igual que las benzodiazepinas, pueden provocar amnesia anterógrada.
Las sustancias no benzodiazepinas no se deben suspender abruptamente si se toman durante más de unas pocas semanas debido al riesgo de efectos de rebote y reacciones agudas de abstinencia, que pueden parecerse a las observadas durante la abstinencia de benzodiazepinas. El tratamiento generalmente implica reducir gradualmente la dosis durante un período de semanas o varios meses, según el individuo, la dosis y el tiempo que se ha tomado el medicamento. Si este enfoque falla, se puede intentar un cambio a una dosis equivalente de benzodiazepina de una benzodiazepina de acción prolongada (como clordiazepóxido o más preferiblemente diazepam) seguido de una reducción gradual de la dosis. En casos extremos y, en particular, cuando se manifiesta una adicción y/o abuso grave, puede ser necesaria una desintoxicación hospitalaria, con flumazenil como posible herramienta de desintoxicación.
Opioides/Opiáceos
opioides son sustancias que actúan sobre los receptores opioides para reducir el dolor. Médicamente se utilizan principalmente para aliviar el dolor, incluida la anestesia. Los opioides también causan euforia y se abusa mucho de ellos.
Opioides y opiáceos no son lo mismo. Los opiáceos se refieren a opioides naturales como la morfina y la codeína. Los opioides se refieren a todos los opioides naturales, semisintéticos y sintéticos, como la heroína y la oxicodona.
Contrariamente a la idea errónea popular, los opioides no son depresivos en el sentido clásico. Producen depresión del sistema nervioso central, pero también excitan ciertas áreas del sistema nervioso central. Para permanecer fiel al término 'depresivo' – los opioides no pueden clasificarse como tales. Los agonistas opioides y los derivados del opio se clasifican de forma diferente. analgésico o narcótico identifica correctamente estos fármacos. Sin embargo, tienen acciones depresoras.
Existen tres clases principales de receptores opioides, μ, κ, δ (mu, kappa y delta), aunque se han informado hasta diecisiete, e incluyen los ε, ι, λ y ζ (Epsilon, Iota, Receptores Lambda y Zeta). Por el contrario, los receptores σ (Sigma) ya no se consideran receptores opioides porque su activación no es revertida por el agonista inverso opioide naloxona. El receptor peptídico opioide de nocicepción (NOP) (ORL1) es un receptor opioide que participa en las respuestas al dolor, la ansiedad, el movimiento, la recompensa, el hambre, la memoria y mucho más. Desempeña un papel importante en el desarrollo de la tolerancia a los agonistas opioides μ.
Cuando el "dolor" ocurre, se envía una señal desde el lugar de la posible lesión. Esta señal sube por la médula espinal hasta el cerebro, donde se percibe como una emoción negativa conocida como nocicepción o "dolor". En el sistema nervioso central, la columna está conectada al cerebro por una estructura llamada tronco encefálico. El tronco del encéfalo es la primera parte del cerebro que se desarrolla en un mamífero a partir de la cresta neural. También es la parte más antigua del cerebro y controla muchas funciones automáticas como la conciencia, la respiración, el ritmo cardíaco, la digestión y muchas más. Los receptores opioides son receptores especializados que bloquean el dolor. Se unen a una amplia gama de hormonas, péptidos y mucho más. Aunque se encuentran en todas partes del sistema nervioso central, están muy concentrados en el tronco del encéfalo. Dependiendo del receptor, su activación tiene la capacidad de evitar que el dolor llegue al cerebro y se perciba como dolor. Por lo tanto, los opioides en realidad no "detienen" dolor; simplemente le impiden saber que está sufriendo. El dolor y la capacidad de modificarlo en función del entorno de un organismo es una ventaja evolutiva y se ha demostrado que puede ayudar a un organismo a escapar y sobrevivir a determinadas situaciones en las que, de otro modo, quedaría inmovilizado debido al dolor y las lesiones. El cerebro medio núcleo del tronco encefálico, con estructuras como la sustancia gris periacueductal, la formación reticular y el núcleo tegmental rostromedial, son responsables de la mayoría de los efectos físicos y psicológicos de las enfermedades endógenas. y opioides exógenos.
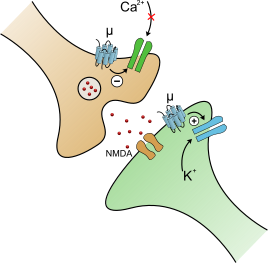
El receptor opioide μ es el responsable de los efectos analgésicos, eufóricos y adversos de los opioides. El receptor opioide μ es un receptor acoplado a proteína G. Cuando se activa el receptor opioide μ, provoca alivio del dolor, euforia, estreñimiento, pupilas contraídas, picazón y náuseas.[3] El opioide μ se encuentra en el tracto gastrointestinal y controla la peristalsis. Esto provoca estreñimiento, que puede ser extremadamente problemático y angustioso. La activación de este receptor también provoca la relajación de los músculos voluntarios e involuntarios, lo que puede provocar efectos secundarios como dificultad para orinar y tragar. El receptor opioide μ también puede reducir los andrógenos, disminuyendo así la libido y la función sexual. También se sabe que el receptor causa "anhedonia musical".
El receptor juega un papel crítico en la alimentación. La palatabilidad de los alimentos está determinada por procesos relacionados con los receptores opioides en el núcleo accumbens y el pálido ventral. Los procesos opioides involucran a los receptores opioides mu y están presentes en la capa rostromedial del núcleo accumbens en sus neuronas espinosas. Esta área ha sido llamada el "sitio de consumo de opioides".
El receptor opioide μ tiene muchos ligandos endógenos, incluida la endorfina.
A corto plazo
- Itching
- Nausea
- Vomiting
- Estreñimiento
- Miosis
- Drowsiness
- Boca seca
Otros
- Efectos cognitivos
- Opioides
- Mareos
- Pérdida del apetito
- Vaciado gástrico retrasado
- Disminución de la unidad sexual
- Función sexual con deficiencias
- Menores de testosterona
- Depresión
- Inmunodeficiencia
- Aumento de la sensibilidad del dolor
- Menstruación irregular
- Aumento del riesgo de caídas
- Respiración lenta
- Coma
El receptor Kappa (KOR) es un receptor acoplado a proteína G ubicado en el sistema nervioso central. KOR también es un receptor acoplado a proteína G. Los humanos y algunos otros primates tienen una mayor densidad de receptores kappa que la mayoría de los demás animales. KOR es responsable de la nocicepción, la conciencia, el control motor y el estado de ánimo. La desregulación de este sistema receptor se ha relacionado con la adicción al alcohol y las drogas.[4] El ligando endógeno de KOR es la dinorfina. La activación de KOR suele provocar disforia; de ahí el nombre dinorfina. La planta intoxicante, Salvia divinorum, contiene salvinorina A, un alcaloide que es un agonista potente y selectivo del receptor κ-opioide (opioide kappa). Esto provoca poderosas alucinaciones. Antagonizar el receptor opioide κ (opioide kappa) puede tratar la depresión, la ansiedad, el estrés, la adicción y el alcoholismo.
El tercer receptor es el receptor δ-opioide (DOR). El receptor delta es el menos estudiado de los 3 receptores opioides principales. Es un receptor acoplado a proteína G y su ligando endógeno es la deltorfina. La activación del receptor δ-opioide (DOR) puede tener efectos antidepresivos. Los agonistas δ-opioides pueden producir depresión respiratoria en dosis muy altas; en dosis más bajas, tienen el efecto contrario. Las dosis altas de un agonista opioide δ pueden provocar convulsiones, aunque no todos los agonistas delta producen este efecto. La activación del receptor delta suele ser estimulante en lugar de sedante como la mayoría de los opioides.
El receptor de nocicepción participa en la regulación de numerosas actividades cerebrales, en particular las conductas emocionales instintivas y el dolor. (NOP) es un receptor acoplado a proteína G. El receptor de nocicepción controla una amplia gama de funciones biológicas que incluyen la nocicepción, la ingesta de alimentos, los procesos de memoria, las funciones cardiovasculares y renales, la actividad locomotora espontánea, la motilidad gastrointestinal, la ansiedad y el control de la liberación de neurotransmisores en sitios periféricos y centrales.
Una sobredosis de opioides es mortal.[5] Una persona que sufre una sobredosis de opioides/opiáceos presenta depresión respiratoria, una afección letal que puede causar hipoxia por una respiración lenta y superficial.[6] Mezclar opioides con otro depresor como benzodiazepinas o alcohol aumenta la posibilidad de sufrir una sobredosis y depresión respiratoria. La sobredosis de opioides provoca una disminución del nivel de conciencia, pupilas puntiagudas y depresión respiratoria. Otros síntomas incluyen convulsiones y espasmos musculares. Los opioides activan los receptores opioides μ en regiones específicas del sistema nervioso central asociadas con la regulación respiratoria. Activan los receptores opioides μ en la médula y la protuberancia. Están ubicados en el tronco del encéfalo y se conectan con la columna. Esta área tiene una alta densidad de receptores opioides μ, ya que bloquean el dolor que sube desde la columna hasta el cerebro. Estas áreas son las partes más antiguas y primitivas del cerebro. Controlan funciones automáticas como la respiración y la digestión. Los opioides detienen este proceso y provocan depresión respiratoria y estreñimiento. El tronco del encéfalo ya no detecta dióxido de carbono en la sangre, por lo que no inicia el reflejo de inhalación, lo que suele provocar hipoxia. Sin embargo, algunas víctimas de sobredosis mueren por insuficiencia cardiovascular o asfixia por ahogarse con el vómito.
La naloxona es un antagonista del receptor opioide μ, lo que significa que en lugar de activar el receptor opioide μ, interrumpe el funcionamiento del receptor. Dado que la naloxona es potente y altamente selectiva para el receptor opioide μ, puede eliminar opioides potentes como el fentanilo del receptor y bloquear la unión de otro ligando al receptor, deteniendo así una sobredosis. Una persona dependiente de opioides puede sufrir una abstinencia precipitada cuando se usa naloxona. Dado que la naloxona bloquea la unión de cualquier opioide endógeno o exógeno al receptor opioide μ. Esto puede hacer que una persona sufra síntomas de abstinencia inmediatamente después de usar naloxona. Esto puede provocar síntomas de abstinencia como sudores fríos y diarrea.
Los opioides activan los receptores opioides μ en el núcleo tegmental rostromedial (RMTg). El núcleo tegmental rostromedial es un núcleo GABAérgico que funciona como un "freno maestro" para el sistema de dopamina del mesencéfalo. El RMTg posee vínculos funcionales y estructurales sólidos con las vías de la dopamina. Los opioides disminuyen la liberación de GABA, desinhibiendo así el freno GABAérgico de las redes de dopamina. GABA es un neurotransmisor inhibidor, lo que significa que bloquea o disminuye el potencial de activación de una neurona. Esto provoca que se liberen grandes cantidades de dopamina, ya que GABA ya no la bloquea. La desinhibición de GABA puede ser responsable de provocar convulsiones, un efecto adverso poco común de los opioides. La desinhibición GABAérgica es también la razón por la que los opioides no se consideran verdaderos "depresores". Esta excitación de las vías dopaminérgicas provoca la euforia de los opioides. Esto provoca importantes efectos de refuerzo positivos en el cerebro, indicándole que lo haga de nuevo. El RMTg también es responsable del desarrollo de la tolerancia y la adicción. Los psicoestimulantes también excitan esta vía.
El fentanilo suele mezclarse con otras sustancias que se venden en la calle.[7] El fentanilo se utiliza para aumentar la potencia de las sustancias, lo que hace que el usuario gaste más dinero en la sustancia mezclada. La codeína es un opiáceo natural más débil que generalmente se usa para la bronquitis, la diarrea y el dolor posoperatorio. Es muy fácil sufrir una sobredosis de estas sustancias, especialmente si no se tiene tolerancia. Se recomienda hacerse una prueba de medicamentos y llevar naloxona.
Opiáceos naturales (Papaver somniferum, opio)
- MorfinaMS Contin)
- Codeine (Código)Tylenol No. 3)
- PapaverinePavabid)
- NoscapinaNarcotine)
- Thebaine
- Oripavine
- Narceine
Opioides morfinanos semisintéticos:
- OxycodoneOxyContin)
- HeroínaDiamorfina)
- HidrocodonaVicodin)
- OxymorphoneOpana)
- HidromorfófonoDilaudid)
- BuprenorfinaSuboxone)
- NaloxoneNarcan)
Los opioides semisintéticos se derivan del alcaloide natural tebaína.
Opioides totalmente sintéticos:
- Fentanyl (Fentanyl)Duragesic)
- Tramadol (Tramadol)Ultram)
- MetadonaDolophine)
- Pethidine (en inglés)Demerol)
- KetobemidoneKetogan)
- PentazocinaTalwin)
- CarfentanilWildnil)
- Loperamida (Loperamida)Imodium)
- Dextropropoxyphene (Dextropropoxyphene)Darvocet)
- TapentadolNucynta)
- Dextropropoxyphene (Dextropropoxyphene)Darvocet)
Otros:
Mitragyna speciosa (Kratom) Alcaloide indol
Did you mean:Piperidinedione

Las piperidinedionas son una clase de depresores que ya no se utilizan. Hay piperidinedionas que se utilizan para otros fines, como el cáncer de mama.[8][9][10]. La clase Piperidinediona es muy similar estructuralmente a los barbitúricos. Algunas piperidinedionas incluyen glutetimida, metilprilon, piritildiona, glutarimida y aminoglutetimida. Los primeros 3 (glutetimida, metilprilon y piritildiona) son depresores del sistema nervioso central. Los depresores de la piperidinediona, específicamente la glutetimida, son moduladores positivos del canal aniónico GABAA. El fármaco aumenta el tono GABAérgico inhibidor y provoca una neuroinhibición de los sistemas cortical y límbico, que se observa clínicamente como un efecto sedante-hipnótico.[11] La glutetimida también es un potente inhibidor de la enzima CYP 2D6 en el hígado. Esta enzima es responsable de convertir muchos fármacos, desde betabloqueantes hasta antidepresivos, pasando por opioides y opiáceos. Debido a sus efectos sobre la conversión de opioides, se abusaba mucho de ella y se mezclaba con opioides como la codeína. La codeína debe metabolizarse a morfina en el hígado para que tenga sus efectos psicoactivos y analgésicos. La mezcla de codeína con piperidinediona glutetimida permitió que el cuerpo convirtiera más codeína en morfina; aumentando así su efecto. Estos eran conocidos como "hits", "cibas y codeína" y "dors y 4s". Se creía que la glutetimida era más segura que los barbitúricos, pero muchas personas morían a causa de la droga. La demanda fue alta en los Estados Unidos en un momento. La producción de glutetimida se interrumpió en Estados Unidos en 1993 y en varios países de Europa del Este, sobre todo en Hungría, en 2006.
La abstinencia de glutetimida es intensa y se asemeja a la abstinencia de barbitúricos. Presenta alucinaciones y delirios típicos de una abstinencia depresiva. En la década de 1970, hubo informes de abstinencia neonatal de glutetimida. Los bebés nacidos de madres adictas a la glutetimida respondieron bien inicialmente, luego presentaron recurrencia de los síntomas aproximadamente 5 días después, incluyendo hiperactividad, inquietud, temblores, hiperreflexia, hipotonía, inestabilidad vasomotora, llanto incesante e irritabilidad general.
La abstinencia de glutetimida provocó agitación severa, temblores y convulsiones que podrían ser fatales.
La sobredosis provoca estupor o coma y depresión respiratoria.
- MethyprylonDimerin, Methyprylone, Noctan, Noludar)
- Pyrithyldione (Pyrithyldione)Presidon, Piridión, Piridiona, Piritildiona)
- PiperidionaAscron, Dihyprylon, Dihyprylone, Sedulon, Tusseval) (Retirada antes de la aprobación)
- Glutethimide (Glutethimide)Doriden)
Quinazolinona
Las quinazolinonas son una clase de depresores que ya rara vez se utilizan. Las quinazolinonas tienen potentes efectos sedantes, hipnóticos y ansiolíticos. La estructura de la quinazolinona es muy similar a la de algunos antibióticos. El principal mecanismo de acción de la quinazolinona es la unión al receptor GABAA. No se une al sitio del etanol, barbitúrico, neuroesteroide o benzodiazepina. En cambio, se une a un sitio directamente entre las proteínas GABRB2 (β2) y (α1) GABRA1 en el receptor GABAA. El anestésico etomidato y el anticonvulsivo loreclezol también pueden unirse a este sitio.
La sobredosis de quinazolinona a veces causa efectos opuestos a la sedación similar a la quinazolinona. La sobredosis consiste en hiperreflexia, vómitos, insuficiencia renal, delirio, hipertonía, coma, espasmos mioclónicos, somnolencia, euforia, hiperactividad muscular, delirio agitado, taquicardia y convulsiones tónico-clónicas. En 1982, 2.764 personas visitaron las salas de emergencia de Estados Unidos por sobredosis de quinazolinonas, específicamente metacualona. Mezclar quinazolinas con otro depresor es posiblemente fatal. La muerte por sobredosis de quinazolinona suele ser causada por un paro cardíaco o respiratorio. La sobredosis se parece a la sobredosis de barbitúricos/carbamatos.
La abstinencia de quinazolinona ocurre cuando alguien que se ha vuelto dependiente de una quinazolinona deja de usarla. La abstinencia de quinazolinona se asemeja a la abstinencia de etanol, barbitúricos, benzodiazepinas y carbamatos. Suele consistir en inquietud, náuseas y vómitos, disminución del apetito, taquicardia, insomnio, temblores, alucinaciones, delirio, confusión y convulsiones; y, que posiblemente sean fatales: respuesta fotoparoxística EEG, espasmos mioclónicos, fiebre, espasmos musculares e irritabilidad.
El clorhidrato de metacualona, los ansiolíticos y los hipnóticos de quinazolinona se conocen como "quaaludes", "ludes" y "galletas de discoteca". La metacualona fue objeto de abuso con mucha frecuencia en el mundo occidental durante las décadas de 1960 y 1970. La metacualona se recetaba principalmente para el insomnio, ya que se pensaba que era más segura que los barbitúricos y los carbamatos.[12] Muchos, incluidas celebridades, abusaron mucho de la metacualona después de su introducción en 1965. La metacualona fue sintetizada por primera vez en la India en 1951 por Indra Kishore Kacker y Syed Husain Zaheer, que estaban realizando una investigación para encontrar nuevos medicamentos contra la malaria. El nombre del medicamento "Quaalude" (Metacualona) es un acrónimo que combina las palabras "interludio tranquilo". La metacualona se suspendió en los Estados Unidos en 1985, principalmente debido a su carácter adictivo psicológico, su abuso generalizado y su uso recreativo ilegal. En la actualidad, se utilizan benzodiazepinas y no benzodiazepinas para tratar el insomnio. La metacualona es ahora una sustancia de la Lista I. Algunos análogos de quinazolinona todavía se venden en línea. Vienen con el riesgo de convulsiones.
Grandes dosis de metacualona pueden causar euforia, desinhibición, aumento de la sexualidad, sociabilidad, relajación muscular, ansiolisis y sedación. Hoy en día, en Sudáfrica se abusa ampliamente de la metacualona. Muchas celebridades han usado quinazolinona, sobre todo metacualona. Bill Cosby admitió haber tenido relaciones sexuales ocasionales con el uso recreativo de metacualona (Quaaludes). La actriz Anissa Jones murió a los 18 años por una sobredosis de cocaína, PCP, metacualona y el barbitúrico Seconal. Billy Murcia, baterista de la banda de rock New York Dolls, murió a los 21 años cuando se ahogó en una bañera por una sobredosis de heroína y metacualona.
La clorocualona era una quinazolinona que se unía al receptor GABAA y sigma-1. Tenía efectos supresores de la tos útiles y efectos sedantes más débiles que la metacualona, pero finalmente se retiró debido a su potencial de abuso y sobredosis.
La diprocualona es una quinazolinona que todavía se utiliza en la actualidad. La diprocualona tiene propiedades sedantes, ansiolíticas, antihistamínicas y analgésicas, resultantes de su actividad agonista en el subtipo β del receptor GABAa, actividad antagonista en todos los receptores de histamina, inhibición de la enzima ciclooxigenasa-1 y posiblemente su actividad agonista tanto en el receptor Sigma-1 como en el receptor Sigma-2. La diprocualona se utiliza principalmente para el tratamiento del dolor inflamatorio asociado con la osteoartritis y la artritis reumatoide; se utiliza con menos frecuencia para tratar el insomnio, la ansiedad y la neuralgia. La diprocualona es el único análogo de la metacualona que todavía tiene un uso clínico generalizado debido a sus útiles efectos antiinflamatorios y analgésicos junto con las acciones sedantes y ansiolíticas comunes a otros fármacos de esta clase. Todavía existen algunas preocupaciones sobre el potencial de abuso y sobredosis de la diprocualona; no se vende como medicamento puro sino como sal de canfosulfonato en mezclas con otros medicamentos como la etenzamida.
La etacualona es un depresor del tipo quinazolinona. Tiene propiedades sedantes, hipnóticas, relajantes musculares y depresoras del sistema nervioso central. Se abusaba mucho de él y había un alto riesgo de sobredosis. Los usuarios inhalarían o fumarían la sal de clorhidrato de etacualona de base libre.
La metilmetacualona es un análogo de la metacualona con efectos hipnóticos y sedantes similares. La metilmetacualona se diferencia de la metacualona por la 4-metilación en el anillo de fenilo. Produce convulsiones sólo ligeramente por encima de la dosis sedante eficaz. Parece que este compuesto se vendió en el mercado negro de Alemania como droga de diseño análoga a la metacualona.
La nitrometacualona es un depresor de quinazolinona con diez veces más efectos hipnóticos y sedantes que la metacualona.
Quinazolinonas:
- Alfoqualone (Alfoqualone)Arofuto)
- Cloroqualone
- Diproqualone
- Etaqualone (Etaqualone)Aolan, Athinazone, Ethinazone)
- Mebroqualone (Mebroqualone)MBQ)
- Mecloqualone (Mecloqualone)Nubarene, Casfen)
- MethaqualoneQuaalude, Sopor, Mandrax)
- Metilmethaqualone
- Nitromethaqualone
- SL-164 (Dicloqualone, DCQ)
Varios
- Bloqueadores de alfa y beta (carvedilol, propranolol, atenolol, etc.)
- Anticolinergicos (atropina, hyoscyamina, escoolamina, etc.)
- Anticonvulsivos (topiramato, carbamazepina, lamotrigina, etc.)
- Antihistamínicos (difenhidramina, doxilamina, promethazina, etc.)
- Antipsicóticos (haloperidol, clorpromazina, clozapina, etc.)
- Hipnotics (zolpidem, zopiclona, hidrato de cloro, eszopiclona, etc.)
- Relajadores musculares (baclofen, phenibut, carisoprodol, cyclobenzaprine, etc.)
- Sedativos (hidroxibutirato-gamma, etc.)
Métodos de ingesta
La combinación de múltiples depresores puede ser muy peligrosa porque se ha propuesto que las propiedades depresivas del sistema nervioso central aumentan exponencialmente en lugar de linealmente. Esta característica hace que los depresores sean una opción común en caso de sobredosis deliberadas en caso de suicidio. El consumo de alcohol o benzodiazepinas junto con la dosis habitual de heroína es a menudo la causa de muerte por sobredosis en adictos a opiáceos.
Contenido relacionado
Colfax (pueblo), Wisconsin
Úlcera bucal
Acromion