Deficiencia de glucosa-6-fosfato deshidrogenasa
Deficiencia de glucosa-6-fosfato deshidrogenasa (G6PDD), que es la deficiencia enzimática más común en todo el mundo, es un error innato del metabolismo que predispone a la degradación de los glóbulos rojos.. La mayoría de las veces, los afectados no presentan síntomas. Después de un desencadenante específico, pueden aparecer síntomas como piel amarillenta, orina oscura, dificultad para respirar y sensación de cansancio. Las complicaciones pueden incluir anemia e ictericia neonatal. Algunas personas nunca presentan síntomas.
Es un trastorno recesivo ligado al cromosoma X que produce una enzima glucosa-6-fosfato deshidrogenasa defectuosa. La glucosa-6-fosfato deshidrogenasa es una enzima que protege los glóbulos rojos, que transportan oxígeno desde los pulmones a los tejidos de todo el cuerpo. Un defecto de la enzima provoca la degradación prematura de los glóbulos rojos. Esta destrucción de los glóbulos rojos se llama hemólisis. La degradación de los glóbulos rojos puede ser provocada por infecciones, ciertos medicamentos, estrés o alimentos como las habas. Dependiendo de la mutación específica, la gravedad de la afección puede variar. El diagnóstico se basa en los síntomas y se apoya en análisis de sangre y pruebas genéticas.
Las personas afectadas deben evitar los desencadenantes dietéticos, en particular las habas. Esto puede resultar difícil, ya que las habas pueden denominarse "habas" y se utilizan en muchos alimentos, enteros o como harina. El falafel es probablemente el más conocido, pero las habas también se suelen utilizar como relleno en albóndigas y otros alimentos. Dado que la deficiencia de G6PD no es una alergia, las regulaciones alimentarias en la mayoría de los países no exigen que las habas se destaquen como alérgeno en la etiqueta.
El tratamiento de los episodios agudos puede incluir medicamentos para la infección, suspender el medicamento causante o transfusiones de sangre. La ictericia en recién nacidos se puede tratar con bililights. Se recomienda que las personas se hagan una prueba de G6PDD antes de tomar ciertos medicamentos, como la primaquina.
Alrededor de 400 millones de personas padecen esta afección en todo el mundo. Es particularmente común en ciertas partes de África, Asia, el Mediterráneo y Medio Oriente. Los hombres se ven afectados con más frecuencia que las mujeres. Se cree que en 2015 provocó 33.000 muertes.
Signos y síntomas
La mayoría de las personas con deficiencia de G6PD son asintomáticas.
La mayoría de las personas que desarrollan síntomas son hombres, debido al patrón de herencia ligado al cromosoma X, pero las mujeres portadoras pueden verse afectadas debido a una lionización desfavorable o una inactivación sesgada del cromosoma X, donde la inactivación aleatoria de un cromosoma X en ciertas células crea una población de glóbulos rojos deficientes en G6PD que coexisten con glóbulos rojos no afectados. Una mujer con un cromosoma X afectado mostrará la deficiencia en aproximadamente la mitad de sus glóbulos rojos. Sin embargo, en algunos casos, incluida la deficiencia de doble X, la proporción puede ser mucho más de la mitad, lo que hace que el individuo sea casi tan sensible como los hombres.
La descomposición de los glóbulos rojos (también conocida como hemólisis) en la deficiencia de G6PD puede manifestarse de varias maneras, incluidas las siguientes:
- ictericia neonatal prolongada, posiblemente conduciendo a kernicterus (arguiblemente la complicación más grave de la deficiencia de G6PD)
- Crisis hemolíticas en respuesta a:
- Enfermedad (especialmente infecciones)
- Ciertos medicamentos (véase infra)
- Ciertos alimentos, sobre todo grandes frijoles, de los cuales la palabra favism derivas
- Ciertas sustancias químicas
- Cetoacidosis diabética
- Hemoglobinuria (orina roja o marrón)
- La crisis muy grave puede causar lesión renal aguda
favismo es una respuesta hemolítica al consumo de habas, también conocidas como habas. Aunque todos los individuos con favismo muestran deficiencia de G6PD, no todos los individuos con deficiencia de G6PD muestran favismo. Se sabe que la afección es más frecuente en bebés y niños, y la variante genética G6PD puede influir en la sensibilidad química. Aparte de esto, los detalles de la relación química entre el favismo y el G6PD no se comprenden bien.
Causa
La deficiencia de G6PD es el resultado de mutaciones en el gen G6PD. El gen G6PD contribuye a la producción de glucosa-6-fosfato deshidrogenasa. Las reacciones químicas que involucran la glucosa-6-fosfato deshidrogenasa producen compuestos que evitan que las especies reactivas de oxígeno se acumulen hasta niveles tóxicos dentro de los glóbulos rojos. Si se produce una reducción en la cantidad de glucosa-6-fosfato deshidrogenasa o una alteración de la estructura debido a mutaciones en el gen G6PD, la enzima pierde su función protectora y conduce a la acumulación de especies reactivas de oxígeno y, por tanto, al daño de los glóbulos rojos.
Desencadenantes
Los portadores de la mutación subyacente no muestran ningún síntoma a menos que sus glóbulos rojos estén expuestos a ciertos desencadenantes, que pueden ser de cuatro tipos principales:
- Foods (fava frijoles es el desencadenante distintivo para los portadores de mutación G6PD),
- Ciertos medicamentos incluyendo aspirina, quinina y otros antimalariales derivados de la quinina.
- Bolas de polilla (naftalina)
- Estrés de una infección bacteriana o viral.
Drogas
Muchas sustancias son potencialmente dañinas para las personas con deficiencia de G6PD. La variación en la respuesta a estas sustancias dificulta las predicciones individuales. Los medicamentos antipalúdicos que pueden causar hemólisis aguda en personas con deficiencia de G6PD incluyen primaquina, pamaquina, cloroquina e hidroxicloroquina. Hay pruebas de que otros antipalúdicos también pueden exacerbar la deficiencia de G6PD, pero sólo en dosis más altas. Las personas con deficiencia de G6PD también deben evitar las sulfonamidas (como sulfanilamida, sulfametoxazol y mafenida), tiazolsulfona, azul de metileno y naftaleno, ya que antagonizan la síntesis de folato, al igual que ciertos analgésicos (como fenazopiridina y acetanilida) y algunos no medicamentos. antibióticos sulfa (ácido nalidíxico, nitrofurantoína, isoniazida, dapsona y furazolidona). Se sabe que la henna causa crisis hemolítica en bebés con deficiencia de G6PD. La rasburicasa también está contraindicada en la deficiencia de G6PD. También se sabe que altas dosis de vitamina C intravenosa causan hemólisis en portadores de deficiencia de G6PD; por lo tanto, la prueba de deficiencia de G6PD es de rutina antes de la infusión de dosis de 25 go más.
Genética
Dos variantes (G6PD A− y G6PD mediterránea) son las más comunes en las poblaciones humanas. El G6PD A− ocurre en el 10% de los africanos y afroamericanos, mientras que el G6PD Mediterráneo prevalece en el Medio Oriente. La distribución conocida del alelo mutado se limita en gran medida a personas de origen mediterráneo (españoles, italianos, griegos, armenios, judíos sefardíes y otros pueblos semíticos). Se cree que ambas variantes se derivan de un fuerte efecto protector contra la malaria Plasmodium falciparum y Plasmodium vivax. Es particularmente frecuente en la población judía kurda, donde aproximadamente 1 de cada 2 hombres padece la afección y la misma tasa de mujeres son portadoras. También es común en hombres afroamericanos, árabes sauditas, sardos, algunas poblaciones africanas y grupos asiáticos.
Todas las mutaciones que causan la deficiencia de G6PD se encuentran en el brazo largo del cromosoma X, en la banda Xq28. El gen G6PD abarca unas 18,5 kilobases. Son bien conocidas y descritas las siguientes variantes y mutaciones:
| Mutación | Gene | Proteína | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Designación | Nombre corto | Isoform G6PD-Protein | OMIM-Code | Tipo | Subtipo | Posición | Posición | Cambio de estructura | Cambio de función |
| G6PD-A(+) | Gd-A(+) | G6PD A | +305900.0001 | nucleótido de polimorfismo | A→G | 376 (Exón 5) | 126 | Asparagine→Acido aspartico (ASN126ASP) | Sin defecto de enzimas (variante) |
| G6PD-A(-) | Gd-A(-) | G6PD A | +305900.0002 | nucleótido de sustitución | G→A | 376 (Exón 5) y 202 | 68 y 126 | Valine→Metionina (VAL68MET) Asparagine→Acido aspartico (ASN126ASP) | |
| G6PD-Mediterranean | Gd-Med | G6PD B | +305900.0006 | nucleótido de sustitución | C→T | 563 (Exón 6) | 188 | Serine→Phenylalanine (SER188PHE) | Clase II |
| G6PD-Canton | Gd-Canton | G6PD B | +305900.0021 | nucleótido de sustitución | G→T | 1376 | 459 | Arginine→Leucine (ARG459LEU) | Clase II |
| G6PD-Chatham | Gd-Chatham | G6PD | +305900.0003 | nucleótido de sustitución | G→A | 1003 | 335 | Alanine→Threonine (ALA335THR) | Clase II |
| G6PD-Cosenza | Gd-Cosenza | G6PD B | +305900.0059 | nucleótido de sustitución | G→C | 1376 | 459 | Arginine→Proline (ARG459PRO) | G6PD-actividad = 10%, por lo tanto alta parte de los pacientes. |
| G6PD-Mahidol | Gd-Mahidol | G6PD | +305900.0005 | nucleótido de sustitución | G→A | 487 (Exón 6) | 163 | Glycine→Serine (GLY163SER) | Clase III |
| G6PD-Orissa | Gd-Orissa | G6PD | +305900.0047 | nucleótido de sustitución | C→G | 131 | 44 | Alanine→Glycine (ALA44GLY) | Un lugar de unión de PNA afectado. Mayor estabilidad que otras variantes. |
| G6PD-Asahi | Gd-Asahi | G6PD A- | +305900.0054 | nucleótido de sustitución (several) | A→G ± G→A | 376 (Exón 5) 202 | 126 68 | Asparagine→Acido aspartico (ASN126ASP) Valine→Metionina (VAL68MET) | Clase III. |
Fisiopatología
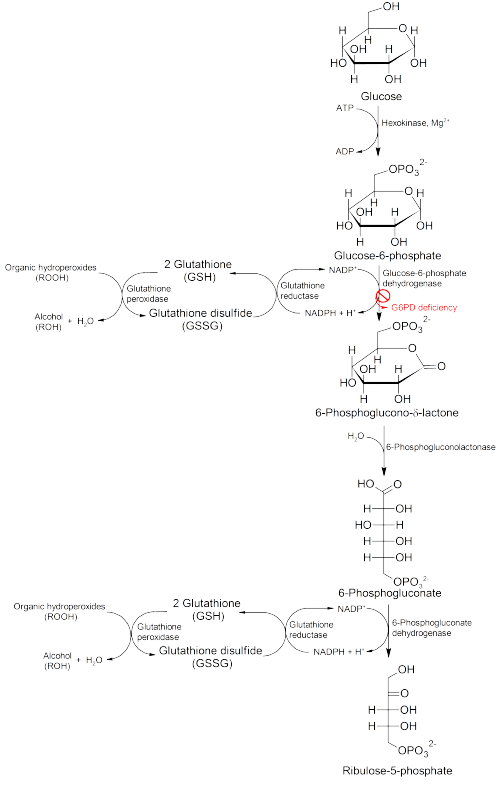
La glucosa-6-fosfato deshidrogenasa (G6PD) es una enzima en la vía de las pentosas fosfato (ver imagen, también conocida como vía de derivación HMP). G6PD convierte la glucosa-6-fosfato en 6-fosfoglucono-δ-lactona y es la enzima limitante de esta vía metabólica que suministra energía reductora a las células manteniendo el nivel de la forma reducida de la coenzima nicotinamida adenina dinucleótido fosfato (NADPH). El NADPH mantiene el suministro de glutatión reducido en las células que se utiliza para eliminar los radicales libres que causan daño oxidativo. La vía también estimula la catalasa, una enzima antioxidante.
La vía G6PD/NADPH es la única fuente de glutatión reducido en los glóbulos rojos (eritrocitos). El papel de los glóbulos rojos como portadores de oxígeno los pone en riesgo sustancial de sufrir daños por radicales libres oxidantes, excepto por el efecto protector de G6PD/NADPH/glutatión.
Las personas con deficiencia de G6PD corren, por tanto, riesgo de sufrir anemia hemolítica en estados de estrés oxidativo. El estrés oxidativo puede resultar de una infección y de la exposición química a medicamentos y ciertos alimentos. Las habas, por ejemplo, las habas, contienen altos niveles de vicina, divicina, convicina e isouramilo, todos los cuales crean oxidantes.
Cuando se consume todo el glutatión reducido restante, los oxidantes dañan posteriormente las enzimas y otras proteínas (incluida la hemoglobina), lo que provoca enlaces cruzados y depósito de proteínas en las membranas de los glóbulos rojos. Los glóbulos rojos dañados son fagocitados y secuestrados (sacados de la circulación) en el bazo. La hemoglobina se metaboliza a bilirrubina (causando ictericia en concentraciones elevadas). Los glóbulos rojos rara vez se desintegran en la circulación, por lo que la hemoglobina rara vez se excreta directamente por el riñón, pero esto puede ocurrir en casos graves y provocar una lesión renal aguda.
La deficiencia de G6PD en la vía alternativa provoca la acumulación de glucosa y, por lo tanto, hay un aumento de los productos finales de glicación avanzada (AGE). La deficiencia también reduce la cantidad de NADPH, que se requiere para la formación de óxido nítrico (NO). La alta prevalencia de diabetes mellitus tipo 2 e hipertensión en los afrocaribeños de Occidente podría estar directamente relacionada con la incidencia de la deficiencia de G6PD en esas poblaciones.
Aunque las mujeres portadoras pueden tener una forma leve de deficiencia de G6PD (dependiendo del grado de inactivación del cromosoma X no afectado; consulte lyonización), se han descrito mujeres homocigotas; en estas mujeres existe una coincidencia de un raro trastorno inmunológico denominado enfermedad granulomatosa crónica (CGD).
Diagnóstico
El diagnóstico generalmente se sospecha cuando pacientes de ciertos grupos étnicos (ver epidemiología) desarrollan anemia, ictericia y síntomas de hemólisis después de desafíos por cualquiera de las causas anteriores, especialmente cuando hay antecedentes familiares positivos.
Generalmente, las pruebas incluirán:
- Conteo sanguíneo completo y reticulocito; en la deficiencia activa de G6PD, los cuerpos heinz se pueden ver en los glóbulos rojos en una película de sangre;
- Enzimas hepáticas (para excluir otras causas de ictericia);
- Deshidrogenasa lactada (elevada en hemolisis y marcador de gravedad hemolítica)
- Haptoglobina (disminuida en hemolisis);
- Una "prueba de antiglobulina directa" (prueba de Coombs) – esto debe ser negativo, ya que la hemolisis en el G6PD no es mediada inmunitariamente;
Cuando hay motivos suficientes para sospechar G6PD, una prueba directa para detectar G6PD es la "prueba de manchas fluorescentes de Beutler", que ha reemplazado en gran medida a una prueba más antigua (la prueba de decoloración de tinte de Motulsky). Otras posibilidades son las pruebas directas de ADN y/o la secuenciación del gen G6PD.
La prueba de manchas fluorescentes de Beutler es una prueba rápida y económica que identifica visualmente el NADPH producido por G6PD bajo luz ultravioleta. Cuando la mancha de sangre no presenta fluorescencia, la prueba es positiva; puede ser falsamente negativo en pacientes que están hemolizando activamente. Por lo tanto, sólo se puede realizar 2 a 3 semanas después de un episodio hemolítico.
Cuando un macrófago del bazo identifica un eritrocito con un cuerpo de Heinz, elimina el precipitado y un pequeño trozo de membrana, lo que da lugar a las características "células de mordedura". Sin embargo, si se produce una gran cantidad de cuerpos de Heinz, como en el caso de la deficiencia de G6PD, algunos cuerpos de Heinz seguirán siendo visibles al observar los glóbulos rojos que se han teñido con violeta cristal. Esta prueba sencilla y económica puede llevar a una presunción inicial de deficiencia de G6PD, que puede confirmarse con las otras pruebas.
Las pruebas durante y durante muchas semanas después de un episodio hemolítico darán resultados falsos negativos, ya que los glóbulos rojos con deficiencia de G6PD se habrán excretado y los glóbulos rojos jóvenes (reticulocitos) aún no tendrán deficiencia de G6PD. También es probable que se obtengan resultados falsos negativos después de cualquier transfusión de sangre. Por esta razón, muchos hospitales esperan 3 meses después de un episodio hemolítico antes de realizar pruebas de deficiencia de G6PD. A las mujeres se les debe medir la actividad de G6PD mediante un ensayo cuantitativo para evitar una clasificación errónea en las pruebas de detección.
Clasificación
La Organización Mundial de la Salud clasifica las variantes genéticas de G6PD en cinco clases, las tres primeras de las cuales son estados de deficiencia.
- Clase I: Deficiencia de severidad (traducción10%) con anemia hemolítica crónica (no esférica)
- Clase II: Deficiencia severa (traducción del 10%), con hemolisis intermitente
- Clase III: Deficiencia moderada (10-60% de actividad), hemolisis con estresores solamente
- Clase IV: Variación no deficiente, sin secuela clínica
- Clase V: Aumento de la actividad enzimática, sin secuela clínica
Diagnóstico diferencial
La deficiencia de 6-fosfogluconato deshidrogenasa (6PGD) tiene síntomas similares y a menudo se confunde con la deficiencia de G6PD, ya que la enzima afectada está dentro de la misma vía; sin embargo, estas enfermedades no están relacionadas y pueden encontrarse en la misma persona.
Tratamiento
La medida más importante es la prevención: evitar los medicamentos y alimentos que causan hemólisis. La vacunación contra algunos patógenos comunes (por ejemplo, hepatitis A y hepatitis B) puede prevenir los ataques inducidos por infecciones.
En la fase aguda de la hemólisis, pueden ser necesarias transfusiones de sangre, o incluso diálisis en la insuficiencia renal aguda. La transfusión de sangre es una medida sintomática importante, ya que los glóbulos rojos transfundidos generalmente no tienen deficiencia de G6PD y vivirán una vida normal en la circulación del receptor. Los afectados deben evitar medicamentos como la aspirina.
Algunos pacientes pueden beneficiarse de la extirpación del bazo (esplenectomía), ya que es un sitio importante de destrucción de glóbulos rojos. El ácido fólico debe utilizarse en cualquier trastorno que presente una elevada renovación de glóbulos rojos. Aunque la vitamina E y el selenio tienen propiedades antioxidantes, su uso no disminuye la gravedad de la deficiencia de G6PD.
Pronóstico
Las personas con deficiencia de G6PD no parecen contraer ninguna enfermedad con más frecuencia que otras personas y pueden tener menos riesgo que otras personas de contraer cardiopatía isquémica y enfermedad cerebrovascular. Sin embargo, un estudio reciente reveló que la deficiencia de G6PD aumenta el riesgo cardiovascular hasta en un 70%. El riesgo que confiere la deficiencia de G6PD es moderado en comparación con el impacto de los factores de riesgo cardiovascular primarios. Además, una revisión publicada planteó la hipótesis de que la deficiencia de G6PD podría reducir la eficacia antiplaquetaria del clopidogrel (resistencia al clopidogrel).
Epidemiología
La deficiencia de G6PD es el segundo defecto enzimático humano más común después de la deficiencia de ALDH2 y está presente en más de 400 millones de personas en todo el mundo. La deficiencia de G6PD provocó 4.100 muertes en 2013 y 3.400 muertes en 1990. La cuenca mediterránea es donde el favismo es más común, especialmente entre los judíos mizrajíes, sardos, chipriotas, griegos, egipcios y algunas poblaciones africanas, incluidas aquellas que tienen estos ancestros. El favismo también ha sido documentado fuera de la cuenca mediterránea, en otras naciones del Medio Oriente y Asia oriental como Irak, Irán, Bulgaria y China. Cerdeña tiene la frecuencia más alta de favismo, con cinco casos por cada 1.000 personas.
Un efecto secundario de esta enfermedad es que confiere protección contra la malaria, en particular la forma de malaria causada por Plasmodium falciparum, la forma más mortal de malaria. Existe una relación similar entre la malaria y la anemia falciforme. Una teoría para explicar esto es que las células infectadas con el parásito Plasmodium son eliminadas más rápidamente por el bazo. Este fenómeno podría dar a los portadores de deficiencia de G6PD una ventaja evolutiva al aumentar su aptitud en entornos endémicos de malaria. Estudios in vitro han demostrado que el Plasmodium falciparum es muy sensible al daño oxidativo. Esta es la base de otra teoría, que es que el defecto genético confiere resistencia debido al hecho de que el huésped deficiente en G6PD tiene un nivel más alto de agentes oxidativos que, aunque generalmente tolerables para el huésped, son mortales para el parásito.
Historia
La comprensión moderna de esta afección comenzó con el análisis de pacientes que mostraban sensibilidad a la primaquina. El descubrimiento de la deficiencia de G6PD se basó en gran medida en las pruebas realizadas a prisioneros voluntarios en la Penitenciaría Estatal de Illinois, un tipo de estudio que hoy en día se considera poco ético y no se puede realizar. Cuando a algunos presos se les administró primaquina, algunos desarrollaron anemia hemolítica pero otros no. A pesar de estos resultados, el ejército estadounidense administró ampliamente el fármaco durante la Guerra de Corea para prevenir la infección recurrente causada por los hipnozoitos del Plasmodium vivax. Se observaron numerosos casos de anemia hemolítica en soldados estadounidenses de ascendencia norteafricana y mediterránea.
Después de estudiar el mecanismo mediante la prueba de Cr51, se demostró de manera concluyente que el efecto hemolítico de la primaquina se debía a un defecto intrínseco de los eritrocitos.
Sociedad y cultura
Tanto en la leyenda como en la mitología, el favismo se conoce desde la antigüedad. A los sacerdotes de varios cultos de la época grecorromana se les prohibía comer o incluso mencionar los frijoles, y Pitágoras tenía una regla estricta de que para unirse a la sociedad de los pitagóricos había que renunciar a los frijoles. Esta prohibición supuestamente se debió a que los frijoles se parecían a los genitales masculinos, pero es posible que se debiera a la creencia de que los frijoles y los humanos fueron creados a partir del mismo material.