Datación por radiocarbono
La datación por radiocarbono (también conocida como datación por carbono o datación por carbono-14) es un método para determinar la edad de un objeto que contiene material orgánico mediante utilizando las propiedades del radiocarbono, un isótopo radiactivo del carbono.
El método fue desarrollado a fines de la década de 1940 en la Universidad de Chicago por Willard Libby. Se basa en el hecho de que el radiocarbono (14
C) se crea constantemente en la atmósfera de la Tierra por la interacción de rayos cósmicos con nitrógeno atmosférico. El 14
C se combina con el oxígeno atmosférico para formar dióxido de carbono radiactivo, que se incorpora a las plantas mediante la fotosíntesis; los animales entonces adquieren 14
C comiendo las plantas. Cuando el animal o la planta muere, deja de intercambiar carbono con su entorno y, a partir de entonces, la cantidad de 14
C que contiene comienza a disminuir como 14
C sufre una desintegración radiactiva. Medición de la cantidad de 14
C en una muestra de una planta o animal muerto, como un trozo de madera o un fragmento de hueso, proporciona información que se puede utilizar para calcular cuándo murió el animal o la planta. Cuanto más antigua es una muestra, menos 14
C hay que detectarlo, y porque la vida media de 14
C (el período de tiempo después del cual la mitad de una muestra determinada se habrá descompuesto) es de aproximadamente 5730 años, las fechas más antiguas que se pueden medir de manera confiable por este proceso datan de hace aproximadamente 50.000 años, aunque los métodos especiales de preparación ocasionan aliado hacen posible el análisis preciso de muestras más antiguas. Libby recibió el Premio Nobel de Química por su trabajo en 1960.
La investigación ha estado en curso desde la década de 1960 para determinar cuál es la proporción de 14
C en la atmósfera durante los últimos cincuenta mil años. Los datos resultantes, en forma de curva de calibración, se utilizan ahora para convertir una medida dada de radiocarbono en una muestra en una estimación de la edad de calendario de la muestra. Se deben hacer otras correcciones para tener en cuenta la proporción de 14
C en diferentes tipos de organismos (fraccionamiento), y los diferentes niveles de 14
C en toda la biosfera (efectos de depósito). Complicaciones adicionales provienen de la quema de combustibles fósiles como el carbón y el petróleo, y de las pruebas nucleares en la superficie realizadas en los años 50 y 60. Debido a que el tiempo que lleva convertir los materiales biológicos en combustibles fósiles es sustancialmente más largo que el tiempo que lleva su 14
C para decaer a continuación niveles detectables, los combustibles fósiles casi no contienen 14
C. Como resultado, a partir de fines del siglo XIX, hubo una caída notable en la proporción de 14
C como el dióxido de carbono generado de la quema de combustibles fósiles comenzó a acumularse en la atmósfera. Por el contrario, las pruebas nucleares aumentaron la cantidad de 14
C en la atmósfera, que alcanzó un máximo en 1965 de casi el doble de la cantidad presente en la atmósfera antes de las pruebas nucleares.
La medición del radiocarbono se realizó originalmente mediante dispositivos de conteo beta, que contaban la cantidad de radiación beta emitida por 14
C átomos en una muestra. Más recientemente, la espectrometría de masas con acelerador se ha convertido en el método de elección; cuenta todos los 14
C átomos en la muestra y no solo los pocos que se descomponen durante las mediciones; por lo tanto, se puede utilizar con muestras mucho más pequeñas (tan pequeñas como semillas de plantas individuales) y proporciona resultados mucho más rápidos. El desarrollo de la datación por radiocarbono ha tenido un profundo impacto en la arqueología. Además de permitir una datación más precisa dentro de los sitios arqueológicos que los métodos anteriores, permite la comparación de fechas de eventos a grandes distancias. Las historias de la arqueología a menudo se refieren a su impacto como la "revolución del radiocarbono". La datación por radiocarbono ha permitido fechar transiciones clave en la prehistoria, como el final de la última glaciación y el comienzo del Neolítico y la Edad del Bronce en diferentes regiones.
Antecedentes
Historia
En 1939, Martin Kamen y Samuel Ruben del Laboratorio de Radiación de Berkeley comenzaron experimentos para determinar si alguno de los elementos comunes en la materia orgánica tenía isótopos con vidas medias lo suficientemente largas como para ser valiosos en la investigación biomédica. Sintetizaron 14
C usando el acelerador de ciclotrón del laboratorio y pronto descubrió que la vida media del átomo era mucho más de lo que se había pensado anteriormente. Esto fue seguido por una predicción de Serge A. Korff, entonces empleado en el Instituto Franklin en Filadelfia, que la interacción de los neutrones térmicos con 14
N en la atmósfera superior crearía 14
C. Anteriormente se había pensado que 14
C sería más probable que los deuterones interactúen con 13
C. En algún momento durante la Segunda Guerra Mundial, Willard Libby, que entonces estaba en Berkeley, se enteró de la investigación de Korff y concibió la idea de que podría ser posible utilizar el radiocarbono para la datación.
En 1945, Libby se mudó a la Universidad de Chicago, donde comenzó su trabajo sobre la datación por radiocarbono. Publicó un artículo en 1946 en el que proponía que el carbono en la materia viva podría incluir 14
C así como carbono no radiactivo. Libby y varios colaboradores procedieron a experimentar con metano recolectado de plantas de alcantarillado en Baltimore y, después de enriquecer isotópicamente sus muestras, pudieron demostrar que contenían 14
C. Por el contrario, el metano creado a partir del petróleo no mostró actividad de radiocarbono debido a su edad. Los resultados se resumieron en un artículo en Science en 1947, en el que los autores comentaron que sus resultados implicaban que sería posible datar materiales que contienen carbono de origen orgánico.
Libby y James Arnold procedieron a probar la teoría de la datación por radiocarbono analizando muestras con edades conocidas. Por ejemplo, dos muestras tomadas de las tumbas de dos reyes egipcios, Zoser y Sneferu, fechadas independientemente en 2625 a. C. más o menos 75 años, fueron fechadas por medición de radiocarbono en un promedio de 2800 a. C. más o menos 250 años. Estos resultados se publicaron en Science en diciembre de 1949. A los 11 años de su anuncio, se habían establecido más de 20 laboratorios de datación por radiocarbono en todo el mundo. En 1960, Libby recibió el Premio Nobel de Química por este trabajo.
Detalles físicos y químicos
En la naturaleza, el carbono existe como tres isótopos, dos estables, no radiactivos: carbono-12 ( 12
C) y carbono -13 (13
C), y carbono-14 radioactivo (14
C), también conocido como "radiocarbono". La vida media de 14
C (el tiempo que tarda la mitad de una cantidad dada de 14
C to decay) es de unos 5730 años, por lo que se puede esperar que su concentración en la atmósfera disminuya durante miles de años, pero 14
C se produce constantemente en la estratosfera inferior y la troposfera superior, principalmente por rayos cósmicos galácticos, y en menor grado por los rayos cósmicos solares. Estos rayos cósmicos generan neutrones a medida que viajan a través de la atmósfera que pueden golpear el nitrógeno-14 (14
N) átomos y convertirlos en 14
C. La siguiente reacción nuclear es la vía principal por la cual 14
C:
- n + 14
7N
→ 14
6C
+ p
donde n representa un neutrón yp representa un protón.
Una vez producido, 14
C se combina rápidamente con el oxígeno (O) en la atmósfera para formar el primer monóxido de carbono (CO) y, en última instancia, dióxido de carbono (CO
2).
- 14
C + O
2 → 14
CO + O
- 14
CO + OH → 14
CO
2 + H
El dióxido de carbono producido de esta manera se difunde en la atmósfera, se disuelve en el océano y las plantas lo absorben a través de la fotosíntesis. Los animales comen las plantas y, en última instancia, el radiocarbono se distribuye por toda la biosfera. La proporción de 14
C a 12
C es aproximadamente 1,25 partes de 14
C a 1012 partes de 12
C. Además, alrededor del 1% de los átomos de carbono son del isótopo estable 13
C.
La ecuación para la desintegración radiactiva de 14
C es:
- 14
6C
→ 14
7N
+
e−
+
.
e
Al emitir una partícula beta (un electrón, e−) y un antineutrino electrónico (
ν
e), uno de los neutrones en 14
C cambia a un protón y el 14
C núcleo revierte al isótopo estable (no radiactivo) 14
N.
Principios
Durante su vida, una planta o animal está en equilibrio con su entorno mediante el intercambio de carbono, ya sea con la atmósfera oa través de su dieta. Por lo tanto, tendrá la misma proporción de 14
C como la atmósfera, o en el caso de animales o plantas marinas, con el océano. Una vez que muere, deja de adquirir 14
C, pero 14
C dentro de su material biológico en ese momento continuará decayendo, por lo que la proporción de 14
C a 12
C en sus restos disminuirá gradualmente. Porque 14
C se desintegra a una velocidad conocida, la proporción de radiocarbono se puede usar para determinar cuánto tiempo ha pasado desde una muestra dada dejó de intercambiar carbono: cuanto más antigua es la muestra, menos 14
C quedará.
La ecuación que rige la desintegración de un isótopo radiactivo es:
- N=N0e− − λ λ t{displaystyle No.
donde N0 es el número de átomos del isótopo en la muestra original (en el tiempo t = 0, cuando el organismo de que se tomó la muestra murió), y N es el número de átomos que quedan después del tiempo t. λ es una constante que depende del isótopo particular; para un isótopo dado, es igual al recíproco de la vida media, es decir, el tiempo promedio o esperado que sobrevivirá un átomo dado antes de sufrir una desintegración radiactiva. La vida media, denotada por τ, de 14
C es 8267 años, por lo que la ecuación anterior se puede reescribir como:
- t=In ()N0/N)⋅ ⋅ 8267 años{displaystyle t=ln(N_{0}/N)cdot {text{8267 years}}
Se supone que la muestra originalmente tenía el mismo 14
C/12
C ratio como la relación en la atmósfera, y dado que se conoce el tamaño de la muestra, se puede calcular el número total de átomos en la muestra, dando como resultado N0, el número de 14
C átomos en el muestra original. Medida de N, el número de 14
C átomos actualmente en la muestra, permite el cálculo de t, la edad de la muestra, utilizando la ecuación anterior.
La vida media de un isótopo radiactivo (generalmente denotada por t1/2) es un concepto más familiar que la vida media, por lo que aunque las ecuaciones anteriores se expresan en términos de la media -life, es más habitual citar el valor de 14
La vida media de C que su vida media. El valor actualmente aceptado para la vida media de 14
C es 5700 ± 30 años. Esto significa que después de 5700 años, solo la mitad de la inicial 14
C permanecerá; una cuarta parte permanecerá después de 11.400 años; un octavo después de 17.100 años; y así.
Los cálculos anteriores hacen varias suposiciones, como que el nivel de 14
C en la atmósfera se ha mantenido constante a lo largo del tiempo. De hecho, el nivel de 14
C en la atmósfera ha variado significativamente y, como resultado, los valores proporcionados por la ecuación anterior han ser corregido usando datos de otras fuentes. Esto se hace mediante curvas de calibración (discutidas a continuación), que convierten una medida de 14
C en una muestra en una edad de calendario estimada. Los cálculos involucran varios pasos e incluyen un valor intermedio llamado "edad de radiocarbono", que es la edad en "años de radiocarbono" de la muestra: una edad expresada en años de radiocarbono significa que no se ha utilizado ninguna curva de calibración − los cálculos para los años de radiocarbono suponen que la atmósfera 14
C/12
C la relación no ha cambiado con el tiempo.
El cálculo de las edades de radiocarbono también requiere el valor de la vida media de 14
C. En el artículo de Libby de 1949, utilizó un valor de 5720 ± 47 años, basado en la investigación de Engelkemeir et al. Este fue notablemente cercano al valor moderno, pero poco después el valor aceptado se revisó a 5568 ± 30 años, y este valor estuvo en uso durante más de una década. Se revisó nuevamente a principios de la década de 1960 a 5730 ± 40 años, lo que significó que muchas fechas calculadas en artículos publicados antes de esto eran incorrectas (el error en la vida media es de aproximadamente el 3%). Para mantener la coherencia con estos primeros documentos, en la Conferencia de Radiocarbono de 1962 en Cambridge (Reino Unido) se acordó utilizar la "vida media de Libby" de 5568 años. Las edades de radiocarbono todavía se calculan utilizando esta vida media y se conocen como "Edad de radiocarbono convencional". Dado que la curva de calibración (IntCal) también informa del pasado atmosférico 14
C concentración usando esta edad convencional, cualquier edad convencional calibrada contra la curva IntCal producirá una edad calibrada correcta. Cuando se cita una fecha, el lector debe tener en cuenta que si se trata de una fecha no calibrada (un término utilizado para las fechas dadas en años de radiocarbono) puede diferir sustancialmente de la mejor estimación de la fecha real del calendario, ya sea porque utiliza un valor incorrecto para la vida media de 14
C, y porque no se aplicó ninguna corrección (calibración) para la variación histórica de 14
C en la atmósfera a lo largo del tiempo.
Reservorio de intercambio de carbono
El carbono se distribuye por la atmósfera, la biosfera y los océanos; estos se denominan colectivamente depósito de intercambio de carbono, y cada componente también se denomina de forma individual depósito de intercambio de carbono. Los diferentes elementos del reservorio de intercambio de carbono varían en la cantidad de carbono que almacenan y en el tiempo que tardan en 14
C generado por los rayos cósmicos para mezclarse completamente con ellos. Esto afecta la proporción de 14
C to 12
C en los diferentes yacimientos y, por tanto, las edades de radiocarbono de las muestras que se originaron en cada yacimiento. La atmósfera, que es donde 14
C, contiene alrededor del 1,9% del carbono total en los embalses, y el 14
C contiene mezclas en menos de siete años. La proporción de 14
C a 12
C en la atmósfera se toma como referencia para los otros reservorios: si otro reservorio tiene una proporción menor de 14
C a 12
C, indica que el carbono es más antiguo y, por lo tanto, que algunos de los 14
C se ha desintegrado, o el reservorio está recibiendo carbono que no está en la línea base atmosférica. La superficie del océano es un ejemplo: contiene el 2,4% del carbono en el depósito de intercambio, pero solo hay alrededor del 95% 14
C como se esperaría si la proporción fuera la misma que en la atmósfera. El tiempo que tarda el carbono de la atmósfera en mezclarse con la superficie del océano es de unos pocos años, pero las aguas superficialestambién reciben agua de las profundidades del océano, que tiene más del 90% del carbono en el reservorio. El agua en las profundidades del océano tarda alrededor de 1000 años en circular de regreso a través de las aguas superficiales, por lo que las aguas superficiales contienen una combinación de agua más antigua, con 14
C, y agua recientemente en la superficie, con 14
C en equilibrio con la atmósfera.
Las criaturas que viven en la superficie del océano tienen la misma 14
C como el agua en la que viven y como resultado de 14
C/12
C relación, la edad de radiocarbono de la vida marina es típicamente de unos 400 años. Los organismos terrestres están en mayor equilibrio con la atmósfera y tienen la misma 14
C/12
C relación como la atmósfera. Estos organismos contienen alrededor del 1,3% del carbono del reservorio; los organismos marinos tienen una masa inferior al 1% de los terrestres y no se muestran en el diagrama. La materia orgánica muerta acumulada, tanto de plantas como de animales, supera la masa de la biosfera en un factor de casi 3, y dado que esta materia ya no intercambia carbono con su entorno, tiene un 14
C/12
C relación inferior a la de la biosfera.
Consideraciones sobre citas
La variación en 14
C/12
C en diferentes partes del depósito de intercambio de carbono significa que un cálculo directo de la edad de una muestra basado en la cantidad de 14
C que contiene a menudo dará un resultado incorrecto. Hay varias otras posibles fuentes de error que deben tenerse en cuenta. Los errores son de cuatro tipos generales:
- variaciones en las 14
C/12
C ratio en la atmósfera, tanto geográfica como con el tiempo; - fracciones isotópicas;
- variaciones en las 14
C/12
C ratio en diferentes partes del embalse; - contaminación.
Variación atmosférica
En los primeros años de uso de la técnica, se entendió que dependía de la 14
C/12
C habiendo permanecido igual durante los miles de años anteriores. Para verificar la precisión del método, se probaron varios artefactos que eran datables por otras técnicas; los resultados de las pruebas coincidían razonablemente con las edades reales de los objetos. Con el tiempo, sin embargo, comenzaron a aparecer discrepancias entre la cronología conocida de las dinastías egipcias más antiguas y las fechas de radiocarbono de los artefactos egipcios. No se podía suponer que la cronología egipcia preexistente ni el nuevo método de datación por radiocarbono fueran precisos, pero una tercera posibilidad era que el 14
C/12
C la proporción había cambiado con el tiempo. La pregunta se resolvió mediante el estudio de los anillos de los árboles: la comparación de series superpuestas de anillos de árboles permitió la construcción de una secuencia continua de datos de anillos de árboles que abarcó 8.000 años. (Desde entonces, la serie de datos de anillos de árboles se ha extendido a 13.900 años). En la década de 1960, Hans Suess pudo usar la secuencia de anillos de árboles para mostrar que las fechas derivadas del radiocarbono eran consistentes con las fechas asignadas por los egiptólogos. Esto fue posible porque aunque las plantas anuales, como el maíz, tienen una 14
C/12
C que refleja la proporción atmosférica en el momento en que estaban creciendo, los árboles solo agregan material a su anillo de árbol más externo en un año determinado, mientras que los anillos de árbol internos no;t obtenga su 14
C reabastecido y en su lugar comienza a perder 14
C a través de la descomposición. Por lo tanto, cada anillo conserva un registro de la atmósfera 14
C/12
C del año en que creció. La datación por carbono de la madera de los anillos de los árboles proporciona la comprobación necesaria de la atmósfera.ric 14
C/12
C ratio: con una muestra de fecha conocida y una medida del valor de N (el número de átomos de 14
C restante en la muestra), la ecuación de datación por carbono permite el cálculo de N0: el número de átomos de 14
C en la muestra en el momento en que se formó el anillo del árbol y, por lo tanto, 14
C /12
C en la atmósfera en ese momento. Equipado con los resultados de la datación por carbono de los anillos de los árboles, fue posible construir curvas de calibración diseñadas para corregir los errores causados por la variación en el tiempo en el 14
C/12
C relación. Estas curvas se describen con más detalle a continuación.
El carbón y el petróleo comenzaron a quemarse en grandes cantidades durante el siglo XIX. Ambos son lo suficientemente antiguos como para contener poco o nada 14
C y, como resultado, CO
2 lanzado diluyó sustancialmente la atmósfera 14
C/12
C relación. La datación de un objeto de principios del siglo XX, por lo tanto, da una fecha aparente más antigua que la fecha real. Por la misma razón, 14
C las concentraciones en el vecindario de las grandes ciudades son más bajas que el promedio atmosférico. Este efecto de los combustibles fósiles (también conocido como efecto Suess, en honor a Hans Suess, quien lo informó por primera vez en 1955) solo representaría una reducción del 0,2 % en 14
C actividad si el carbono adicional de los combustibles fósiles se distribuyera por todo el depósito de intercambio de carbono, pero debido a la larga demora en mezclarse con las profundidades del océano, el efecto real es una reducción del 3%.
Un efecto mucho mayor proviene de las pruebas nucleares en la superficie, que liberaron una gran cantidad de neutrones a la atmósfera, lo que resultó en la creación de 14
C. Aproximadamente desde 1950 hasta 1963, cuando se prohibieron las pruebas nucleares atmosféricas, se estima que varias toneladas de 14
C fueron creados. Si todo este extra 14
C se hubiera extendido inmediatamente por todo el depósito de intercambio de carbono, habría provocado un aumento en 14
C/12
C proporción de solo un pequeño porcentaje, pero el efecto inmediato fue casi duplicar la cantidad de 14
C en el atmósfera, con el nivel máximo en 1964 para el hemisferio norte y en 1966 para el hemisferio sur. Desde entonces, el nivel ha bajado, ya que esta bomba de pulso o "bomba de carbono" (como a veces se le llama) se filtra en el resto del depósito.
Fraccionamiento isotópico
La fotosíntesis es el proceso principal por el cual el carbono se traslada de la atmósfera a los seres vivos. En las rutas fotosintéticas 12
C se absorbe un poco más fácilmente que 13
C, que a su vez se absorbe más fácilmente que 14
C. La absorción diferencial de los tres isótopos de carbono conduce a 13
C/12
C y 14
C/12
C proporciones en las plantas que difieren de las proporciones en la atmósfera. Este efecto se conoce como fraccionamiento isotópico.
Para determinar el grado de fraccionamiento que tiene lugar en una planta dada, las cantidades de ambos 12
C y 13
C se miden los isótopos y el resultado 13
C/12
C se compara con una relación estándar conocida como PDB. El 13
C/12
C ratio se usa en lugar de 14
C/12
C porque el primero es mucho más fácil medir, y este último se puede derivar fácilmente: el agotamiento de 13
C relativo a 12
C es proporcional a la diferencia en las masas atómicas de los dos isótopos, por lo que el agotamiento de 14
C es el doble del agotamiento de 13
C. El fraccionamiento de 13
C, conocido como δ13C, se calcula de la siguiente manera:
- δ δ C13=()()C13C12)muestra()C13C12)estándar− − 1)× × 1000{displaystyle delta {ce {fnh}}=left({frac {left({fracfc}==left({frac {fc {fc {fcfnhfnhfnhfnhfnhfnhfnhfnh00fnhfnhnhfnhfnhnhnhnh}fnh}fnhfnh}fnh}fnh}fnhfnh}fnh00}fnh}fnhfnh}fnh}fnh}fnh}fnh}fnh}fnh}c}fnh}cfnhfnh}fnh}fnh}fnh}fnh}ccccccc}c}c} {cHFF} {cHFF} {c}} {c}}} {c}}} {c}} {c}}}} {cc}}}}}} {cc}}}}}} {ccc}}}}} {cc}}}}}}} {c}}}}} {c}}}}}}}}}}}}}}}}} {c}}}} {c}}}}}}} {c}}}}}}} {c}}}} {c}}}}} {c}}}}}}}}}}}}}}}}}} {c} {c}}}}}}}}} {c}}}}}} {c}}}}}}} {c}}}}}}}}}}}}}}} {c}}}}}}}}}}}}}}}}}}}}}} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} {fnMicroc} {fnMicroc} {fnMicroc} {fnMicroc} {fnMicrosoft} {fnMicroc} {fnMicroc}} {fnMicroc}} {f}}}}} {f}}}}} {f}}}}}} {f}}}}}}}}f}}}}}}}}}}}}}}}}}}}}}}} {f} {f}f}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}f} {f} {f} {f} {f} {f} {f}f}}}}}}}}}}}}}}}} {cHFF} {cHFF} {c}} {c}}} {c}}} {c}} {c}}}} {cc}}}}}} {cc}}}}}} {ccc}}}}} {cc}}}}}}} {c}}}}} {c}}}}}}}}}}}}}}}}} {c}}}} {c}}}}}}} {c}}}}}}} {c}}}} {c}}}}} {c}}}}}}}}}}}}}}}}}} {c} {c}}}}}}}}} {c}}}}}} {c}}}}}}} {c}}}}}}}}}}}}}}} {c}}}}}}}}}}}}}}}}}}}}}} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif}.
donde el signo ‰ indica partes por mil. Porque el estándar PDB contiene una proporción inusualmente alta de 13
C, la mayoría δ13C los valores son negativos.
| Material | Típico δ13C rango |
|---|---|
| PDB | 0/ |
| Marine plankton | −22 a 17. |
| Plantas C3 | −30 - −22 |
| Plantas C4 | −15 - −9. |
| Atmosférico CO 2 | −8 |
| Marine CO 2 | −32 −13. |
Para los organismos marinos, los detalles de las reacciones de fotosíntesis son menos conocidos y los valores de δ13C para los organismos fotosintéticos marinos dependen de la temperatura. A temperaturas más altas, CO
2 tiene poca solubilidad en agua, lo que significa que hay menos CO
2 disponible para las reacciones fotosintéticas. En estas condiciones, el fraccionamiento se reduce y, a temperaturas superiores a 14 °C, los valores de δ13C son correspondientemente más altos, mientras que a temperaturas más bajas, CO
2 se vuelve más soluble y, por lo tanto, más disponible para los organismos marinos. El valor de δ13C para los animales depende de su dieta. Un animal que come alimentos con valores altos de δ13C tendrá un mayor δ 13C que uno que come alimentos con menor δ13C valores. Los propios procesos bioquímicos del animal también pueden afectar los resultados: por ejemplo, tanto los minerales óseos como el colágeno óseo suelen tener una mayor concentración de 13
C que se encuentra en la dieta del animal, aunque por diferentes razones bioquímicas. El enriquecimiento del hueso 13
C también implica que el material excretado se agota en 13
C en relación con la dieta.
Desde 13
C constituye aproximadamente el 1% del carbono en una muestra, el 13
C/12
C se puede medir con precisión mediante espectrometría de masas. Se han encontrado valores típicos de δ13C mediante experimentos para muchas plantas, así como para diferentes partes de animales como como colágeno óseo, pero al fechar una muestra determinada es mejor determinar el valor de δ13C para esa muestra directamente que confiar en los valores publicados.
El intercambio de carbono entre el CO
2 y el carbonato en la superficie del océano también está sujeto a fraccionamiento, con 14
C en la atmósfera es más probable que 12
C para disolverse en el océano. El resultado es un aumento general en 14
C/12
Relación C en el océano del 1,5 %, en relación con la 14
C/12
C en la atmósfera. Este aumento en 14
C cancela casi exactamente la disminución causada por el afloramiento de agua (que contiene agua vieja y, por lo tanto, 14
C-empobrecido, carbono) de las profundidades del océano, de modo que las mediciones directas de 14
C son similares a las medidas para el resto de la biosfera. La corrección del fraccionamiento isotópico, como se hace con todas las fechas de radiocarbono para permitir la comparación entre los resultados de diferentes partes de la biosfera, da una edad aparente de unos 400 años para el agua superficial del océano.
Efectos de depósito
La hipótesis del reservorio de intercambio original de Libby asumía que 14
C/ 12
C en el depósito de intercambio es constante en todo el mundo, pero desde entonces se ha descubierto que hay varias causas de variación en la relación en todo el depósito.
Efecto marino
El CO
2 en la atmósfera se transfiere al océano al disolverse en el agua superficial como iones de carbonato y bicarbonato; al mismo tiempo, los iones de carbonato en el agua regresan al aire como CO
2. Este proceso de intercambio trae 14
C de la atmósfera a las aguas superficiales del océano, pero el 14
C así introducida tarda mucho tiempo en filtrarse a través de todo el volumen del océano. Las partes más profundas del océano se mezclan muy lentamente con las aguas superficiales y la mezcla es desigual. El mecanismo principal que trae agua profunda a la superficie es el afloramiento, que es más común en las regiones más cercanas al ecuador. El afloramiento también está influenciado por factores como la topografía del fondo del océano local y las costas, el clima y los patrones del viento. En general, la mezcla de aguas superficiales y profundas lleva mucho más tiempo que la mezcla de CO
2 con las aguas superficiales, y como Como resultado, el agua de algunas áreas oceánicas profundas tiene una edad de radiocarbono aparente de varios miles de años. La surgencia mezcla este "viejo" agua con el agua superficial, dando al agua superficial una edad aparente de varios cientos de años (después de corregir el fraccionamiento). Este efecto no es uniforme: el efecto promedio es de unos 400 años, pero hay desviaciones locales de varios cientos de años para áreas geográficamente cercanas entre sí. Estas desviaciones pueden tenerse en cuenta en la calibración, y los usuarios de software como CALIB pueden proporcionar como entrada la corrección adecuada para la ubicación de sus muestras. El efecto también se aplica a organismos marinos como conchas y mamíferos marinos como ballenas y focas, que tienen edades de radiocarbono que parecen tener cientos de años.
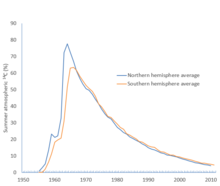
Efecto hemisferio
Los hemisferios norte y sur tienen sistemas de circulación atmosférica que son lo suficientemente independientes entre sí como para que haya un retraso notable en la mezcla entre los dos. El atmosférico 14
C/12
C ratio es menor en el hemisferio sur, con una edad adicional aparente de unos 40 años para los resultados de radiocarbono del sur en comparación con el norte. Esto se debe a que la mayor superficie de océano en el hemisferio sur significa que hay más carbono intercambiado entre el océano y la atmósfera que en el norte. Dado que la superficie del océano se agota en 14
C debido al efecto marino, 14
C se elimina de la atmósfera del sur más rápidamente que en el norte. El efecto se ve reforzado por un fuerte afloramiento alrededor de la Antártida.
Otros efectos
Si el carbono del agua dulce se obtiene en parte del carbono envejecido, como las rocas, el resultado será una reducción de la 14
C/12
C relación en el agua. Por ejemplo, los ríos que pasan sobre piedra caliza, que se compone principalmente de carbonato de calcio, adquirirán iones de carbonato. De manera similar, el agua subterránea puede contener carbono derivado de las rocas a través de las cuales ha pasado. Estas rocas suelen ser tan antiguas que ya no contienen ninguna 14
C, por lo que este carbono reduce la 14
C/12
C proporción del agua que ingresa, lo que puede dar lugar a edades aparentes de miles de años tanto para el agua afectada como para las plantas y organismos de agua dulce que viven en ella. Esto se conoce como el efecto del agua dura porque a menudo se asocia con iones de calcio, que son característicos del agua dura; otras fuentes de carbono, como el humus, pueden producir resultados similares y también pueden reducir la edad aparente si son de origen más reciente que la muestra. El efecto varía mucho y no hay una compensación general que se pueda aplicar; Por lo general, se necesita investigación adicional para determinar el tamaño de la compensación, por ejemplo, comparando la edad de radiocarbono de las conchas de agua dulce depositadas con el material orgánico asociado.
Las erupciones volcánicas expulsan grandes cantidades de carbono al aire. El carbono es de origen geológico y no tiene 14
C, por lo que el estilo 14
C/12
C la relación en la vecindad del volcán está deprimida en relación con las áreas circundantes. Los volcanes inactivos también pueden emitir carbono envejecido. Las plantas que fotosintetizan este carbono también tienen 14
C/12
Proporciones C: por ejemplo, se encontró que las plantas en el vecindario de la caldera de Furnas en las Azores tenían edades aparentes que oscilaban entre 250 y 3320 años.
Contaminación
Cualquier adición de carbono a una muestra de una edad diferente hará que la fecha medida sea inexacta. La contaminación con carbono moderno hace que una muestra parezca más joven de lo que realmente es: el efecto es mayor para las muestras más antiguas. Si una muestra que tiene 17.000 años está contaminada de modo que el 1% de la muestra es carbono moderno, parecerá ser 600 años más joven; para una muestra que tiene 34.000 años, la misma cantidad de contaminación causaría un error de 4.000 años. Contaminación con carbón viejo, sin restos 14
C, provoca un error en la otra dirección independientemente de la edad: una muestra contaminada con 1 El % de carbono antiguo parecerá tener unos 80 años más de lo que realmente es, independientemente de la fecha de la muestra.
Muestras
Las muestras para fechar deben convertirse en un formato adecuado para medir 14
C content; esto puede significar la conversión a forma gaseosa, líquida o sólida, según la técnica de medición que se utilice. Antes de que se pueda hacer esto, la muestra debe tratarse para eliminar cualquier contaminación y cualquier componente no deseado. Esto incluye eliminar los contaminantes visibles, como las raicillas que pueden haber penetrado en la muestra desde su entierro. Se pueden usar lavados con álcali y ácido para eliminar la contaminación por ácido húmico y carbonato, pero se debe tener cuidado para evitar eliminar la parte de la muestra que contiene el carbono que se va a analizar.
Consideraciones materiales
- Es común reducir una muestra de madera a sólo el componente de celulosa antes de la prueba, pero ya que esto puede reducir el volumen de la muestra al 20% de su tamaño original, la prueba de toda la madera se realiza también. El carbón se prueba a menudo pero es probable que necesite tratamiento para eliminar contaminantes.
- El hueso sin quemadura puede ser probado; es habitual hasta la fecha que utiliza el colágeno, la fracción de proteínas que permanece después de lavar el material estructural del hueso. La hidroxiprolina, uno de los aminoácidos constitutivos en el hueso, se pensó una vez que era un indicador fiable ya que no se sabía que ocurriría excepto en el hueso, pero desde entonces se ha detectado en el agua subterránea.
- Para el hueso quemado, la testabilidad depende de las condiciones bajo las cuales se quemó el hueso. Si el hueso fue calentado bajo condiciones de reducción, (y la materia orgánica asociada) puede haber sido carbonizado. En este caso, la muestra suele ser usable.
- Las campanas de organismos marinos y terrestres consisten casi enteramente de carbonato de calcio, ya sea como aragonita o como calcita, o alguna mezcla de los dos. El carbonato de calcio es muy susceptible a disolver y recrystallizar; el material recrystallized contendrá carbono del ambiente de la muestra, que puede ser de origen geológico. Si las pruebas de shell recrystallized es inevitable, a veces es posible identificar el material de shell original de una secuencia de pruebas. También es posible probar la conchiolina, una proteína orgánica que se encuentra en la cáscara, pero constituye sólo 1–2% de material cáscara.
- Los tres componentes principales de la turba son el ácido húmico, las huminas y el ácido fulvico. De estos, las huminas dan la fecha más fiable ya que son insolubles en alcalí y menos probable que contengan contaminantes del medio ambiente de la muestra. Una dificultad particular con la turba seca es la eliminación de los rootlets, que probablemente sean difíciles de distinguir del material de la muestra.
- El suelo contiene material orgánico, pero debido a la probabilidad de contaminación por ácido húmico de origen más reciente, es muy difícil obtener fechas satisfactorias de radiocarbono. Es preferible sieve el suelo para fragmentos de origen orgánico, y data los fragmentos con métodos que son tolerantes a tamaños de muestras pequeñas.
- Otros materiales que se han datado con éxito incluyen marfil, papel, textiles, semillas individuales y granos, paja de ladrillos de barro, y restos de alimentos carbonizados encontrados en cerámica.
Preparación y tamaño
Especialmente para muestras más antiguas, puede ser útil enriquecer la cantidad de 14
C en la muestra antes de la prueba. Esto se puede hacer con una columna de difusión térmica. El proceso dura aproximadamente un mes y requiere una muestra diez veces mayor que la que se necesitaría de otro modo, pero permite una medición más precisa del 14
C /12
C en material antiguo y amplía la edad máxima que se puede informar de forma fiable.
Una vez eliminada la contaminación, las muestras deben convertirse a una forma adecuada para la tecnología de medición que se utilizará. Donde se requiere gas, CO
2 se usa mucho. Para que las muestras se utilicen en contadores de centelleo líquido, el carbón debe estar en forma líquida; la muestra normalmente se convierte en benceno. Para la espectrometría de masas con acelerador, los objetivos de grafito sólido son los más comunes, aunque los gaseosos CO También se puede usar
2.
La cantidad de material necesario para la prueba depende del tipo de muestra y la tecnología que se utilice. Hay dos tipos de tecnología de prueba: detectores que registran la radiactividad, conocidos como contadores beta, y espectrómetros de masas de acelerador. Para los contadores beta, normalmente se requiere una muestra que pese al menos 10 gramos (0,35 onzas). La espectrometría de masas con acelerador es mucho más sensible y se pueden usar muestras que contienen tan solo 0,5 miligramos de carbono.
Medición y resultados
Durante décadas, después de que Libby realizara los primeros experimentos de datación por radiocarbono, la única manera de medir la 14
C en una muestra era detectar la desintegración radiactiva de átomos de carbono individuales. En este enfoque, lo que se mide es la actividad, en número de eventos de descomposición por unidad de masa por período de tiempo, de la muestra. Este método también se conoce como "recuento beta", porque son las partículas beta emitidas por el 14
C átomos que se detectan. A fines de la década de 1970, se dispuso de un enfoque alternativo: contar directamente el número de 14
C y 12
C átomos en una muestra determinada, mediante espectrometría de masas con acelerador, generalmente denominada AMS. AMS cuenta el 14
C/12
C relación directamente, en lugar de la actividad de la muestra, sino mediciones de actividad y 14
C/12
C se puede convertir exactamente entre sí. Durante algún tiempo, los métodos de conteo beta fueron más precisos que AMS, pero ahora AMS es más preciso y se ha convertido en el método de elección para las mediciones de radiocarbono. Además de una precisión mejorada, AMS tiene otras dos ventajas significativas sobre el conteo beta: puede realizar pruebas precisas en muestras demasiado pequeñas para el conteo beta, y es mucho más rápido: se puede lograr una precisión del 1 % en minutos con AMS, que es mucho más rápido de lo que se podría lograr con la tecnología más antigua.
Recuento beta
El primer detector de Libby fue un contador Geiger diseñado por él mismo. Convirtió el carbono de su muestra en negro de lámpara (hollín) y cubrió con él la superficie interna de un cilindro. Este cilindro se insertó en el contador de tal manera que el alambre contador estuviera dentro del cilindro de muestra, para que no hubiera material entre la muestra y el alambre. Cualquier material interpuesto habría interferido con la detección de radiactividad, ya que las partículas beta emitidas por la descomposición 14
C son tan débiles que la mitad son detenido por un espesor de 0,01 mm de aluminio.
El método de Libby pronto fue reemplazado por contadores proporcionales de gas, que se vieron menos afectados por la bomba de carbono (el 14
C creado por las pruebas de armas nucleares). Estos contadores registran ráfagas de ionización causadas por las partículas beta emitidas por el 14
C átomos; los estallidos son proporcionales a la energía de la partícula, por lo que se pueden identificar e ignorar otras fuentes de ionización, como la radiación de fondo. Los contadores están rodeados de blindaje de plomo o acero, para eliminar la radiación de fondo y reducir la incidencia de los rayos cósmicos. Además, se utilizan detectores de anticoincidencia; estos eventos de registro fuera del contador y cualquier evento registrado simultáneamente tanto dentro como fuera del contador se considera un evento extraño y se ignora.
La otra tecnología común utilizada para medir 14
C es el recuento de centelleo líquido, que se inventó en 1950, pero que tenía esperar hasta principios de la década de 1960, cuando se desarrollaron métodos eficientes de síntesis de benceno, para volverse competitivo con el conteo de gases; después de 1970, los contadores de líquidos se convirtieron en la opción tecnológica más común para los laboratorios de datación recién construidos. Los contadores funcionan detectando destellos de luz causados por las partículas beta emitidas por 14
C mientras interactúan con un agente fluorescente agregado al benceno. Al igual que los contadores de gas, los contadores de centelleo líquido requieren contadores de protección y anticoincidencia.
Tanto para el contador proporcional de gas como para el contador de centelleo de líquido, lo que se mide es el número de partículas beta detectadas en un período de tiempo determinado. Dado que se conoce la masa de la muestra, se puede convertir en una medida estándar de actividad en unidades de cuentas por minuto por gramo de carbono (cpm/g C) o becquereles por kg (Bq/kg C, en unidades SI). Cada dispositivo de medición también se usa para medir la actividad de una muestra en blanco, una muestra preparada a partir de carbono lo suficientemente viejo como para no tener actividad. Esto proporciona un valor para la radiación de fondo, que se debe restar de la actividad medida de la muestra que se está fechando para obtener la actividad atribuible únicamente a la 14
C. Además, se mide una muestra con una actividad estándar para proporcionar una línea de base para la comparación.
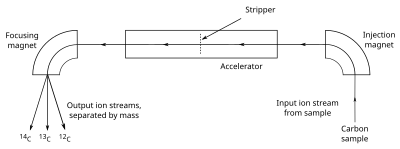
Espectrometría de masas con acelerador
AMS cuenta los átomos de 14
C y 12
C en una muestra dada, determinando 14
C/12
C proporción directamente. Se hace que la muestra, a menudo en forma de grafito, emita iones C− (átomos de carbono con una única carga negativa), que se inyectan en un acelerador. Los iones se aceleran y pasan a través de un separador, que elimina varios electrones para que los iones emerjan con una carga positiva. Los iones, que pueden tener de 1 a 4 cargas positivas (C+ a C4+), dependiendo del diseño del acelerador, luego pasan a través de un imán que curva su camino; los iones más pesados están menos curvados que los más ligeros, por lo que los diferentes isótopos emergen como flujos de iones separados. Luego, un detector de partículas registra la cantidad de iones detectados en el 14
C stream, pero dado que el volumen de 12
C (y 13
C, necesaria para la calibración) es demasiado grande para la detección de iones individuales, los recuentos se determinan midiendo la corriente eléctrica creada en una copa de Faraday. La gran carga positiva inducida por el separador fuerza moléculas como 13
CH, que tiene un peso lo suficientemente cercano a 14
C para interferir con las mediciones, para disociar, para que no se detecten. La mayoría de las máquinas AMS también miden el δ13C de la muestra, para usar en el cálculo de la muestra. s edad de radiocarbono. El uso de AMS, a diferencia de formas más simples de espectrometría de masas, es necesario debido a la necesidad de distinguir los isótopos de carbono de otros átomos o moléculas que tienen una masa muy similar, como 14
N y 13
CH. Al igual que con el recuento beta, se utilizan tanto muestras en blanco como muestras estándar. Se pueden medir dos tipos diferentes de blanco: una muestra de carbón muerto que no se ha sometido a ningún procesamiento químico, para detectar cualquier fondo de máquina, y una muestra conocida como blanco de proceso hecho de carbón muerto que se procesa en el material objetivo exactamente de la misma manera. como la muestra que se está fechando. Cualquier 14
C es probable que la señal del blanco de fondo de la máquina sea causada por haces de iones que no han seguido la ruta esperada en el interior el detector o por hidruros de carbono como 12
CH
2 o 13
CH. A 14
C La señal del blanco de proceso mide la cantidad de contaminación introducida durante la preparación de la muestra. Estas medidas se utilizan en el cálculo posterior de la edad de la muestra.
Cálculos
Los cálculos a realizar sobre las medidas tomadas dependen de la tecnología utilizada, ya que los contadores beta miden la radiactividad de la muestra mientras que AMS determina la proporción de los tres isótopos de carbono diferentes en la muestra.
Para determinar la edad de una muestra cuya actividad ha sido medida por conteo beta, se debe encontrar la relación entre su actividad y la actividad del estándar. Para determinar esto, se mide una muestra en blanco (de carbón viejo o muerto) y se mide una muestra de actividad conocida. Las muestras adicionales permiten detectar y corregir errores como la radiación de fondo y errores sistemáticos en la configuración del laboratorio. El material de muestra estándar más común es el ácido oxálico, como el estándar HOxII, 1,000 lb del cual fue preparado por el Instituto Nacional de Estándares y Tecnología (NIST) en 1977 a partir de cosechas de remolacha francesa.
Los resultados de las pruebas de AMS tienen la forma de proporciones de 12
C, 13
C, y 14
C, que se utilizan para calcular Fm, la "fracción moderna". Esto se define como la relación entre 14
C/12
relación C en la muestra y 14
C/12
C proporción en carbono moderno, que a su vez se define como 14
C/12
C proporción que se habría medido en 1950 si no hubiera habido un efecto de combustible fósil.
Tanto el conteo beta como los resultados de AMS deben corregirse por fraccionamiento. Esto es necesario porque diferentes materiales de la misma edad, que debido al fraccionamiento tienen 14
C/12
C proporciones, parecerán tener diferentes edades porque 14
C/12
C se toma como indicador de edad. Para evitar esto, todas las medidas de radiocarbono se convierten a la medida que se hubiera visto si la muestra hubiera sido de madera, que tiene un δ13
C valor de −25‰.
Una vez corregido 14
C/12
C, una "edad de radiocarbono" se calcula usando:
- Edad=− − In ()F m)⋅ ⋅ 8033años{displaystyle {text{Age}=-ln({text{Fm})cdot 8033{text{ years}}}
El cálculo utiliza 8033 años, la vida media derivada de la vida media de Libby de 5568 años, no 8267 años, la vida media derivada del valor moderno más preciso de 5730 años. El valor de Libby para la vida media se utiliza para mantener la coherencia con los primeros resultados de las pruebas de radiocarbono; las curvas de calibración incluyen una corrección para esto, por lo que se asegura la precisión de las edades de calendario finales informadas.
Errores y confiabilidad
La confiabilidad de los resultados se puede mejorar alargando el tiempo de prueba. Por ejemplo, si contar las desintegraciones beta durante 250 minutos es suficiente para arrojar un error de ± 80 años, con una confianza del 68 %, duplicar el tiempo de conteo a 500 minutos permitirá obtener una muestra con solo la mitad 14
C para ser medido con el mismo término de error de 80 años.
La datación por radiocarbono generalmente se limita a la datación de muestras de no más de 50 000 años, ya que las muestras más antiguas tienen 14
C ser medible. Se han obtenido fechas más antiguas utilizando técnicas especiales de preparación de muestras, muestras grandes y tiempos de medición muy prolongados. Estas técnicas pueden permitir la medición de fechas de hasta 60.000 y en algunos casos hasta 75.000 años antes del presente.
Las fechas de radiocarbono generalmente se presentan con un rango de una desviación estándar (generalmente representada por la letra griega sigma como 1σ) a cada lado de la media. Sin embargo, un rango de fechas de 1σ representa solo un nivel de confianza del 68 %, por lo que la edad real del objeto que se mide puede estar fuera del rango de fechas citadas. Esto se demostró en 1970 mediante un experimento realizado por el laboratorio de radiocarbono del Museo Británico, en el que se tomaron medidas semanales en la misma muestra durante seis meses. Los resultados variaron ampliamente (aunque consistentemente con una distribución normal de errores en las mediciones) e incluyeron múltiples rangos de fechas (de 1σ de confianza) que no se superpusieron entre sí. Las mediciones incluyeron una con un rango de hace aproximadamente 4250 a aproximadamente 4390 años, y otra con un rango de aproximadamente 4520 a aproximadamente 4690.
Los errores en el procedimiento también pueden conducir a errores en los resultados. Si el 1% del benceno en una muestra de referencia moderna se evapora accidentalmente, el conteo de centelleo dará una edad de radiocarbono que es demasiado joven en unos 80 años.
Calibración
Los cálculos anteriores producen fechas en años de radiocarbono: es decir, fechas que representan la edad que tendría la muestra si 14
C /12
C la relación había sido constante históricamente. Aunque Libby había señalado ya en 1955 la posibilidad de que esta suposición fuera incorrecta, no fue hasta que comenzaron a acumularse discrepancias entre las edades medidas y las fechas históricas conocidas de los artefactos que quedó claro que sería necesario aplicar una corrección a las edades de radiocarbono para obtener fechas del calendario.
Para producir una curva que se pueda usar para relacionar años calendario con años de radiocarbono, se necesita una secuencia de muestras fechadas de forma segura que se puedan analizar para determinar su edad de radiocarbono. El estudio de los anillos de los árboles condujo a la primera secuencia de este tipo: las piezas individuales de madera muestran secuencias características de anillos que varían en grosor debido a factores ambientales como la cantidad de lluvia en un año determinado. Estos factores afectan a todos los árboles de un área, por lo que examinar las secuencias de anillos de árboles de madera vieja permite identificar secuencias superpuestas. De esta manera, una secuencia ininterrumpida de anillos de árboles puede extenderse hacia el pasado. La primera secuencia publicada de este tipo, basada en los anillos de los árboles de pino bristlecone, fue creada por Wesley Ferguson. Hans Suess usó estos datos para publicar la primera curva de calibración para la datación por radiocarbono en 1967. La curva mostraba dos tipos de variación con respecto a la línea recta: una fluctuación a largo plazo con un período de aproximadamente 9000 años y una variación a más corto plazo, a menudo denominada a como "meneos", con un período de décadas. Suess dijo que dibujó la línea que muestra las ondulaciones por "cósmico schwung", lo que significa que las variaciones fueron causadas por fuerzas extraterrestres. Durante algún tiempo no estuvo claro si los movimientos eran reales o no, pero ahora están bien establecidos. Estas fluctuaciones a corto plazo en la curva de calibración ahora se conocen como efectos de Vries, en honor a Hessel de Vries.
Se usa una curva de calibración tomando la fecha de radiocarbono informada por un laboratorio y leyendo a partir de esa fecha en el eje vertical del gráfico. El punto donde esta línea horizontal se cruza con la curva dará la edad de calendario de la muestra en el eje horizontal. Esta es la forma inversa a la forma en que se construye la curva: un punto en el gráfico se deriva de una muestra de edad conocida, como el anillo de un árbol; cuando se prueba, la edad de radiocarbono resultante da un punto de datos para el gráfico.
Durante los siguientes treinta años, se publicaron muchas curvas de calibración usando una variedad de métodos y enfoques estadísticos. Estos fueron reemplazados por la serie de curvas IntCal, comenzando con IntCal98, publicado en 1998 y actualizado en 2004, 2009, 2013 y 2020. Las mejoras a estas curvas se basan en nuevos datos recopilados de anillos de árboles, varvas, coral, planta macrofósiles, espeleotemas y foraminíferos. Los datos de IntCal20 incluyen curvas separadas para los hemisferios norte y sur, ya que difieren sistemáticamente debido al efecto del hemisferio. La curva sur (SHCAL20) se basa en datos independientes siempre que sea posible y se deriva de la curva norte al agregar el desplazamiento promedio para el hemisferio sur donde no había datos directos disponibles. También hay una curva de calibración marina separada, MARINE20. Para un conjunto de muestras que forman una secuencia con una separación temporal conocida, estas muestras forman un subconjunto de la curva de calibración. La secuencia se puede comparar con la curva de calibración y la mejor coincidencia con la secuencia establecida. Este "coincidencia de movimiento" La técnica puede conducir a una datación más precisa de lo que es posible con fechas de radiocarbono individuales. La coincidencia de movimiento se puede usar en lugares donde hay una meseta en la curva de calibración y, por lo tanto, puede proporcionar una fecha mucho más precisa que la que pueden producir los métodos de intersección o probabilidad. La técnica no se limita a los anillos de los árboles; por ejemplo, una secuencia de tefra estratificada en Nueva Zelanda, que se cree que es anterior a la colonización humana de las islas, se ha fechado en 1314 d. C. ± 12 años mediante coincidencia de movimiento. Las ondulaciones también significan que leer una fecha de una curva de calibración puede dar más de una respuesta: esto ocurre cuando la curva sube y baja lo suficiente como para que la edad del radiocarbono intercepte la curva en más de un lugar, lo que puede llevar a que se obtenga un resultado de radiocarbono. informado como dos rangos de edad separados, correspondientes a las dos partes de la curva que interceptó la edad de radiocarbono.
Las técnicas estadísticas bayesianas se pueden aplicar cuando hay varias fechas de radiocarbono para calibrar. Por ejemplo, si se toma una serie de fechas de radiocarbono de diferentes niveles en una secuencia estratigráfica, el análisis bayesiano se puede usar para evaluar fechas que son atípicas y puede calcular distribuciones de probabilidad mejoradas, con base en la información previa de que la secuencia debe ordenarse en el tiempo.. Cuando se introdujo el análisis bayesiano, su uso estaba limitado por la necesidad de usar computadoras centrales para realizar los cálculos, pero desde entonces la técnica se ha implementado en programas disponibles para computadoras personales, como OxCal.
Fechas de informes
Se han utilizado varios formatos para citar resultados de radiocarbono desde que se fecharon las primeras muestras. A partir de 2019, el formato estándar requerido por la revista Radiocarbon es el siguiente.
Las fechas no calibradas deben ser reportadas como "laboratorio: C14{displaystyle {ce {fnK}} {fnK}}} {fnK}}}} {fn}}}}}}} {fn}} año ± rango BP", donde:
- laboratorio identifica el laboratorio que probó la muestra, y el ID de la muestra
- C14{displaystyle {ce {fnK}} {fnK}}} {fnK}}}} {fn}}}}}}} {fn}} año es la determinación del laboratorio de la edad de la muestra, en los años de radiocarbono
- rango es la estimación del laboratorio del error en la edad, en confianza 1σ.
- 'BP' significa "antes presente", refiriéndose a una fecha de referencia de 1950, de modo que "500 BP" significa el año 1450 DC.
Por ejemplo, la fecha no calibrada "UtC-2020: 3510 ± 60 BP" indica que la muestra fue analizada por el Utrecht van der Graaff Laboratorium ("UtC"), donde tiene un número de muestra de "2020", y que la edad sin calibrar es de 3510 años antes del presente, ± 60 años. A veces se utilizan formas relacionadas: por ejemplo, "10 ka BP" significa 10 000 años de radiocarbono antes del presente (es decir, 8050 a. C.), y "14
C año BP" podría usarse para distinguir la fecha no calibrada de una fecha derivada de otro método de datación, como la termoluminiscencia.
Calibrado 14
C las fechas se informan con frecuencia como "cal BP", "cal BC& #34;, o "cal AD", nuevamente con 'BP' refiriéndose al año 1950 como la fecha cero. Radiocarbon ofrece dos opciones para informar fechas calibradas. Un formato común es "cal rango de fechas confianza", donde:
- date-range es el rango de fechas correspondientes al nivel de confianza dado
- confianza indica el nivel de confianza para el rango de fecha dado.
Por ejemplo, "cal 1220–1281 dC (1σ)" significa una fecha calibrada para la cual la fecha real se encuentra entre 1220 d. C. y 1281 d. C., con un nivel de confianza de '1 sigma', o aproximadamente 68 %. Las fechas calibradas también se pueden expresar como "BP" en lugar de usar "BC" y "AD". La curva utilizada para calibrar los resultados debe ser la última curva IntCal disponible. Las fechas calibradas también deben identificar cualquier programa, como OxCal, utilizado para realizar la calibración. Además, un artículo en Radiocarbon en 2014 sobre las convenciones de informes de fecha de radiocarbono recomienda que se proporcione información sobre el tratamiento de la muestra, incluido el material de la muestra, los métodos de pretratamiento y las medidas de control de calidad; que la cita del software utilizado para la calibración debe especificar el número de versión y cualquier opción o modelo utilizado; y que se debe dar la fecha calibrada con las probabilidades asociadas para cada rango.
Uso en arqueología
Interpretación
Un concepto clave en la interpretación de las fechas de radiocarbono es la asociación arqueológica: ¿cuál es la verdadera relación entre dos o más objetos en un sitio arqueológico? Con frecuencia sucede que una muestra para la datación por radiocarbono se puede tomar directamente del objeto de interés, pero también hay muchos casos en los que esto no es posible. Los ajuares funerarios de metal, por ejemplo, no pueden fecharse por radiocarbono, pero se pueden encontrar en una tumba con un ataúd, carbón u otro material que se puede suponer que se depositó al mismo tiempo. En estos casos, la fecha del ataúd o del carbón es indicativa de la fecha de depósito del ajuar, por la relación funcional directa entre ambas. También hay casos en los que no existe una relación funcional, pero la asociación es razonablemente fuerte: por ejemplo, una capa de carbón en un basurero proporciona una fecha que tiene relación con el basurero.
La contaminación es motivo de especial preocupación cuando se data material muy antiguo obtenido de excavaciones arqueológicas y se necesita mucho cuidado en la selección y preparación de las muestras. En 2014, Thomas Higham y sus colaboradores sugirieron que muchas de las fechas publicadas para los artefactos neandertales son demasiado recientes debido a la contaminación por "carbono joven".
A medida que un árbol crece, solo el anillo exterior del árbol intercambia carbono con su entorno, por lo que la edad medida para una muestra de madera depende de dónde se haya tomado la muestra. Esto significa que las fechas de radiocarbono en las muestras de madera pueden ser más antiguas que la fecha en que se taló el árbol. Además, si un trozo de madera se usa para múltiples propósitos, puede haber una demora significativa entre la tala del árbol y el uso final en el contexto en el que se encuentra. Esto a menudo se conoce como la "madera vieja" problema. Un ejemplo es el sendero de la Edad del Bronce en Withy Bed Copse, en Inglaterra; la vía se construyó con madera que claramente había sido trabajada para otros fines antes de ser reutilizada en la vía. Otro ejemplo es la madera flotante, que se puede utilizar como material de construcción. No siempre es posible reconocer la reutilización. Otros materiales pueden presentar el mismo problema: por ejemplo, se sabe que algunas comunidades neolíticas utilizaron betún para impermeabilizar cestas; la edad de radiocarbono del betún será mayor que la que puede medir el laboratorio, independientemente de la edad real del contexto, por lo que probar el material de la canasta dará una edad engañosa si no se tiene cuidado. Un problema aparte, relacionado con la reutilización, es el del uso prolongado o la deposición retrasada. Por ejemplo, un objeto de madera que permanece en uso durante un período prolongado tendrá una edad aparente mayor que la edad real del contexto en el que se deposita.
Usar arqueología externa
La arqueología no es el único campo que utiliza la datación por radiocarbono. Las fechas de radiocarbono también se pueden usar en estudios de geología, sedimentología y lagos, por ejemplo. La capacidad de datar muestras diminutas usando AMS ha significado que los paleobotánicos y los paleoclimatólogos pueden usar la datación por radiocarbono directamente en polen purificado de secuencias de sedimentos, o en pequeñas cantidades de material vegetal o carbón vegetal. Las fechas de material orgánico recuperado de los estratos de interés se pueden utilizar para correlacionar los estratos en diferentes lugares que parecen ser similares en términos geológicos. El material de datación de una ubicación brinda información de fecha sobre la otra ubicación, y las fechas también se utilizan para ubicar los estratos en la línea de tiempo geológica general.
El radiocarbono también se usa para datar el carbono liberado de los ecosistemas, particularmente para monitorear la liberación de carbono antiguo que se almacenó previamente en los suelos como resultado de la perturbación humana o el cambio climático. Los avances recientes en las técnicas de recolección de campo también permiten la datación por radiocarbono del metano y el dióxido de carbono, que son importantes gases de efecto invernadero.
Aplicaciones notables
Límite Pleistoceno/Holoceno en Two Creeks Fossil Forest
El Pleistoceno es una época geológica que comenzó hace unos 2,6 millones de años. El Holoceno, la época geológica actual, comienza hace unos 11.700 años cuando finaliza el Pleistoceno. Establecer la fecha de este límite, que está definido por un fuerte calentamiento climático, con la mayor precisión posible ha sido un objetivo de los geólogos durante gran parte del siglo XX. En Two Creeks, en Wisconsin, se descubrió un bosque fósil (Área Natural Estatal del Bosque Enterrado de Two Creeks), y la investigación posterior determinó que la destrucción del bosque fue causada por el avance del hielo de Valders, el último movimiento de hielo hacia el sur antes del final de el Pleistoceno en esa zona. Antes del advenimiento de la datación por radiocarbono, los árboles fosilizados habían sido fechados mediante la correlación de secuencias de capas de sedimentos depositadas anualmente en Two Creeks con secuencias en Escandinavia. Esto llevó a estimaciones de que los árboles tenían entre 24.000 y 19.000 años y, por lo tanto, se tomó como la fecha del último avance de la glaciación de Wisconsin antes de que su retirada final marcara el final del Pleistoceno en América del Norte. En 1952, Libby publicó fechas de radiocarbono para varias muestras del sitio Two Creeks y dos sitios similares cercanos; las fechas se promediaron a 11.404 AP con un error estándar de 350 años. Este resultado no estaba calibrado, ya que aún no se entendía la necesidad de calibrar las edades de radiocarbono. Otros resultados durante la próxima década respaldaron una fecha promedio de 11.350 BP, y se cree que los resultados son los más precisos con un promedio de 11.600 BP. Hubo resistencia inicial a estos resultados por parte de Ernst Antevs, el paleobotánico que había trabajado en la serie de varvas escandinavas, pero sus objeciones finalmente fueron descartadas por otros geólogos. En la década de 1990, las muestras se analizaron con AMS, arrojando fechas (sin calibrar) que van desde 11.640 AP hasta 11.800 AP, ambas con un error estándar de 160 años. Posteriormente, una muestra del bosque fósil se utilizó en una prueba interlaboratorio, con resultados proporcionados por más de 70 laboratorios. Estas pruebas produjeron una edad media de 11 788 ± 8 BP (confianza de 2σ) que, cuando se calibra, da un rango de fechas de 13 730 a 13 550 cal BP. Las fechas de radiocarbono de Two Creeks ahora se consideran un resultado clave en el desarrollo de la comprensión moderna de la glaciación de América del Norte al final del Pleistoceno.
Pergaminos del Mar Muerto
En 1947, se descubrieron rollos en cuevas cerca del Mar Muerto que contenían escritos en hebreo y arameo, la mayoría de los cuales se cree que fueron producidos por los esenios, una pequeña secta judía. Estos rollos son de gran importancia en el estudio de los textos bíblicos porque muchos de ellos contienen la versión más antigua conocida de los libros de la biblia hebrea. Libby incluyó una muestra del envoltorio de lino de uno de estos rollos, el Gran Rollo de Isaías, en un análisis de 1955, con una edad estimada de 1917 ± 200 años. Sobre la base de un análisis del estilo de escritura, se hicieron estimaciones paleográficas de la edad de 21 de los rollos, y dos laboratorios de AMS analizaron muestras de la mayoría de estos, junto con otros rollos que no habían sido fechados paleográficamente, en la década de 1990. Los resultados variaron en edad desde principios del siglo IV a. C. hasta mediados del siglo IV d. En todos los casos, excepto en dos, se determinó que los rollos estaban dentro de los 100 años de la edad determinada paleográficamente. El rollo de Isaías se incluyó en la prueba y se encontró que tenía dos intervalos de fechas posibles con un nivel de confianza de 2σ, debido a la forma de la curva de calibración en ese punto: hay un 15 % de probabilidad de que data del 355 al 295 a. y una probabilidad del 84% de que data del 210 al 45 a. Posteriormente, estas fechas fueron criticadas con el argumento de que antes de probar los rollos, se habían tratado con aceite de ricino moderno para facilitar la lectura de la escritura; se argumentó que si no se eliminara el aceite de ricino lo suficiente, los dátiles serían demasiado jóvenes. Se han publicado varios artículos que apoyan y se oponen a las críticas.
Impacto
Poco después de la publicación del artículo de Libby de 1949 en Science, las universidades de todo el mundo comenzaron a establecer laboratorios de datación por radiocarbono y, a fines de la década de 1950, había más de 20 activos 14
C laboratorios de investigación. Rápidamente se hizo evidente que los principios de la datación por radiocarbono eran válidos, a pesar de ciertas discrepancias, cuyas causas seguían siendo desconocidas.
El desarrollo de la datación por radiocarbono ha tenido un profundo impacto en la arqueología, a menudo descrito como la "revolución del radiocarbono". En palabras del antropólogo R. E. Taylor, "14
C los datos crearon un mundo la prehistoria es posible aportando una escala temporal que trasciende las fronteras locales, regionales y continentales". Proporciona una datación más precisa dentro de los sitios que los métodos anteriores, que generalmente se derivan de la estratigrafía o de las tipologías (por ejemplo, de herramientas de piedra o cerámica); también permite la comparación y sincronización de eventos a través de grandes distancias. El advenimiento de la datación por radiocarbono incluso puede haber llevado a mejores métodos de campo en arqueología, ya que un mejor registro de datos conduce a una asociación más firme de los objetos con las muestras que se van a analizar. Estos métodos de campo mejorados a veces estaban motivados por intentos de probar que un 14
C la fecha era incorrecta. Taylor también sugiere que la disponibilidad de información de fechas definitivas liberó a los arqueólogos de la necesidad de concentrar gran parte de su energía en determinar las fechas de sus hallazgos y condujo a una expansión de las preguntas que los arqueólogos estaban dispuestos a investigar. Por ejemplo, desde la década de 1970, las preguntas sobre la evolución del comportamiento humano se vieron con mucha más frecuencia en la arqueología.
El marco de datación proporcionado por el radiocarbono condujo a un cambio en la visión predominante de cómo las innovaciones se extendieron por la Europa prehistórica. Los investigadores habían pensado anteriormente que muchas ideas se difundían por difusión a través del continente, o por invasiones de pueblos que traían consigo nuevas ideas culturales. A medida que las fechas de radiocarbono comenzaron a demostrar que estas ideas eran erróneas en muchos casos, se hizo evidente que estas innovaciones a veces debían haber surgido localmente. Esto ha sido descrito como una "segunda revolución de radiocarbono", y con respecto a la prehistoria británica, el arqueólogo Richard Atkinson ha caracterizado el impacto de la datación por radiocarbono como "terapia... radical" por la "enfermedad progresiva del invasionismo". En términos más generales, el éxito de la datación por radiocarbono estimuló el interés en los enfoques analíticos y estadísticos de los datos arqueológicos. Taylor también ha descrito el impacto de AMS y la capacidad de obtener mediciones precisas a partir de muestras muy pequeñas, como el comienzo de una tercera revolución de radiocarbono.
Ocasionalmente, las técnicas de datación por radiocarbono fechan un objeto de interés popular, por ejemplo, la Sábana Santa de Turín, una pieza de tela de lino que algunos creen que tiene una imagen de Jesucristo después de su crucifixión. Tres laboratorios separados fecharon muestras de lino de la Sábana Santa en 1988; los resultados apuntaron a los orígenes del siglo XIV, lo que generó dudas sobre la autenticidad del sudario como una supuesta reliquia del siglo I.
Los investigadores han estudiado otros isótopos radiactivos creados por los rayos cósmicos para determinar si también podrían usarse para asistir en la datación de objetos de interés arqueológico; tales isótopos incluyen 3He, 10Be, 21Ne, 26Al y 36Cl. Con el desarrollo de AMS en la década de 1980, fue posible medir estos isótopos con la precisión suficiente para que fueran la base de técnicas de datación útiles, que se han aplicado principalmente a la datación de rocas. Los isótopos radiactivos naturales también pueden formar la base de los métodos de datación, como la datación con potasio-argón, la datación con argón-argón y la datación con series de uranio. Otras técnicas de datación de interés para los arqueólogos incluyen la termoluminiscencia, la luminiscencia estimulada ópticamente, la resonancia de espín de electrones y la datación de huellas de fisión, así como técnicas que dependen de bandas o capas anuales, como la dendrocronología, la tefrocronología y la cronología de varvas.
Contenido relacionado
Colinas del puerto
Museo de Antropología de la UBC
Retrogresión y degradación del suelo