Cruce cromosómico

Cruce cromosómico, o entrecruzamiento, es el intercambio de material genético durante la reproducción sexual entre dos cromosomas homólogos' cromátidas no hermanas que dan como resultado cromosomas recombinantes. Es una de las fases finales de la recombinación genética, que ocurre en la etapa de paquiteno de la profase I de la meiosis durante un proceso llamado sinapsis. La sinapsis comienza antes de que se desarrolle el complejo sinaptonemal y no se completa hasta cerca del final de la profase I. El cruce generalmente ocurre cuando las regiones coincidentes en los cromosomas coincidentes se rompen y luego se vuelven a conectar con el otro cromosoma.
El cruce fue descrito, en teoría, por Thomas Hunt Morgan. Se basó en el descubrimiento de Frans Alfons Janssens, quien describió el fenómeno en 1909 y lo llamó "chiasmatypie". El término quiasma está vinculado, si no es idéntico, al cruce cromosómico. Morgan vio de inmediato la gran importancia de Janssens' interpretación citológica de los quiasmas a los resultados experimentales de su investigación sobre la herencia de Drosophila. La base física del cruce fue demostrada por primera vez por Harriet Creighton y Barbara McClintock en 1931.
La frecuencia vinculada de entrecruzamiento entre dos genes loci (marcadores) es el valor de entrecruzamiento. Para un conjunto fijo de condiciones genéticas y ambientales, la recombinación en una región particular de una estructura de enlace (cromosoma) tiende a ser constante y lo mismo ocurre con el valor de entrecruzamiento que se utiliza en la producción de mapas genéticos.
Orígenes
Hay dos teorías populares y superpuestas que explican los orígenes del entrecruzamiento, provenientes de las diferentes teorías sobre el origen de la meiosis. La primera teoría se basa en la idea de que la meiosis evolucionó como otro método de reparación del ADN y, por lo tanto, el entrecruzamiento es una forma novedosa de reemplazar secciones de ADN posiblemente dañadas. La segunda teoría proviene de la idea de que la meiosis evolucionó a partir de la transformación bacteriana, con la función de propagar la diversidad. En 1931, Barbara McClintock descubrió una planta de maíz triploide. Hizo hallazgos clave con respecto al cariotipo del maíz, incluido el tamaño y la forma de los cromosomas. McClintock usó las etapas de profase y metafase de la mitosis para describir la morfología de los cromosomas del maíz, y luego mostró la primera demostración citológica de entrecruzamiento en la meiosis. Trabajando con la estudiante Harriet Creighton, McClintock también hizo contribuciones significativas a la comprensión temprana de la codependencia de los genes vinculados.
Teoría de la reparación del ADN
El entrecruzamiento y la reparación del ADN son procesos muy similares, que utilizan muchos de los mismos complejos proteicos. En su informe, 'La importancia de las respuestas del genoma al desafío', McClintock estudió el maíz para mostrar cómo cambiaría el genoma del maíz para superar las amenazas a su supervivencia. Usó 450 plantas autopolinizadas que recibieron de cada progenitor un cromosoma con un extremo roto. Usó patrones modificados de expresión génica en diferentes sectores de las hojas de sus plantas de maíz para mostrar que los elementos transponibles ('elementos de control') se esconden en el genoma, y su movilidad les permite alterar la acción de los genes en diferentes lugares Estos elementos también pueden reestructurar el genoma, desde unos pocos nucleótidos hasta segmentos completos de cromosomas. Las recombinasas y las primasas sientan las bases de los nucleótidos a lo largo de la secuencia de ADN. Uno de esos complejos proteicos particulares que se conserva entre procesos es RAD51, una proteína recombinasa bien conservada que ha demostrado ser crucial en la reparación del ADN, así como en el cruce. Varios otros genes en D. melanogaster también se han relacionado con ambos procesos, al mostrar que los mutantes en estos loci específicos no pueden reparar el ADN o cruzarse. Dichos genes incluyen mei-41, mei-9, hdm, spnA y brca2. Este gran grupo de genes conservados entre procesos apoya la teoría de una estrecha relación evolutiva. Además, se ha descubierto que la reparación y el entrecruzamiento del ADN favorecen regiones similares en los cromosomas. En un experimento que utilizó el mapeo de híbridos de radiación en el cromosoma 3B del trigo (Triticum aestivum L.), se encontró que el entrecruzamiento y la reparación del ADN ocurrían predominantemente en las mismas regiones. Además, se ha correlacionado que el entrecruzamiento ocurre en respuesta a condiciones estresantes y probablemente dañinas para el ADN.
Enlaces a la transformación bacteriana
El proceso de transformación bacteriana también comparte muchas similitudes con el cruce cromosómico, particularmente en la formación de salientes en los lados de la hebra de ADN rota, lo que permite la hibridación de una nueva hebra. La propia transformación bacteriana se ha relacionado muchas veces con la reparación del ADN. La segunda teoría proviene de la idea de que la meiosis evolucionó a partir de la transformación bacteriana, con la función de propagar la diversidad genética. Por lo tanto, esta evidencia sugiere que se trata de si el cruce está relacionado con la reparación del ADN o la transformación bacteriana, ya que los dos no parecen ser mutuamente excluyentes. Es probable que el entrecruzamiento haya evolucionado a partir de la transformación bacteriana, que a su vez se desarrolló a partir de la reparación del ADN, lo que explica los vínculos entre los tres procesos.
Química
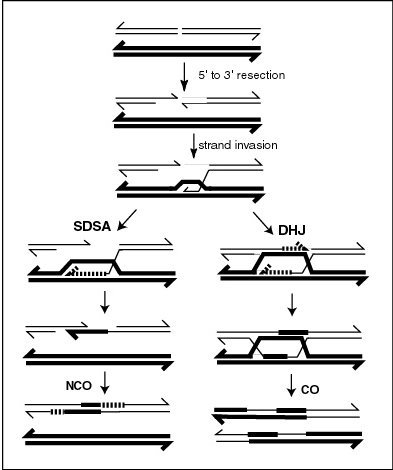
La recombinación meiótica puede iniciarse mediante roturas de doble cadena que se introducen en el ADN mediante la exposición a agentes que dañan el ADN o la proteína Spo11. Luego, una o más exonucleasas digieren el 5' extremos generados por las roturas de doble cadena para producir 3' colas de ADN monocatenario (ver diagrama). La recombinasa específica de meiosis Dmc1 y la recombinasa general Rad51 recubren el ADN monocatenario para formar filamentos de nucleoproteína. Las recombinasas catalizan la invasión de la cromátida opuesta por el ADN monocatenario de un extremo de la ruptura. A continuación, el 3' El extremo del ADN invasor prepara la síntesis de ADN, provocando el desplazamiento de la hebra complementaria, que posteriormente se hibrida con el ADN monocatenario generado a partir del otro extremo de la ruptura inicial de la doble hebra. La estructura resultante es un intercambio de hebras cruzadas, también conocida como unión de Holliday. El contacto entre dos cromátidas que pronto se cruzarán se conoce como quiasma. El cruce de Holliday es una estructura tetraédrica que se puede 'jalar' por otras recombinasas, moviéndolo a lo largo de la estructura de cuatro cadenas.
MSH4 y MSH5
Las proteínas MSH4 y MSH5 forman una estructura heterooligomérica (heterodímero) en levaduras y humanos. En la levadura Saccharomyces cerevisiae, MSH4 y MSH5 actúan específicamente para facilitar los entrecruzamientos entre cromosomas homólogos durante la meiosis. El complejo MSH4/MSH5 se une y estabiliza las uniones Holliday dobles y promueve su resolución en productos cruzados. Un mutante hipomórfico (parcialmente funcional) MSH4 de S. cerevisiae mostró una reducción del 30% en todo el genoma en el número de cruces y una gran cantidad de meiosis con cromosomas sin intercambio. No obstante, este mutante dio lugar a patrones de viabilidad de las esporas que sugerían que la segregación de los cromosomas sin intercambio se producía de forma eficaz. Así en S. cerevisiae la segregación apropiada aparentemente no depende enteramente de cruces entre pares homólogos.
Quiasma
El saltamontes Melanoplus femur-rubrum se expuso a una dosis aguda de rayos X durante cada etapa individual de la meiosis y se midió la frecuencia del quiasma. Se encontró que la irradiación durante las etapas de leptoteno-cigoteno de la meiosis (es decir, antes del período de paquiteno en el que se produce la recombinación cruzada) aumenta la frecuencia de quiasma subsiguiente. De manera similar, en el saltamontes Chorthippus brunneus, la exposición a la radiación X durante las etapas de cigoteno-paquiteno temprano provocó un aumento significativo en la frecuencia media del quiasma celular. La frecuencia de quiasma se puntuó en las etapas posteriores de diploteno-diacinesis de la meiosis. Estos resultados sugieren que los rayos X inducen daños en el ADN que se reparan mediante una vía cruzada que conduce a la formación de quiasmas.
Crossovers Clase I y Clase II
Las roturas de doble cadena (DSB) se reparan mediante dos vías para generar entrecruzamientos en eucariotas. La mayoría de ellos son reparados por los homólogos de MutL MLH1 y MLH3, lo que define los cruces de clase I. Los restantes son el resultado de la vía de clase II, que está regulada por la endonucleasa MUS81. Existen interconexiones entre estas dos vías: los cruces de clase I pueden compensar la pérdida de la vía de clase II. En ratones knockout para MUS81, los entrecruzamientos de clase I son elevados, mientras que los recuentos de entrecruzamientos totales en los quiasmas son normales. Sin embargo, los mecanismos que subyacen a esta diafonía no se conocen bien. Un estudio reciente sugiere que una proteína de andamiaje llamada SLX4 puede participar en esta regulación. Específicamente, los ratones knockout SLX4 fenocopian en gran medida el knockout MUS81, una vez más, un cruce de clase I elevado mientras que el recuento de quiasmas es normal.
Consecuencias
En la mayoría de los eucariotas, una célula porta dos versiones de cada gen, cada una denominada alelo. Cada padre transmite un alelo a cada descendiente. Un gameto individual hereda un complemento haploide completo de alelos en los cromosomas que se seleccionan independientemente de cada par de cromátidas alineadas en la placa metafásica. Sin la recombinación, todos los alelos de esos genes unidos en el mismo cromosoma se heredarían juntos. La recombinación meiótica permite una segregación más independiente entre los dos alelos que ocupan las posiciones de genes únicos, ya que la recombinación baraja el contenido de alelos entre los cromosomas homólogos.
La recombinación da como resultado una nueva disposición de alelos maternos y paternos en el mismo cromosoma. Aunque los mismos genes aparecen en el mismo orden, algunos alelos son diferentes. De esta forma, es teóricamente posible tener cualquier combinación de alelos parentales en una descendencia, y el hecho de que dos alelos aparezcan juntos en una descendencia no tiene ninguna influencia sobre la probabilidad estadística de que otra descendencia tenga la misma combinación. Este principio de "surtido independiente" de los genes es fundamental para la herencia genética. Sin embargo, la frecuencia de recombinación en realidad no es la misma para todas las combinaciones de genes. Esto lleva a la noción de "distancia genética", que es una medida de la frecuencia de recombinación promediada sobre una muestra (adecuadamente grande) de pedigríes. En términos generales, se puede decir que esto se debe a que la recombinación está muy influenciada por la proximidad de un gen a otro. Si dos genes están ubicados juntos en un cromosoma, la probabilidad de que un evento de recombinación separe estos dos genes es menor que si estuvieran más separados. El ligamiento genético describe la tendencia de los genes a ser heredados juntos como resultado de su ubicación en el mismo cromosoma. El desequilibrio de ligamiento describe una situación en la que algunas combinaciones de genes o marcadores genéticos ocurren con mayor o menor frecuencia en una población de lo que cabría esperar dadas las distancias que los separan. Este concepto se aplica cuando se busca un gen que pueda causar una enfermedad en particular. Esto se hace comparando la aparición de una secuencia de ADN específica con la aparición de una enfermedad. Cuando se encuentra una alta correlación entre los dos, es probable que la secuencia genética apropiada sea realmente más cercana.
Cruce no homólogo
Por lo general, los entrecruzamientos ocurren entre regiones homólogas de cromosomas coincidentes, pero las similitudes en la secuencia y otros factores pueden dar como resultado alineaciones no coincidentes. La mayor parte del ADN se compone de secuencias de pares de bases repetidas un gran número de veces. Estos segmentos repetitivos, a menudo denominados satélites, son bastante homogéneos entre especies. Durante la replicación del ADN, cada cadena de ADN se utiliza como plantilla para la creación de nuevas cadenas utilizando un mecanismo parcialmente conservado; el funcionamiento adecuado de este proceso da como resultado dos cromosomas emparejados idénticos, a menudo llamados hermanos. Se sabe que los eventos de cruce de cromátidas hermanas ocurren a un ritmo de varios eventos de cruce por célula por división en eucariotas. La mayoría de estos eventos involucran un intercambio de cantidades iguales de información genética, pero pueden ocurrir intercambios desiguales debido a un desajuste de secuencia. Estos se conocen con una variedad de nombres, que incluyen cruce no homólogo, cruce desigual y recombinación desequilibrada, y dan como resultado una inserción o eliminación de información genética en el cromosoma. Si bien son raras en comparación con los eventos cruzados homólogos, estas mutaciones son drásticas y afectan a muchos loci al mismo tiempo. Se consideran el principal impulsor detrás de la generación de duplicaciones de genes y son una fuente general de mutación dentro del genoma.
Se desconocen las causas específicas de los eventos cruzados no homólogos, pero se sabe que varios factores influyentes aumentan la probabilidad de un cruce desigual. Un vector común que conduce a una recombinación desequilibrada es la reparación de roturas de doble cadena (DSB). Los DSB a menudo se reparan mediante la reparación dirigida por homología, un proceso que implica la invasión de una cadena de plantilla por parte de la cadena DSB (consulte la figura a continuación). Las regiones homólogas cercanas de la hebra plantilla se utilizan a menudo para la reparación, lo que puede dar lugar a inserciones o deleciones en el genoma si se utiliza una parte no homóloga pero complementaria de la hebra plantilla. La similitud de secuencia es un factor importante en el cruce: es más probable que ocurran eventos de cruce en regiones largas de identidad cercana en un gen. Esto significa que cualquier sección del genoma con secciones largas de ADN repetitivo es propensa a eventos cruzados.
La presencia de elementos transponibles es otro elemento influyente del cruce no homólogo. Las regiones de código repetitivas caracterizan los elementos transponibles; Las regiones complementarias pero no homólogas son ubicuas dentro de los transposones. Debido a que las regiones cromosómicas compuestas de transposones tienen grandes cantidades de código idéntico y repetitivo en un espacio condensado, se cree que las regiones de transposones que experimentan un evento de cruce son más propensas a emparejamientos complementarios erróneos; es decir, una sección de un cromosoma que contiene muchas secuencias idénticas, si sufre un evento de entrecruzamiento, es menos probable que coincida con una sección perfectamente homóloga de código complementario y más propensa a unirse con una sección de código en un parte ligeramente diferente del cromosoma. Esto da como resultado una recombinación desequilibrada, ya que la información genética puede insertarse o eliminarse en el nuevo cromosoma, dependiendo de dónde ocurrió la recombinación.
Si bien los factores que motivan la recombinación desigual siguen siendo oscuros, se han aclarado los elementos del mecanismo físico. Las proteínas de reparación de errores de emparejamiento (MMR), por ejemplo, son una familia reguladora bien conocida de proteínas, responsables de regular las secuencias de ADN que no coinciden durante la replicación y la regulación de escape. El objetivo operativo de las MMR es la restauración del genotipo parental. Se sabe que una clase de MMR en particular, MutSβ, inicia la corrección de desajustes de inserción-deleción de hasta 16 nucleótidos. Se sabe poco sobre el proceso de escisión en eucariotas, pero E. coli las escisiones implican la división de una muesca en el 5' o 3' cadena, después de lo cual la ADN helicasa y la ADN polimerasa III se unen y generan proteínas monocatenarias, que son digeridas por exonucleasas y unidas a la cadena por ligasa. Múltiples vías de MMR se han implicado en el mantenimiento de la estabilidad del genoma de organismos complejos, y cualquiera de los muchos posibles fallos en la vía de MMR da como resultado errores de edición y corrección del ADN. Por lo tanto, aunque no se sabe con certeza qué mecanismos conducen a errores de cruce no homólogo, es muy probable que esté involucrada la vía MMR.
Contenido relacionado
Colocasia
Tirosina quinasa
Proteína





