Cromatografía líquida de alta resolución
La cromatografía líquida de alta resolución (HPLC), anteriormente conocida como cromatografía líquida de alta presión, es una técnica de química analítica utilizada para separar, identificar y cuantificar cada componente de una mezcla. Se basa en bombas para pasar un solvente líquido presurizado que contiene la mezcla de muestra a través de una columna llena con un material adsorbente sólido. Cada componente de la muestra interactúa de forma ligeramente diferente con el material adsorbente, lo que genera diferentes velocidades de flujo para los diferentes componentes y conduce a la separación de los componentes a medida que salen de la columna.
La HPLC se ha utilizado para la fabricación (p. ej., durante el proceso de producción de productos farmacéuticos y biológicos), legal (p. ej.,, detección de fármacos para mejorar el rendimiento en la orina), investigación (p.ej., separar los componentes de una muestra biológica compleja, o de productos químicos sintéticos similares entre sí) y médicos (p.ej., detectar niveles de vitamina D en suero sanguíneo).
La cromatografía se puede describir como un proceso de transferencia de masa que implica adsorción. HPLC se basa en bombas para pasar un líquido presurizado y una mezcla de muestra a través de una columna llena de adsorbente, lo que lleva a la separación de los componentes de la muestra. El componente activo de la columna, el adsorbente, suele ser un material granular hecho de partículas sólidas (por ejemplo,, sílice, polímeros, etc.), de 2 a 50 μm de tamaño. Los componentes de la mezcla de muestra se separan entre sí debido a sus diferentes grados de interacción con las partículas adsorbentes. El líquido presurizado suele ser una mezcla de disolventes (por ejemplo,, agua, acetonitrilo y/o metanol) y se denomina "fase móvil". Su composición y temperatura juegan un papel importante en el proceso de separación al influir en las interacciones que tienen lugar entre los componentes de la muestra y el adsorbente. Estas interacciones son de naturaleza física, como hidrofóbicas (dispersivas), dipolo-dipolo e iónicas, la mayoría de las veces una combinación.
La HPLC se distingue de la cromatografía líquida tradicional (de "baja presión") porque las presiones operativas son significativamente más altas (50 a 350 bar), mientras que la cromatografía líquida ordinaria generalmente se basa en la fuerza de la gravedad para pasar la fase móvil. a través de la columna. Debido a la pequeña cantidad de muestra separada en la HPLC analítica, las dimensiones típicas de la columna son de 2,1 a 4,6 mm de diámetro y de 30 a 250 mm de longitud. Además, las columnas de HPLC están hechas con partículas adsorbentes más pequeñas (de 2 a 50 μm de tamaño de partícula promedio). Esto le da a HPLC un poder de resolución superior (la capacidad de distinguir entre compuestos) al separar mezclas, lo que la convierte en una técnica cromatográfica popular.
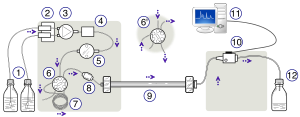
El esquema de un instrumento de HPLC suele incluir un desgasificador, un muestreador, bombas y un detector. El muestreador lleva la mezcla de muestra a la corriente de fase móvil que la lleva a la columna. Las bombas entregan el flujo y la composición deseados de la fase móvil a través de la columna. El detector genera una señal proporcional a la cantidad de componente de la muestra que emerge de la columna, lo que permite el análisis cuantitativo de los componentes de la muestra. Un microprocesador digital y un software de usuario controlan el instrumento de HPLC y proporcionan análisis de datos. Algunos modelos de bombas mecánicas en un instrumento de HPLC pueden mezclar varios disolventes en proporciones que cambian con el tiempo, generando un gradiente de composición en la fase móvil. Varios detectores son de uso común, como UV/Vis, matriz de fotodiodos (PDA) o basados en espectrometría de masas. La mayoría de los instrumentos de HPLC también tienen un horno de columna que permite ajustar la temperatura a la que se realiza la separación.
Operación
La mezcla de muestra que se va a separar y analizar se introduce en un pequeño volumen discreto (normalmente microlitros) en la corriente de fase móvil que se filtra a través de la columna. Los componentes de la muestra se mueven a través de la columna a diferentes velocidades, que son una función de las interacciones físicas específicas con el adsorbente (también llamada fase estacionaria). La velocidad de cada componente depende de su naturaleza química, de la naturaleza de la fase estacionaria (columna) y de la composición de la fase móvil. El tiempo en el que un analito específico eluye (emerge de la columna) se denomina tiempo de retención. El tiempo de retención medido en condiciones particulares es una característica de identificación de un analito dado.
Hay muchos tipos diferentes de columnas disponibles, llenas de adsorbentes que varían en tamaño de partícula, porosidad y química superficial. El uso de materiales de relleno de tamaño de partícula más pequeño requiere el uso de una presión operativa más alta ('contrapresión') y, por lo general, mejora la resolución cromatográfica (el grado de separación de picos entre analitos consecutivos que emergen de la columna). Las partículas absorbentes pueden ser de naturaleza hidrófoba o polar.
Las fases móviles comunes utilizadas incluyen cualquier combinación miscible de agua con varios solventes orgánicos (los más comunes son acetonitrilo y metanol). Algunas técnicas de HPLC utilizan fases móviles sin agua (consulte la cromatografía de fase normal a continuación). El componente acuoso de la fase móvil puede contener ácidos (como ácido fórmico, fosfórico o trifluoroacético) o sales para ayudar en la separación de los componentes de la muestra. La composición de la fase móvil se puede mantener constante ("modo de elución isocrático") o variar ("modo de elución en gradiente") durante el análisis cromatográfico. La elución isocrática suele ser eficaz en la separación de componentes de la muestra que son muy diferentes en su afinidad por la fase estacionaria. En la elución en gradiente, la composición de la fase móvil varía típicamente de fuerza de elución baja a alta. La fuerza de elución de la fase móvil se refleja en los tiempos de retención del analito con una alta fuerza de elución que produce una elución rápida (=tiempos de retención cortos). Un perfil de gradiente típico en la cromatografía de fase inversa podría comenzar con un 5 % de acetonitrilo (en agua o tampón acuoso) y progresar linealmente hasta un 95 % de acetonitrilo durante 5 a 25 minutos. Los periodos de composición de fase móvil constante pueden ser parte de cualquier perfil de gradiente. Por ejemplo, la composición de la fase móvil se puede mantener constante al 5 % de acetonitrilo durante 1 a 3 min, seguido de un cambio lineal hasta el 95 % de acetonitrilo.
La composición elegida de la fase móvil depende de la intensidad de las interacciones entre varios componentes de la muestra ("analitos") y la fase estacionaria (p. ej., interacciones hidrofóbicas en HPLC de fase reversa). Dependiendo de su afinidad por las fases estacionaria y móvil, los analitos se reparten entre las dos durante el proceso de separación que tiene lugar en la columna. Este proceso de partición es similar al que ocurre durante una extracción líquido-líquido pero es continuo, no escalonado. En este ejemplo, usando un gradiente de agua/acetonitrilo, más componentes hidrófobos eluirán (se desprenderán de la columna) tarde, una vez que la fase móvil se concentre más en acetonitrilo (es decir,, en una fase móvil de mayor elución). fortaleza).
La elección de los componentes de la fase móvil, los aditivos (como sales o ácidos) y las condiciones del gradiente dependen de la naturaleza de la columna y los componentes de la muestra. A menudo, se realiza una serie de pruebas con la muestra para encontrar el método de HPLC que proporcione la separación adecuada.
Historia y desarrollo
Antes de la HPLC, los científicos usaban técnicas estándar de cromatografía líquida. Los sistemas de cromatografía de líquidos eran en gran medida ineficaces debido a que el caudal de los disolventes dependía de la gravedad. Las separaciones tardaron muchas horas y, a veces, días en completarse. La cromatografía de gases (GC) en ese momento era más potente que la cromatografía líquida (LC); sin embargo, se creía que la separación de fases gaseosas y el análisis de biopolímeros muy polares de alto peso molecular eran imposibles. La GC resultó ineficaz para muchos bioquímicos debido a la inestabilidad térmica de los solutos. Como resultado, se formularon hipótesis sobre métodos alternativos que pronto darían como resultado el desarrollo de la HPLC.
Siguiendo el trabajo seminal de Martin y Synge en 1941, Calvin Giddings, Josef Huber y otros predijeron en la década de 1960 que la LC podría funcionar en el modo de alta eficiencia al reducir el diámetro de las partículas de empaque sustancialmente por debajo el nivel típico de LC (y GC) de 150 μm y usando presión para aumentar la velocidad de la fase móvil. Estas predicciones se sometieron a una extensa experimentación y refinamiento a lo largo de los años 60 y 70. Las primeras investigaciones de desarrollo comenzaron a mejorar las partículas de LC, y la invención de Zipax, una partícula superficialmente porosa, fue prometedora para la tecnología de HPLC.
La década de 1970 trajo muchos desarrollos en hardware e instrumentación. Los investigadores comenzaron a usar bombas e inyectores para hacer un diseño rudimentario de un sistema de HPLC. Las bombas amplificadoras de gas eran ideales porque operaban a presión constante y no requerían sellos sin fugas ni válvulas de retención para un flujo constante y una buena cuantificación. Se lograron hitos de hardware en Dupont IPD (División de Polímeros Industriales), como el uso de un dispositivo de gradiente de volumen de permanencia bajo, así como el reemplazo del inyector de septum con una válvula de inyección de bucle.
Si bien los desarrollos instrumentales fueron importantes, la historia de la HPLC se trata principalmente de la historia y la evolución de la tecnología de partículas. Después de la introducción de partículas de capa porosa, ha habido una tendencia constante a reducir el tamaño de las partículas para mejorar la eficiencia. Sin embargo, al disminuir el tamaño de partícula, surgieron nuevos problemas. Las desventajas prácticas surgen de la caída de presión excesiva necesaria para forzar el fluido móvil a través de la columna y la dificultad de preparar un relleno uniforme de materiales extremadamente finos. Cada vez que el tamaño de las partículas se reduce significativamente, generalmente debe ocurrir otra ronda de desarrollo del instrumento para manejar la presión.
Tipos
Cromatografía de partición
La cromatografía de partición fue uno de los primeros tipos de cromatografía que desarrollaron los químicos. El principio del coeficiente de partición se ha aplicado en cromatografía en papel, cromatografía en capa fina, aplicaciones de separación de fase gaseosa y líquido-líquido. El Premio Nobel de Química de 1952 fue ganado por Archer John Porter Martin y Richard Laurence Millington Synge por su desarrollo de la técnica, que se utilizó para la separación de aminoácidos. La cromatografía de partición utiliza un solvente retenido, en la superficie o dentro de los granos o fibras de un "inerte" matriz de soporte sólida como con cromatografía en papel; o aprovecha alguna interacción culómbica y/o donadora de hidrógeno con la fase estacionaria. Las moléculas del analito se reparten entre una fase estacionaria líquida y el eluyente. Al igual que en la cromatografía de interacción hidrofílica (HILIC, una subtécnica dentro de HPLC), este método separa los analitos en función de las diferencias en su polaridad. HILIC suele utilizar una fase estacionaria polar enlazada y una fase móvil compuesta principalmente de acetonitrilo con agua como componente fuerte. La HPLC de partición se ha utilizado históricamente en soportes de sílice o alúmina no unidos. Cada uno funciona eficazmente para separar analitos por diferencias polares relativas. Las fases enlazadas HILIC tienen la ventaja de separar solutos ácidos, básicos y neutros en una sola corrida cromatográfica.
Los analitos polares se difunden en una capa de agua estacionaria asociada con la fase estacionaria polar y, por lo tanto, se retienen. Cuanto más intensas sean las interacciones entre el analito polar y la fase estacionaria polar (en relación con la fase móvil), mayor será el tiempo de elución. La fuerza de interacción depende de los grupos funcionales que forman parte de la estructura molecular del analito, con grupos más polarizados (p. ej., hidroxilo-) y grupos capaces de formar puentes de hidrógeno que inducen una mayor retención. Las interacciones culómbicas (electrostáticas) también pueden aumentar la retención. El uso de disolventes más polares en la fase móvil disminuirá el tiempo de retención de los analitos, mientras que los disolventes más hidrofóbicos tienden a aumentar los tiempos de retención.
Cromatografía en fase normal
La cromatografía de fase normal fue uno de los primeros tipos de HPLC que desarrollaron los químicos. También conocido como HPLC de fase normal (NP-HPLC), este método separa los analitos en función de su afinidad por una superficie estacionaria polar como la sílice, por lo que se basa en la capacidad del analito para participar en interacciones polares (como enlaces de hidrógeno o dipolo). tipo dipolo de interacciones) con la superficie del adsorbente. La NP-HPLC utiliza una fase móvil no acuosa y no polar (p. ej., cloroformo) y funciona eficazmente para separar analitos fácilmente solubles en disolventes no polares. El analito se asocia y es retenido por la fase estacionaria polar. La fuerza de adsorción aumenta con el aumento de la polaridad del analito. La fuerza de interacción depende no solo de los grupos funcionales presentes en la estructura de la molécula del analito, sino también de factores estéricos. El efecto del impedimento estérico sobre la fuerza de interacción permite que este método resuelva (separe) los isómeros estructurales.
El uso de disolventes más polares en la fase móvil disminuirá el tiempo de retención de los analitos, mientras que los disolventes más hidrofóbicos tienden a inducir una elución más lenta (aumento del tiempo de retención). Los disolventes muy polares, como trazas de agua en la fase móvil, tienden a adsorberse en la superficie sólida de la fase estacionaria formando una capa de unión estacionaria (agua) que se considera que juega un papel activo en la retención. Este comportamiento es algo peculiar de la cromatografía de fase normal porque se rige casi exclusivamente por un mecanismo de adsorción (es decir,, los analitos interactúan con una superficie sólida en lugar de con la capa solvatada de un ligando adherido a la superficie adsorbente; véase también HPLC de fase inversa a continuación). La cromatografía de adsorción todavía se usa ampliamente para las separaciones de isómeros estructurales en formatos de cromatografía de columna y de capa fina sobre soportes de sílice o alúmina activados (secos).
La HPLC de partición y la NP-HPLC cayeron en desgracia en la década de 1970 con el desarrollo de la HPLC de fase inversa debido a la escasa reproducibilidad de los tiempos de retención debido a la presencia de una capa de agua o de disolvente orgánico prótico en la superficie de la sílice o medios cromatográficos de alúmina. Esta capa cambia con cualquier cambio en la composición de la fase móvil (por ejemplo,, el nivel de humedad), lo que provoca cambios en los tiempos de retención.
Recientemente, la cromatografía de partición ha vuelto a ser popular con el desarrollo de fases ligadas Hilic que demuestran una mejor reproducibilidad y debido a una mejor comprensión del rango de utilidad de la técnica.
Cromatografía de desplazamiento
El principio básico de la cromatografía de desplazamiento es: Una molécula con una alta afinidad por la matriz de cromatografía (el desplazador) competirá eficazmente por los sitios de unión y, por lo tanto, desplazará a todas las moléculas con menor afinidad. Existen claras diferencias entre la cromatografía de desplazamiento y la de elución. En el modo de elución, las sustancias suelen emerger de una columna en picos gaussianos estrechos. Se desea una amplia separación de los picos, preferiblemente hasta la línea de base, para lograr la máxima purificación. La velocidad a la que cualquier componente de una mezcla desciende por la columna en el modo de elución depende de muchos factores. Pero para que dos sustancias viajen a diferentes velocidades y, por lo tanto, se resuelvan, debe haber diferencias sustanciales en alguna interacción entre las biomoléculas y la matriz cromatográfica. Los parámetros operativos se ajustan para maximizar el efecto de esta diferencia. En muchos casos, la separación de la línea de base de los picos solo se puede lograr con elución en gradiente y cargas de columna bajas. Por lo tanto, dos inconvenientes de la cromatografía en modo de elución, especialmente a escala preparativa, son la complejidad operativa, debido al bombeo de disolvente en gradiente, y el bajo rendimiento, debido a las bajas cargas de columna. La cromatografía de desplazamiento tiene ventajas sobre la cromatografía de elución en que los componentes se resuelven en zonas consecutivas de sustancias puras en lugar de "picos". Debido a que el proceso aprovecha la no linealidad de las isotermas, se puede separar una alimentación de columna más grande en una columna dada con los componentes purificados recuperados a una concentración significativamente mayor.
Cromatografía de fase inversa (RPC)
La HPLC de fase inversa (RP-HPLC) tiene una fase estacionaria no polar y una fase móvil acuosa moderadamente polar. Una fase estacionaria común es una sílice cuya superficie ha sido modificada con RMe2SiCl, donde R es un grupo alquilo de cadena lineal como C18H37 o C8H17. Con tales fases estacionarias, el tiempo de retención es mayor para las moléculas que son menos polares, mientras que las moléculas polares eluyen más fácilmente (al principio del análisis). Un analista puede aumentar los tiempos de retención agregando más agua a la fase móvil; haciendo así que la afinidad del analito hidrofóbico por la fase estacionaria hidrofóbica sea más fuerte en relación con la fase móvil ahora más hidrofílica. De manera similar, un investigador puede disminuir el tiempo de retención agregando más solvente orgánico al eluyente. La RP-HPLC se usa con tanta frecuencia que a menudo se denomina incorrectamente "HPLC" sin más especificación. La industria farmacéutica emplea regularmente RP-HPLC para calificar los medicamentos antes de su lanzamiento.
RP-HPLC funciona según el principio de las interacciones hidrofóbicas, que se origina en la alta simetría de la estructura del agua dipolar y desempeña el papel más importante en todos los procesos de las ciencias de la vida. RP-HPLC permite la medición de estas fuerzas interactivas. La unión del analito a la fase estacionaria es proporcional al área de la superficie de contacto alrededor del segmento no polar de la molécula del analito tras la asociación con el ligando en la fase estacionaria. Este efecto solvofóbico está dominado por la fuerza del agua para la "reducción de caries" alrededor del analito y la cadena C18 versus el complejo de ambos. La energía liberada en este proceso es proporcional a la tensión superficial del eluyente (agua: 7,3×10−6 J/cm 2, metanol: 2,2×10−6 J/cm2) y a la superficie hidrófoba del analito y del ligando respectivamente. La retención se puede disminuir agregando un solvente menos polar (metanol, acetonitrilo) en la fase móvil para reducir la tensión superficial del agua. La elución de gradiente utiliza este efecto al reducir automáticamente la polaridad y la tensión superficial de la fase móvil acuosa durante el transcurso del análisis.
Las propiedades estructurales de la molécula del analito juegan un papel importante en sus características de retención. En general, un analito con un área de superficie hidrofóbica más grande (C–H, C–C y, en general, enlaces atómicos no polares, como S-S y otros) se retiene por más tiempo porque no interactúa con la estructura del agua. Por otro lado, los analitos con mayor área de superficie polar (conferida por la presencia de grupos polares, como -OH, -NH2, COO− o -NH3+ en su estructura) se retienen menos al estar mejor integrados en el agua. Tales interacciones están sujetas a efectos estéricos en el sentido de que las moléculas muy grandes pueden tener solo un acceso restringido a los poros de la fase estacionaria, donde tienen lugar las interacciones con los ligandos de la superficie (cadenas de alquilo). Dicho impedimento superficial normalmente da como resultado una menor retención.
El tiempo de retención aumenta con el área superficial hidrófoba (no polar). Los compuestos de cadena ramificada eluyen más rápidamente que sus correspondientes isómeros lineales porque el área superficial total disminuye. De manera similar, los compuestos orgánicos con enlaces C-C simples eluyen más tarde que aquellos con un enlace triple C=C o C-C, ya que el enlace doble o triple es más corto que un enlace C-C simple.
Además de la tensión superficial de la fase móvil (fuerza organizativa en la estructura del eluyente), otros modificadores de la fase móvil pueden afectar la retención de analitos. Por ejemplo, la adición de sales inorgánicas provoca un aumento lineal moderado de la tensión superficial de las soluciones acuosas (aprox. 1,5×10−7 J/cm2 por mol de NaCl, 2,5×10−7 J/cm 2 por Mol para (NH4)2SO4), y porque la entropía del analito-disolvente La interfaz está controlada por la tensión superficial, la adición de sales tiende a aumentar el tiempo de retención. Esta técnica se utiliza para la separación y recuperación suaves de proteínas y la protección de su actividad biológica en el análisis de proteínas (cromatografía de interacción hidrofóbica, HIC).
Otro factor importante es el pH de la fase móvil, ya que puede cambiar el carácter hidrofóbico del analito. Por esta razón, la mayoría de los métodos utilizan un agente amortiguador, como el fosfato de sodio, para controlar el pH. Los tampones sirven para múltiples propósitos: controlar el pH, neutralizar la carga en la superficie de sílice de la fase estacionaria y actuar como agentes de emparejamiento de iones para neutralizar la carga del analito. El formiato de amonio se agrega comúnmente en la espectrometría de masas para mejorar la detección de ciertos analitos mediante la formación de aductos de analito-amonio. Un ácido orgánico volátil como el ácido acético, o más comúnmente el ácido fórmico, a menudo se agrega a la fase móvil si se usa espectrometría de masas para analizar el eluyente de la columna. El ácido trifluoroacético se usa con poca frecuencia en aplicaciones de espectrometría de masas debido a su persistencia en el detector y en el sistema de administración de solventes, pero puede ser eficaz para mejorar la retención de analitos como los ácidos carboxílicos en aplicaciones que utilizan otros detectores, ya que es un ácido orgánico bastante fuerte. Los efectos de los ácidos y los tampones varían según la aplicación, pero generalmente mejoran la resolución cromatográfica.
Las columnas de fase reversa son bastante difíciles de dañar en comparación con las columnas de sílice normales; sin embargo, muchas columnas de fase reversa consisten en partículas de sílice derivatizadas con alquilo y nunca deben usarse con bases acuosas, ya que destruirán la partícula de sílice subyacente. Se pueden usar con ácido acuoso, pero la columna no debe exponerse al ácido por mucho tiempo, ya que puede corroer las partes metálicas del equipo de HPLC. Las columnas de RP-HPLC deben enjuagarse con un solvente limpio después de su uso para eliminar los ácidos o tampones residuales y almacenarse en una composición adecuada de solvente. El contenido de metal de las columnas de HPLC debe mantenerse bajo si se quiere conservar la mejor capacidad posible para separar sustancias. Una buena prueba para el contenido de metal de una columna es inyectar una muestra que sea una mezcla de 2,2'- y 4,4'-bipiridina. Debido a que el 2,2'-bipy puede quelar el metal, la forma del pico del 2,2'-bipy se distorsionará (cola) cuando los iones metálicos estén presentes en la superficie de la sílice...
Cromatografía de exclusión por tamaño
La cromatografía de exclusión por tamaño (SEC), también conocida como cromatografía de permeación en gel o cromatografía de filtración en gel, separa las partículas en función del tamaño molecular (en realidad, por tamaño de partícula). 39; s Stokes radio). Generalmente es una cromatografía de baja resolución y, por lo tanto, a menudo se reserva para el "pulido" paso de la purificación. También es útil para determinar la estructura terciaria y la estructura cuaternaria de proteínas purificadas. SEC se utiliza principalmente para el análisis de moléculas grandes como proteínas o polímeros. SEC funciona atrapando estas moléculas más pequeñas en los poros de una partícula. Las moléculas más grandes simplemente pasan por los poros ya que son demasiado grandes para entrar en los poros. Por lo tanto, las moléculas más grandes fluyen a través de la columna más rápido que las moléculas más pequeñas, es decir, cuanto más pequeña es la molécula, mayor es el tiempo de retención.
Esta técnica es ampliamente utilizada para la determinación del peso molecular de los polisacáridos. SEC es la técnica oficial (sugerida por la farmacopea europea) para la comparación del peso molecular de diferentes heparinas de bajo peso molecular disponibles comercialmente.
Cromatografía de intercambio iónico
En la cromatografía de intercambio iónico (IC), la retención se basa en la atracción entre los iones del soluto y los sitios cargados unidos a la fase estacionaria. Los iones de soluto de la misma carga que los sitios cargados de la columna se excluyen de la unión, mientras que los iones de soluto de la carga opuesta a los sitios cargados de la columna se retienen en la columna. Los iones de soluto que se retienen en la columna se pueden eluir de la columna cambiando las condiciones del solvente (por ejemplo,, aumentando el efecto iónico del sistema solvente al aumentar la concentración de sal de la solución, aumentando la temperatura de la columna, cambiando el pH del solvente, etc.).
Los tipos de intercambiadores de iones incluyen resinas de poliestireno, intercambiadores de iones de celulosa y dextrano (geles) y vidrio de poro controlado o sílice porosa. Las resinas de poliestireno permiten el entrecruzamiento lo que aumenta la estabilidad de la cadena. Una mayor reticulación reduce el desvío, lo que aumenta el tiempo de equilibrio y, en última instancia, mejora la selectividad. Los intercambiadores de iones de celulosa y dextrano poseen tamaños de poro más grandes y densidades de carga bajas, lo que los hace adecuados para la separación de proteínas.
En general, los intercambiadores de iones favorecen la unión de iones de mayor carga y menor radio.
Un aumento en la concentración de contraiones (con respecto a los grupos funcionales en las resinas) reduce el tiempo de retención. Una disminución del pH reduce el tiempo de retención en el intercambio catiónico, mientras que un aumento del pH reduce el tiempo de retención en el intercambio aniónico. Al disminuir el pH del solvente en una columna de intercambio catiónico, por ejemplo, más iones de hidrógeno están disponibles para competir por posiciones en la fase estacionaria aniónica, eluyendo así los cationes débilmente unidos.
Esta forma de cromatografía se usa ampliamente en las siguientes aplicaciones: purificación de agua, preconcentración de componentes traza, cromatografía de intercambio de ligandos, cromatografía de intercambio iónico de proteínas, cromatografía de intercambio aniónico de alto pH de carbohidratos y oligosacáridos, y otras.
Cromatografía de bioafinidad
Este proceso cromatográfico se basa en la propiedad de las sustancias biológicamente activas para formar complejos estables, específicos y reversibles. La formación de estos complejos involucra la participación de fuerzas moleculares comunes como la interacción de Van der Waals, la interacción electrostática, la interacción dipolo-dipolo, la interacción hidrofóbica y el enlace de hidrógeno. Un enlace bioespecífico eficiente se forma mediante una acción simultánea y concertada de varias de estas fuerzas en los sitios de unión complementarios.
Cromatografía acuosa en fase normal
La cromatografía de fase normal acuosa (ANP) es una técnica cromatográfica que abarca la región de la fase móvil entre la cromatografía de fase inversa (RP) y la cromatografía de fase normal orgánica (ONP). Esta técnica se utiliza para lograr una selectividad única para los compuestos hidrófilos, mostrando una elución de fase normal utilizando disolventes de fase inversa.
Elución isocrática y en gradiente
Una separación en la que la composición de la fase móvil permanece constante durante todo el procedimiento se denomina isocrática (que significa composición constante). (El ejemplo de estos el porcentaje de metanol durante todo el procedimiento se mantendrá constante, es decir, 10%) La palabra fue acuñada por Csaba Horvath, quien fue uno de los pioneros de HPLC.,
La composición de la fase móvil no tiene por qué permanecer constante. Una separación en la que la composición de la fase móvil cambia durante el proceso de separación se describe como una elución en gradiente. Un ejemplo es un gradiente que comienza con 10 % de metanol y termina con 90 % de metanol después de 20 minutos. Los dos componentes de la fase móvil normalmente se denominan "A" y "B"; A es el "débil" disolvente que permite que el soluto eluya lentamente, mientras que B es el "fuerte" disolvente que eluye rápidamente los solutos de la columna. En la cromatografía de fase inversa, el disolvente A suele ser agua o un tampón acuoso, mientras que B es un disolvente orgánico miscible con agua, como acetonitrilo, metanol, THF o isopropanol..
En la elución isocrática, el ancho del pico aumenta linealmente con el tiempo de retención de acuerdo con la ecuación para N, el número de platos teóricos. Esto puede ser una gran desventaja cuando se analiza una muestra que contiene analitos con una amplia gama de factores de retención. Al usar una fase móvil más débil, el tiempo de ejecución se alarga y da como resultado que los picos de elución lenta sean amplios, lo que reduce la sensibilidad. Una fase móvil más fuerte mejoraría los problemas de tiempo de ejecución y la ampliación de picos posteriores, pero da como resultado una menor separación de picos, especialmente para analitos de elución rápida que pueden tener tiempo insuficiente para resolverse por completo. Este problema se soluciona cambiando la composición de la fase móvil de la elución en gradiente.
Al comenzar a partir de una fase móvil más débil y fortalecerla durante el tiempo de ejecución, la elución en gradiente disminuye la retención de los componentes que eluyen más tarde para que eluyan más rápido, dando picos más estrechos (y más altos) para la mayoría de los componentes, al mismo tiempo que permite la separación adecuada de los componentes de elución anterior. Esto también mejora la forma del pico para los picos con cola, ya que la concentración creciente del eluyente orgánico empuja hacia adelante la parte de la cola de un pico. Esto también aumenta la altura del pico (el pico parece "más nítido"), lo cual es importante en el análisis de trazas. El programa de gradiente puede incluir "pasos" aumentos en el porcentaje del componente orgánico, o diferentes pendientes en diferentes tiempos, todo de acuerdo con el deseo de una separación óptima en un tiempo mínimo.
En la elución isocrática, la selectividad no cambia si cambian las dimensiones de la columna (longitud y diámetro interno); es decir, los picos eluyen en el mismo orden. En la elución en gradiente, el orden de elución puede cambiar a medida que cambian las dimensiones o el caudal.
La fuerza impulsora en la cromatografía de fase reversa se origina en el orden superior de la estructura del agua. El papel del componente orgánico de la fase móvil es reducir este alto orden y, por lo tanto, reducir la fuerza retardante del componente acuoso.
Parámetros
Teórico
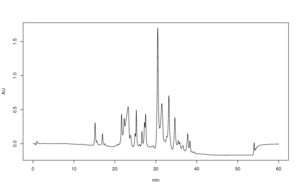
Las separaciones de HPLC tienen parámetros teóricos y ecuaciones para describir la separación de componentes en picos de señal cuando se detectan mediante instrumentación, como un detector UV o un espectrómetro de masas. Los parámetros se derivan en gran medida de dos conjuntos de teoría cromatográfica: la teoría de placas (como parte de la cromatografía de partición) y la teoría de velocidad de la cromatografía/ecuación de Van Deemter. Por supuesto, se pueden poner en práctica mediante el análisis de cromatogramas de HPLC, aunque la teoría de velocidad se considera la teoría más precisa.
Son análogos al cálculo del factor de retención para una separación por cromatografía en papel, pero describen qué tan bien HPLC separa una mezcla en dos o más componentes que se detectan como picos (bandas) en un cromatograma. Los parámetros de HPLC son el factor de eficiencia (N), el factor de retención (primo kappa) y el factor de separación (alfa). Juntos, los factores son variables en una ecuación de resolución, que describe qué tan bien dos componentes' picos separados o superpuestos entre sí. En su mayoría, estos parámetros solo se utilizan para describir las separaciones de fase inversa de HPLC y de fase normal de HPLC, ya que esas separaciones tienden a ser más sutiles que otros modos de HPLC (por ejemplo,, intercambio iónico y exclusión por tamaño).
El volumen vacío es la cantidad de espacio en una columna que está ocupado por solvente. Es el espacio dentro de la columna que está fuera del material de empaque interno de la columna. El volumen vacío se mide en un cromatograma a medida que se detecta el pico del primer componente, que suele ser el disolvente que estaba presente en la mezcla de muestra; idealmente, el solvente de la muestra fluye a través de la columna sin interactuar con la columna, pero aún es detectable a diferencia del solvente de HPLC. El volumen vacío se utiliza como factor de corrección.
El factor de eficiencia (N) mide prácticamente qué tan nítidos son los picos de los componentes en el cromatograma, como la proporción del área del pico del componente ("tiempo de retención") en relación con el ancho de los picos en su punto más ancho (en la línea de base). Los picos que son altos, nítidos y relativamente angostos indican que el método de separación eliminó eficientemente un componente de una mezcla; alta eficiencia. La eficiencia depende mucho de la columna de HPLC y del método de HPLC utilizado. El factor de eficiencia es sinónimo de número de placa y del 'número de placas teóricas'.
El factor de retención (principal kappa) mide cuánto tiempo se adhirió a la columna un componente de la mezcla, medido por el área bajo la curva de su pico en un cromatograma (dado que los cromatogramas de HPLC son una función de tiempo). Cada pico de cromatograma tendrá su propio factor de retención (p. ej., kappa1 para el factor de retención del primer pico). Este factor puede ser corregido por el volumen vacío de la columna.
El factor de separación (alfa) es una comparación relativa de qué tan bien se separaron dos componentes vecinos de la mezcla (es decir,, dos bandas vecinas en un cromatograma). Este factor se define en términos de una relación de los factores de retención de un par de picos cromatográficos vecinos y también puede corregirse por el volumen vacío de la columna. Cuanto mayor sea el valor del factor de separación por encima de 1,0, mejor será la separación, hasta aproximadamente 2,0 más allá del cual probablemente no se necesite un método de HPLC para la separación. Las ecuaciones de resolución relacionan los tres factores de manera que la alta eficiencia y los factores de separación mejoran la resolución de los picos de los componentes en una separación por HPLC.
Diámetro interior
El diámetro interno (DI) de una columna de HPLC es un parámetro importante que influye en la sensibilidad de detección y la selectividad de separación en la elución en gradiente. También determina la cantidad de analito que se puede cargar en la columna. Las columnas más grandes suelen verse en aplicaciones industriales, como la purificación de un producto farmacéutico para su uso posterior. Las columnas de ID bajo tienen una sensibilidad mejorada y un menor consumo de disolvente a expensas de la capacidad de carga.
Las columnas de diámetro interno más grande (más de 10 mm) se utilizan para purificar cantidades utilizables de material debido a su gran capacidad de carga.
Las columnas de escala analítica (4,6 mm) han sido el tipo de columna más común, aunque las columnas más pequeñas están ganando popularidad rápidamente. Se utilizan en el análisis cuantitativo tradicional de muestras y, a menudo, utilizan un detector de absorbancia UV-Vis.
Las columnas de diámetro estrecho (1-2 mm) se utilizan para aplicaciones en las que se desea una mayor sensibilidad, ya sea con detectores especiales de UV-vis, detección de fluorescencia o con otros métodos de detección, como cromatografía de líquidos y espectrometría de masas.
Las columnas capilares (menos de 0,3 mm) se utilizan casi exclusivamente con medios de detección alternativos, como la espectrometría de masas. Por lo general, están hechos de capilares de sílice fundida, en lugar de los tubos de acero inoxidable que emplean las columnas más grandes.
Tamaño de partículas
La HPLC más tradicional se realiza con la fase estacionaria adherida al exterior de pequeñas partículas esféricas de sílice (perlas muy pequeñas). Estas partículas vienen en una variedad de tamaños, siendo las perlas de 5 µm las más comunes. Las partículas más pequeñas generalmente brindan más área de superficie y mejores separaciones, pero la presión requerida para una velocidad lineal óptima aumenta en la inversa del diámetro de la partícula al cuadrado.
Según las ecuaciones de la velocidad, la eficiencia y la contrapresión de la columna, reducir el diámetro de las partículas a la mitad y mantener el mismo tamaño de la columna duplicará la velocidad y la eficiencia de la columna; pero cuatro veces aumenta la contrapresión. Y la HPLC de partículas pequeñas también puede disminuir la ampliación del ancho. Las partículas más grandes se utilizan en HPLC preparativa (diámetros de columna de 5 cm hasta >30 cm) y para aplicaciones que no son de HPLC, como la extracción en fase sólida.
Tamaño de poro
Muchas fases estacionarias son porosas para proporcionar una mayor superficie. Los poros pequeños proporcionan una mayor superficie, mientras que los poros más grandes tienen una mejor cinética, especialmente para analitos más grandes. Por ejemplo, una proteína que es solo un poco más pequeña que un poro podría entrar en el poro pero no salir fácilmente una vez dentro.
Presión de la bomba
Las bombas varían en capacidad de presión, pero su rendimiento se mide en función de su capacidad para generar un caudal volumétrico consistente y reproducible. La presión puede alcanzar los 60 MPa (6000 lbf/in2), o alrededor de 600 atmósferas. Los sistemas modernos de HPLC se han mejorado para trabajar a presiones mucho más altas y, por lo tanto, pueden usar tamaños de partículas mucho más pequeños en las columnas (<2 μm). Estos "cromatografía líquida de rendimiento ultra alto" o UHPLC, que también se conocen como sistemas de cromatografía de ultra alta presión, pueden funcionar hasta 120 MPa (17 405 lbf/in2), o alrededor de 1200 atmósferas. El término "UPLC" es una marca registrada de Waters Corporation, pero a veces se usa para referirse a la técnica más general de UHPLC.
Detectores
Los detectores de HPLC se dividen en dos categorías principales: universales o selectivos. Los detectores universales suelen medir una propiedad a granel (por ejemplo,, índice de refracción) midiendo la diferencia de una propiedad física entre la fase móvil y la fase móvil con soluto, mientras que los detectores selectivos miden una propiedad de soluto (por ejemplo,, absorbancia UV-Vis) respondiendo simplemente a la propiedad física o química del soluto. HPLC usa más comúnmente un detector de absorbancia UV-Vis, sin embargo, se puede usar una amplia gama de otros detectores de cromatografía. Un detector universal que complementa la detección de absorbancia UV-Vis es el detector de aerosol cargado (CAD). Un tipo de detector comúnmente utilizado incluye detectores de índice de refracción, que proporcionan lecturas midiendo los cambios en el índice de refracción del eluyente a medida que se mueve a través de la celda de flujo. En ciertos casos, es posible usar múltiples detectores, por ejemplo, LCMS normalmente combina UV-Vis con un espectrómetro de masas.
Cuando se utiliza con un detector electroquímico (ECD), el HPLC-ECD detecta selectivamente neurotransmisores como: norepinefrina, dopamina, serotonina, glutamato, GABA, acetilcolina y otros en aplicaciones de investigación de análisis neuroquímico. El HPLC-ECD detecta neurotransmisores en el rango femtomolar. Otros métodos para detectar neurotransmisores incluyen cromatografía líquida-espectrometría de masas, ELISA o radioinmunoensayos.
Automuestreadores
Se pueden inyectar automáticamente grandes cantidades de muestras en un sistema de HPLC mediante el uso de muestreadores automáticos de HPLC. Además, los inyectores automáticos de HPLC tienen un volumen de inyección y una técnica exactamente iguales para cada inyección, por lo que proporcionan un alto grado de precisión del volumen de inyección. Es posible permitir la agitación de la muestra dentro de la cámara de muestreo, promoviendo así la homogeneidad.
Aplicaciones
Fabricación
La HPLC tiene muchas aplicaciones tanto en el laboratorio como en la ciencia clínica. Es una técnica común utilizada en el desarrollo farmacéutico, ya que es una forma confiable de obtener y asegurar la pureza del producto. Si bien la HPLC puede producir productos (puros) de muy alta calidad, no siempre es el método principal utilizado en la producción de materiales farmacéuticos a granel. De acuerdo con la farmacopea europea, HPLC se usa en solo el 15,5% de las síntesis. Sin embargo, juega un papel en el 44% de las síntesis en la farmacopea de los Estados Unidos. Esto podría deberse posiblemente a las diferencias en las limitaciones monetarias y de tiempo, ya que la HPLC a gran escala puede ser una técnica costosa. Lamentablemente, un aumento en la especificidad, la precisión y la exactitud que se produce con HPLC corresponde a un aumento en el costo.
Legal
Esta técnica también se utiliza para la detección de drogas ilícitas en la orina. El método más común de detección de drogas es un inmunoensayo. Este método es mucho más conveniente. Sin embargo, la conveniencia tiene el costo de la especificidad y la cobertura de una amplia gama de medicamentos. Dado que HPLC es un método para determinar (y posiblemente aumentar) la pureza, el uso de HPLC solo para evaluar las concentraciones de fármacos es algo insuficiente. Con esto, la HPLC en este contexto a menudo se realiza junto con la espectrometría de masas. El uso de cromatografía líquida en lugar de cromatografía de gases junto con MS evita la necesidad de derivatizar con agentes de acetilación o alquilación, lo que puede ser un paso adicional engorroso. Esta técnica se ha utilizado para detectar una variedad de agentes como agentes dopantes, metabolitos de drogas, conjugados de glucurónido, anfetaminas, opioides, cocaína, BZD, ketamina, LSD, cannabis y pesticidas. La realización de HPLC junto con la espectrometría de masas reduce la necesidad absoluta de estandarizar las ejecuciones experimentales de HPLC.
Investigación
Se pueden realizar ensayos similares con fines de investigación, detectando concentraciones de candidatos clínicos potenciales, como medicamentos antimicóticos y para el asma. Obviamente, esta técnica también es útil para observar múltiples especies en muestras recolectadas, pero requiere el uso de soluciones estándar cuando se busca información sobre la identidad de las especies. Se utiliza como método para confirmar los resultados de las reacciones de síntesis, ya que la pureza es esencial en este tipo de investigación. Sin embargo, la espectrometría de masas sigue siendo la forma más fiable de identificar especies.
Médica
(feminine)El uso médico de la HPLC puede incluir el análisis de fármacos, pero cae más cerca de la categoría de análisis de nutrientes. Si bien la orina es el medio más común para analizar las concentraciones de fármacos, el suero sanguíneo es la muestra recolectada para la mayoría de los análisis médicos con HPLC. Se han ensayado frente a HPLC otros métodos de detección de moléculas útiles para estudios clínicos, a saber, los inmunoensayos. En un ejemplo de esto, se compararon los ensayos competitivos de unión a proteínas (CPBA) y HPLC para la sensibilidad en la detección de vitamina D. Útil para diagnosticar deficiencias de vitamina D en niños, se encontró que la sensibilidad y especificidad de este CPBA alcanzó solo el 40% y el 60%. %, respectivamente, de la capacidad de HPLC. Si bien es una herramienta costosa, la precisión de la HPLC es casi incomparable.
Contenido relacionado
Carbono-14
Química analítica
Detergente