Cristal
Un cristal o sólido cristalino es un material sólido cuyos componentes (como átomos, moléculas o iones) están dispuestos en una estructura microscópica altamente ordenada, formando un cristal celosía que se extiende en todas direcciones. Además, los monocristales macroscópicos suelen identificarse por su forma geométrica, que consta de caras planas con orientaciones características específicas. El estudio científico de los cristales y la formación de cristales se conoce como cristalografía. El proceso de formación de cristales a través de mecanismos de crecimiento de cristales se denomina cristalización o solidificación.
La palabra cristal deriva de la palabra griega antigua κρύσταλλος (krustallos), que significa tanto & #34;hielo" y "cristal de roca", de κρύος (kruos), "frío helado, escarcha".
Ejemplos de cristales grandes incluyen copos de nieve, diamantes y sal de mesa. La mayoría de los sólidos inorgánicos no son cristales sino policristales, es decir, muchos cristales microscópicos fusionados en un solo sólido. Los policristales incluyen la mayoría de los metales, rocas, cerámicas y hielo. Una tercera categoría de sólidos son los sólidos amorfos, donde los átomos no tienen estructura periódica alguna. Los ejemplos de sólidos amorfos incluyen vidrio, cera y muchos plásticos.
A pesar del nombre, el cristal de plomo, el cristal y los productos relacionados no son cristales, sino tipos de vidrio, es decir, sólidos amorfos.
Los cristales, o sólidos cristalinos, a menudo se usan en prácticas pseudocientíficas como la cristaloterapia y, junto con las piedras preciosas, a veces se asocian con hechizos en las creencias Wicca y movimientos religiosos relacionados.
Estructura cristalina (microscópica)
La definición científica de un "cristal" se basa en la disposición microscópica de los átomos en su interior, llamada estructura cristalina. Un cristal es un sólido donde los átomos forman un arreglo periódico. (Los cuasicristales son una excepción, ver más abajo).
No todos los sólidos son cristales. Por ejemplo, cuando el agua líquida comienza a congelarse, el cambio de fase comienza con pequeños cristales de hielo que crecen hasta fusionarse, formando una estructura policristalina. En el bloque final de hielo, cada uno de los pequeños cristales (llamados "cristalitos" o "granos") es un verdadero cristal con una disposición periódica de átomos, pero el policristal entero no no tienen un arreglo periódico de átomos, porque el patrón periódico se rompe en los límites de grano. La mayoría de los sólidos inorgánicos macroscópicos son policristalinos, incluidos casi todos los metales, cerámica, hielo, rocas, etc. Los sólidos que no son ni cristalinos ni policristalinos, como el vidrio, se denominan sólidos amorfos, también llamados vítreos, vítreos, o no cristalino. Estos no tienen orden periódico, ni siquiera microscópicamente. Existen claras diferencias entre los sólidos cristalinos y los sólidos amorfos: en particular, el proceso de formación de un vidrio no libera el calor latente de fusión, pero la formación de un cristal sí lo hace.
Una estructura cristalina (una disposición de átomos en un cristal) se caracteriza por su celda unitaria, una pequeña caja imaginaria que contiene uno o más átomos en una disposición espacial específica. Las celdas unitarias se apilan en un espacio tridimensional para formar el cristal.
La simetría de un cristal está restringida por el requisito de que las celdas unitarias se apilen perfectamente sin espacios. Hay 219 posibles simetrías cristalinas (comúnmente se cita 230, pero esto trata a los equivalentes quirales como entidades separadas), llamados grupos espaciales cristalográficos. Estos se agrupan en 7 sistemas de cristal, como el sistema de cristal cúbico (donde los cristales pueden formar cubos o cajas rectangulares, como la halita que se muestra a la derecha) o el sistema de cristal hexagonal (donde los cristales pueden formar hexágonos, como el hielo de agua ordinario).
Caras y formas de cristal

Los cristales se reconocen comúnmente, macroscópicamente, por su forma, que consta de caras planas con ángulos agudos. Estas características de forma no son necesarias para un cristal (un cristal se define científicamente por su disposición atómica microscópica, no por su forma macroscópica), pero la forma macroscópica característica suele estar presente y es fácil de ver.
Los cristales euédricos son aquellos que tienen caras planas evidentes y bien formadas. Los cristales anédricos no lo hacen, generalmente porque el cristal es un grano en un sólido policristalino.
Las caras planas (también llamadas facetas) de un cristal euédrico están orientadas de una manera específica en relación con la disposición atómica subyacente del cristal: son planos de índice de Miller relativamente bajo. Esto ocurre porque algunas orientaciones superficiales son más estables que otras (menor energía superficial). A medida que crece un cristal, los nuevos átomos se adhieren fácilmente a las partes más ásperas y menos estables de la superficie, pero con menos facilidad a las superficies planas y estables. Por lo tanto, las superficies planas tienden a hacerse más grandes y más suaves, hasta que toda la superficie del cristal se compone de estas superficies planas. (Vea el diagrama a la derecha).
Una de las técnicas más antiguas de la ciencia de la cristalografía consiste en medir las orientaciones tridimensionales de las caras de un cristal y usarlas para inferir la simetría subyacente del cristal.
Las formas cristalográficas de un cristal son conjuntos de posibles caras del cristal que están relacionadas por una de las simetrías del cristal. Por ejemplo, los cristales de galena a menudo toman la forma de cubos, y las seis caras del cubo pertenecen a una forma cristalográfica que muestra una de las simetrías del sistema cristalino isométrico. Galena también cristaliza a veces como octaedros, y las ocho caras del octaedro pertenecen a otra forma cristalográfica que refleja una simetría diferente del sistema isométrico. Una forma cristalográfica se describe colocando entre paréntesis los índices de Miller de una de sus caras. Por ejemplo, la forma octaédrica se escribe como {111}, y las otras caras de la forma están implícitas en la simetría del cristal.
Los formularios pueden estar cerrados, lo que significa que el formulario puede encerrar completamente un volumen de espacio, o abiertos, lo que significa que no puede hacerlo. Las formas cúbica y octaédrica son ejemplos de formas cerradas. Todas las formas del sistema isométrico están cerradas, mientras que todas las formas de los sistemas cristalinos monoclínico y triclínico están abiertas. Las caras de un cristal pueden pertenecer todas a la misma forma cerrada, o pueden ser una combinación de múltiples formas abiertas o cerradas.
El hábito de un cristal es su forma externa visible. Esto está determinado por la estructura del cristal (que restringe las posibles orientaciones de las facetas), la química y el enlace específicos del cristal (que pueden favorecer algunos tipos de facetas sobre otros) y las condiciones bajo las cuales se formó el cristal.
Ocurrencia en la naturaleza
Rocas
Por volumen y peso, las mayores concentraciones de cristales en la Tierra son parte de su lecho de roca sólida. Los cristales que se encuentran en las rocas suelen variar en tamaño desde una fracción de milímetro hasta varios centímetros de diámetro, aunque ocasionalmente se encuentran cristales excepcionalmente grandes. A partir de 1999, el cristal natural más grande conocido en el mundo es un cristal de berilo de Malakialina, Madagascar, de 18 m (59 pies) de largo y 3,5 m (11 pies) de diámetro, y con un peso de 380 000 kg (840 000 lb).
Algunos cristales se han formado por procesos magmáticos y metamórficos, dando origen a grandes masas de roca cristalina. La gran mayoría de las rocas ígneas se forman a partir de magma fundido y el grado de cristalización depende principalmente de las condiciones en las que se solidificaron. Rocas como el granito, que se han enfriado muy lentamente y bajo grandes presiones, se han cristalizado por completo; pero muchos tipos de lava se vertieron en la superficie y se enfriaron muy rápidamente, y en este último grupo es común una pequeña cantidad de materia amorfa o vítrea. Otras rocas cristalinas, las rocas metamórficas como los mármoles, los micaesquistos y las cuarcitas, se recristalizan. Esto significa que en un principio eran rocas fragmentarias como la caliza, el esquisto y la arenisca y nunca han estado fundidas ni completamente disueltas, pero las condiciones de alta temperatura y presión del metamorfismo han actuado sobre ellas borrando sus estructuras originales e induciendo la recristalización en ellas. el estado solido
Otros cristales de roca se han formado a partir de la precipitación de fluidos, comúnmente agua, para formar drusas o vetas de cuarzo. Se han depositado evaporitas como halita, yeso y algunas calizas a partir de soluciones acuosas, principalmente debido a la evaporación en climas áridos.
Hielo
El hielo a base de agua en forma de nieve, hielo marino y glaciares son estructuras cristalinas/policristalinas comunes en la Tierra y otros planetas. Un solo copo de nieve es un solo cristal o una colección de cristales, mientras que un cubo de hielo es un policristal.
Cristales organigénicos
Muchos organismos vivos son capaces de producir cristales, por ejemplo calcita y aragonito en el caso de la mayoría de los moluscos o hidroxilapatita en el caso de los vertebrados.
Polimorfismo y alotropía
El mismo grupo de átomos a menudo puede solidificarse de muchas maneras diferentes. El polimorfismo es la capacidad de un sólido de existir en más de una forma cristalina. Por ejemplo, el hielo de agua normalmente se encuentra en la forma hexagonal Hielo Ih, pero también puede existir como Hielo cúbico Ic, Hielo romboédrico II y muchas otras formas. Los diferentes polimorfos generalmente se denominan diferentes fases.
Además, los mismos átomos pueden formar fases no cristalinas. Por ejemplo, el agua también puede formar hielo amorfo, mientras que el SiO2 puede formar tanto sílice fundida (un vidrio amorfo) como cuarzo (un cristal). Asimismo, si una sustancia puede formar cristales, también puede formar policristales.
Para los elementos químicos puros, el polimorfismo se conoce como alotropía. Por ejemplo, el diamante y el grafito son dos formas cristalinas de carbono, mientras que el carbono amorfo es una forma no cristalina. Los polimorfos, a pesar de tener los mismos átomos, pueden tener propiedades muy diferentes. Por ejemplo, el diamante se encuentra entre las sustancias más duras que se conocen, mientras que el grafito es tan blando que se usa como lubricante.
El poliamorfismo es un fenómeno similar en el que los mismos átomos pueden existir en más de una forma sólida amorfa.
Cristalización
La cristalización es el proceso de formación de una estructura cristalina a partir de un fluido o de materiales disueltos en un fluido. (Más raramente, los cristales se pueden depositar directamente del gas; ver deposición de película delgada y epitaxia).
La cristalización es un campo complejo y ampliamente estudiado porque, según las condiciones, un solo fluido puede solidificarse en muchas formas posibles diferentes. Puede formar un solo cristal, quizás con varias fases, estequiometrías, impurezas, defectos y hábitos posibles. O bien, puede formar un policristal, con varias posibilidades de tamaño, disposición, orientación y fase de sus granos. La forma final del sólido está determinada por las condiciones bajo las cuales se solidifica el fluido, como la química del fluido, la presión ambiental, la temperatura y la velocidad con la que cambian todos estos parámetros.
Las técnicas industriales específicas para producir monocristales grandes (llamados boules) incluyen el proceso Czochralski y la técnica Bridgman. Se pueden usar otros métodos de cristalización menos exóticos, dependiendo de las propiedades físicas de la sustancia, incluida la síntesis hidrotermal, la sublimación o simplemente la cristalización basada en solventes.
Los procesos geológicos pueden crear monocristales grandes. Por ejemplo, los cristales de selenita de más de 10 m se encuentran en la Cueva de los Cristales en Naica, México. Para obtener más detalles sobre la formación de cristales geológicos, consulte más arriba.
Los cristales también pueden formarse mediante procesos biológicos, véase más arriba. Por el contrario, algunos organismos tienen técnicas especiales para prevenir que se produzca la cristalización, como las proteínas anticongelantes.
Defectos, impurezas y maclados
Un cristal ideal tiene cada átomo en un patrón repetitivo perfecto y exacto. Sin embargo, en realidad, la mayoría de los materiales cristalinos tienen una variedad de defectos cristalográficos, lugares donde se interrumpe el patrón del cristal. Los tipos y estructuras de estos defectos pueden tener un profundo efecto en las propiedades de los materiales.
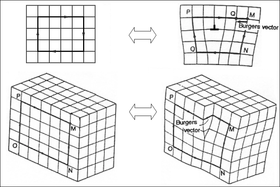
Algunos ejemplos de defectos cristalográficos incluyen defectos de vacancia (un espacio vacío donde debería caber un átomo), defectos intersticiales (un átomo adicional comprimido donde no cabe) y dislocaciones (ver figura a la derecha). Las dislocaciones son especialmente importantes en la ciencia de los materiales porque ayudan a determinar la resistencia mecánica de los materiales.
Otro tipo común de defecto cristalográfico es una impureza, lo que significa que el "incorrecto" tipo de átomo está presente en un cristal. Por ejemplo, un cristal perfecto de diamante solo contendría átomos de carbono, pero un cristal real quizás también contenga algunos átomos de boro. Estas impurezas de boro cambian el color del diamante a ligeramente azul. Asimismo, la única diferencia entre el rubí y el zafiro es el tipo de impurezas presentes en un cristal de corindón.
En los semiconductores, un tipo especial de impureza, llamado dopante, cambia drásticamente las propiedades eléctricas del cristal. Los dispositivos semiconductores, como los transistores, son posibles en gran medida colocando diferentes dopantes de semiconductores en diferentes lugares, en patrones específicos.
El maclado es un fenómeno entre un defecto cristalográfico y un límite de grano. Al igual que un límite de grano, un límite gemelo tiene diferentes orientaciones de cristal en sus dos lados. Pero a diferencia de un límite de grano, las orientaciones no son aleatorias, sino que están relacionadas de una manera específica, como una imagen especular.
La mosaicoidad es una extensión de las orientaciones del plano cristalino. Un cristal de mosaico consta de unidades cristalinas más pequeñas que están algo desalineadas entre sí.
Enlaces químicos
En general, los sólidos se pueden mantener unidos mediante varios tipos de enlaces químicos, como enlaces metálicos, enlaces iónicos, enlaces covalentes, enlaces de van der Waals y otros. Ninguno de estos es necesariamente cristalino o no cristalino. Sin embargo, hay algunas tendencias generales como sigue.
Los metales son casi siempre policristalinos, aunque hay excepciones como los metales amorfos y los metales monocristalinos. Estos últimos se cultivan sintéticamente. (Una pieza de metal microscópicamente pequeña puede formar naturalmente un solo cristal, pero las piezas más grandes generalmente no lo hacen). Los materiales compuestos iónicos suelen ser cristalinos o policristalinos. En la práctica, se pueden crear grandes cristales de sal por solidificación de un fluido fundido o por cristalización a partir de una solución. Los sólidos enlazados covalentemente (a veces llamados sólidos de red covalente) también son muy comunes, ejemplos notables son el diamante y el cuarzo. Las fuerzas débiles de van der Waals también ayudan a mantener unidos ciertos cristales, como los sólidos moleculares cristalinos, así como la unión entre capas en el grafito. Los materiales poliméricos generalmente formarán regiones cristalinas, pero las longitudes de las moléculas generalmente evitan la cristalización completa y, a veces, los polímeros son completamente amorfos.
Cuasicristales
Un cuasicristal consta de conjuntos de átomos ordenados pero no estrictamente periódicos. Tienen muchos atributos en común con los cristales comunes, como mostrar un patrón discreto en la difracción de rayos X y la capacidad de formar formas con caras lisas y planas.
Los cuasicristales son más famosos por su capacidad para mostrar una simetría quíntuple, lo que es imposible para un cristal periódico ordinario (consulte el teorema de restricción cristalográfica).
La Unión Internacional de Cristalografía ha redefinido el término "cristal" para incluir tanto cristales periódicos ordinarios como cuasicristales ("cualquier sólido que tenga un diagrama de difracción esencialmente discreto").
Los cuasicristales, descubiertos por primera vez en 1982, son bastante raros en la práctica. Se sabe que solo unos 100 sólidos forman cuasicristales, en comparación con los 400 000 cristales periódicos conocidos en 2004. El Premio Nobel de Química de 2011 fue otorgado a Dan Shechtman por el descubrimiento de los cuasicristales.
Propiedades especiales de la anisotropía
Los cristales pueden tener ciertas propiedades eléctricas, ópticas y mecánicas especiales que el vidrio y los policristales normalmente no pueden. Estas propiedades están relacionadas con la anisotropía del cristal, es decir, la falta de simetría rotacional en su disposición atómica. Una de esas propiedades es el efecto piezoeléctrico, donde un voltaje a través del cristal puede encogerlo o estirarlo. Otro es la birrefringencia, donde aparece una imagen doble al mirar a través de un cristal. Además, varias propiedades de un cristal, incluida la conductividad eléctrica, la permitividad eléctrica y el módulo de Young, pueden ser diferentes en diferentes direcciones en un cristal. Por ejemplo, los cristales de grafito consisten en una pila de láminas y, aunque cada lámina individual es mecánicamente muy resistente, las láminas están unidas entre sí de manera bastante floja. Por lo tanto, la resistencia mecánica del material es bastante diferente según la dirección de la tensión.
No todos los cristales tienen todas estas propiedades. Por el contrario, estas propiedades no son del todo exclusivas de los cristales. Pueden aparecer en vidrios o policristales que se han vuelto anisotrópicos por trabajo o estrés, por ejemplo, birrefringencia inducida por estrés.
Cristalografía
Cristalografía es la ciencia de medir la estructura cristalina (en otras palabras, la disposición atómica) de un cristal. Una técnica de cristalografía ampliamente utilizada es la difracción de rayos X. Un gran número de estructuras cristalinas conocidas se almacenan en bases de datos cristalográficas.
Galería de imágenes
Contenido relacionado
Hidróxido
Elemento del período 6
Lee Smolin