Craneoplastia
La craneoplastia es una intervención quirúrgica destinada a reparar defectos craneales causados por traumatismos u operaciones previas, como la craneotomía descompresiva. Se realiza rellenando la zona defectuosa con diversos materiales, normalmente un trozo de hueso del propio paciente o un material sintético. La craneoplastia se lleva a cabo mediante incisión y reflexión del cuero cabelludo tras aplicar anestesia y antibióticos al paciente. Se refleja el músculo temporal y se eliminan todos los tejidos blandos circundantes, exponiendo así por completo el defecto craneal. Se coloca el colgajo de craneoplastia y se fija sobre el defecto craneal. A continuación se sella la herida.
La craneoplastia estaba estrechamente relacionada con la trepanación, y la operación más antigua data del año 3000 a. C. Actualmente, el procedimiento se realiza tanto con fines estéticos como funcionales. La craneoplastia puede restaurar la forma normal del cráneo y prevenir otras complicaciones causadas por un cuero cabelludo hundido, como el "síndrome del trepanado". La craneoplastia es una operación riesgosa, con riesgos potenciales como infección bacteriana y reabsorción del colgajo óseo.
Etymology
La palabra craneoplastia se puede dividir en dos partes: craneo- y -plastia. Craneo- proviene de la palabra griega antigua κρανίον, que significa "cráneo", mientras que -plastia proviene de la palabra griega antigua πλαστός, que significa "moldeado" o "formado".
Usos médicos
La operación tiene un valor estético, ya que se restaura la forma normal del cráneo del paciente en lugar de la presencia de un colgajo de piel hundido, que puede afectar la confianza de los pacientes.
También tiene valor terapéutico, ya que la operación proporciona estructura al cráneo y protección al cerebro contra daños físicos. La cirugía restablece la dinámica normal del líquido cefalorraquídeo (LCR) y del flujo sanguíneo cerebral, junto con la presión intracraneal normal. La craneoplastia puede mejorar la función neurológica en algunas personas. Además, puede reducir la aparición de dolores de cabeza causados por lesiones o cirugías previas.
El momento óptimo para realizar una craneoplastia es controvertido. Algunos expertos calculan que el tiempo entre una craneotomía y una craneoplastia suele ser de entre 6 meses y un año, mientras que otros dicen que las dos operaciones deberían realizarse con más de un año de diferencia.
El momento de la craneoplastia se ve afectado por múltiples factores. Se requiere tiempo suficiente para la recuperación de la incisión de la operación anterior, así como para eliminar cualquier infección (tanto sistémica como craneal). Algunos hallazgos mostraron que una mayor tasa de infección se asocia con la craneoplastia temprana debido a la interrupción de la cicatrización de la herida, así como a una mayor incidencia de hidrocefalia. Por el contrario, existe evidencia de complicaciones limitantes de la craneoplastia temprana causadas por el "síndrome del trepanado", incluidos cambios en el flujo sanguíneo cerebral e hidrodinámica anormal del líquido cefalorraquídeo. Otros investigadores no han informado de diferencias significativas en la tasa de infección con diferentes momentos de la operación.
Las contraindicaciones para la craneoplastia incluyen la presencia de infección bacteriana, hinchazón cerebral e hidrocefalia. La craneoplastia se pospone hasta que se hayan eliminado todas las contraindicaciones.
Procedimiento
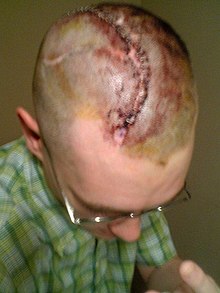
Antes de la operación se realizan tomografías computarizadas y resonancias magnéticas para estudiar el defecto craneal. Se administran antibióticos al paciente para prevenir la infección bacteriana.
El paciente se coloca sobre una rosquilla de espuma o un soporte de cabeza en forma de herradura para la operación. Luego se lo anestesia y se realiza una incisión siguiendo la incisión de la operación anterior. Se desdobla el cuero cabelludo y el músculo temporal para revelar completamente el defecto craneal. Se observa una pérdida de sangre significativa a medida que se forman nuevos vasos sanguíneos en los tejidos cicatriciales que se dañan por la incisión. Se eliminan los tejidos blandos en el borde del defecto y se limpia el defecto. El material de craneoplastia se coloca sobre el defecto y se fija al cráneo circundante con una placa de titanio estándar y tornillos. Se puede drenar el LCR del cerebro para reducir la hernia. Se pueden perforar pequeños orificios en el injerto óseo o la prótesis para evitar la acumulación de líquido debajo del defecto reparado. Luego se vuelven a fijar en su lugar los tejidos blandos, el temporal y el cuero cabelludo. Se aplica un drenaje subgaleal y un apósito para controlar la hinchazón facial.
Después de la operación, se realiza una tomografía computarizada y los pacientes pueden permanecer en cuidados intensivos durante al menos una noche para una mejor observación del estado neurológico, o ser ubicados en una unidad de cuidados regulares. El drenaje subgaleal y el vendaje se retiran antes de que el paciente sea dado de alta.
Niños
Se realizan consideraciones especiales en los niños que se someten a una craneoplastia para adaptarse al crecimiento de su cráneo. Ciertos materiales son más recomendables en comparación con la craneoplastia para adultos.
Los injertos óseos autólogos son los materiales más preferidos para la craneoplastia pediátrica, ya que son aceptados por el huésped y el colgajo óseo se puede integrar en el cuerpo del huésped. Sin embargo, las piezas de hueso autólogo pueden no estar disponibles o no ser adecuadas en ciertas ocasiones. El tamaño corporal de los niños puede no ser suficiente para tener colgajos óseos para almacenar en sus espacios subcutáneos, mientras que las instalaciones de criopreservación para injertos óseos no están ampliamente disponibles. El uso de autoinjertos también se asocia con una alta tasa de reabsorción ósea.
Los materiales sintéticos se utilizan para la craneoplastia pediátrica cuando no se dispone de autoinjertos o no se recomienda su uso. La hidroxiapatita es otra opción para la craneoplastia pediátrica, ya que permite la expansión del cráneo de los niños y su capacidad de moldearse sin problemas. Se utiliza con menos frecuencia que los autoinjertos debido a su naturaleza frágil, su alta tasa de infección y su escasa capacidad para integrarse con el cráneo humano.
Las craneoplastias bilaterales son más propensas a complicaciones en comparación con las craneoplastias unilaterales en niños. Esto puede explicarse por la mayor área de la herida en el cuero cabelludo, un mayor volumen de pérdida de sangre y la mayor complejidad y duración de la operación.
Riesgos
El riesgo de complicaciones de la craneoplastia oscila entre el 15% y el 41%. No está claro el motivo de un riesgo tan elevado en comparación con el de otras operaciones neuroquirúrgicas. Los pacientes varones y los pacientes de mayor edad son grupos con mayores tasas de complicaciones.
Las complicaciones que pueden presentarse después de una craneoplastia incluyen infección bacteriana, reabsorción del colgajo óseo, dehiscencia de la herida, hematomas, convulsiones, higroma y pérdida de líquido cefalorraquídeo (LCR).
El riesgo de infecciones bacterianas al realizar una craneoplastia oscila entre el 5 y el 12,8%. Existen múltiples factores que afectan al riesgo de infección, uno de ellos es el material utilizado para la operación. El uso de titanio, ya sea a medida o mediante una malla, se asocia a una menor tasa de infección; por otro lado, materiales como el metacrilato de metilo y el hueso autólogo se asocian a una mayor tasa de infección. Otro factor de riesgo de infección bacteriana es el lugar de la operación. Las craneoplastias bifrontales se asocian a tasas de infección significativamente más altas y a tasas más altas de reintervención. Otros factores de riesgo de infección incluyen infecciones previas, contacto entre los senos nasales y el lugar de la operación, cuero cabelludo desvascularizado (pérdida de irrigación sanguínea en el cuero cabelludo), operaciones previas y tipo de lesión.
La reabsorción ósea es otra complicación de la craneoplastia, con una tasa de complicaciones del 0,7-17,4 %. La reabsorción ósea se produce cuando el injerto autólogo no tiene irrigación sanguínea debido a la desvitalización, o cuando quedan tejidos cicatriciales o tejidos blandos en el borde del defecto craneal durante la craneoplastia. Los pacientes pediátricos tienen un mayor riesgo de reabsorción, con una tasa de reabsorción de hasta el 50 %. La reabsorción ósea es más probable que se produzca en este grupo de pacientes cuando su craneoplastia se realiza más de 6 semanas después de su operación anterior. Los colgajos óseos fragmentados, así como los colgajos óseos grandes (>70 cm2), se asocian con una mayor tasa de reabsorción.
Historia
Historia antigua
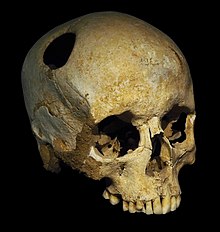
La primera operación de craneoplastia data del año 3000 a. C. en la civilización peruana precolombina, donde se encontraron metales preciosos, calabazas y conchas junto a cráneos trepanados en cementerios, lo que sugiere que se había realizado craneoplastia. En la región de Paracas, en el actual Perú, se encontró un cráneo del año 2000 a. C. con una fina placa de oro que cubría un defecto craneal. Además, se encontraron cráneos defectuosos cubiertos con cáscaras de coco u hojas de palma en antiguas tribus de las islas polinesias. Sanan y Haines afirmaron que los materiales que se utilizaban para la craneoplastia estaban asociados con el estado del paciente.
Historia moderna
En la antigua Asia, Egipto, Grecia y Roma, los primeros autores de cirugía no hicieron hincapié en la investigación sobre la craneoplastia, aunque sí se realizaron investigaciones y prácticas sobre la trepanación en la antigua Grecia y Roma. Se hizo más hincapié en el desarrollo de habilidades para aplicar vendajes en heridas abiertas.

La primera descripción moderna de la craneoplastia fue escrita por el cirujano Ibrahim bin Abdullah del Imperio Otomano, en su libro de cirugía Alâim-i Cerrâhîn en 1505. El libro menciona el uso de xenoinjertos de perros o cabras Kangal como materiales para la craneoplastia. Dichos materiales se utilizaban debido a la accesibilidad de estos animales cerca de los campos de batalla, donde es probable que se realice el procedimiento.
La primera descripción verdadera de una craneoplastia en Europa fue hecha por Fallopius en el siglo XVI, quien afirmó que el cráneo fracturado debía ser removido y reinsertado con una placa de oro si la duramadre estaba dañada. Esto fue cuestionado por otros profesionales de su época, quienes pensaban que los cirujanos podían quedarse con el oro en lugar de usarlo para la cirugía. La primera craneoplastia fue reportada por el cirujano holandés Job Janszoon van Meekeren. El informe describía el uso de un segmento de un cráneo canino como material para la craneoplastia en un noble de Moscú. La operación fue exitosa, pero el uso del hueso canino no fue aceptado por la iglesia y el hombre fue obligado a abandonar Rusia.
Desde la primera operación, se han utilizado huesos de más especies animales como xenoinjertos para la craneoplastia. Entre ellos se incluyen perros, simios, gansos, conejos, terneros, águilas, bueyes y búfalos. En 1917, William Wayne Babcock informó sobre el uso de un "hueso de sopa", un trozo de hueso animal cocido y perforado, como xenoinjerto.
Desarrollo de materiales modernos
La prevalencia de las lesiones en la cabeza aumentó en el siglo XX con el avance de los armamentos, en particular el uso de granadas de mano en la guerra de trincheras durante la Primera Guerra Mundial. Junto con una menor mortalidad por sufrir dichas lesiones debido al desarrollo de la eliminación de restos celulares, el cierre de heridas y el uso de antibióticos, las técnicas de craneoplastia mejoraron. Los autoinjertos, los aloinjertos y los materiales sintéticos son los principales tipos de materiales utilizados para la craneoplastia.

Los autoinjertos, o injertos autólogos, son tejidos corporales extraídos del propio paciente. La primera craneoplastia exitosa con un autoinjerto se registró en 1821, con la reinserción del trozo de hueso en el cráneo. La operación logró una curación parcial. Posteriormente, se realizaron más estudios y operaciones con autoinjertos. Sir William Macewen informó sobre un caso exitoso de reimplantación de hueso craneal en 1885, popularizando los autoinjertos como material para craneoplastia. Las operaciones posteriores implicaron autoinjertos extraídos de diferentes partes del cuerpo del paciente, como la tibia (hueso de la pierna), la escápula (omóplato), el íleon (hueso de la cadera), el esternón (hueso del pecho), junto con tejidos grasos y fascia.
Los aloinjertos son tejidos de otro individuo de la misma especie. El primer uso de aloinjertos fue reportado en 1915 con cartílago de cadáver por Morestin. Posteriormente, Gosset reportó otros 32 casos de craneoplastias realizadas con cartílago de cadáver en 1916. El uso de cartílago de cadáver fue favorecido durante la Primera Guerra Mundial debido a su maleabilidad y resistencia a la infección. Su uso disminuyó debido a su falta de calcificación significativa y fuerza. El cráneo de cadáver fue otro tipo de aloinjerto reportado como material de craneoplastia varias veces por Sicard y Dambrin de 1917 a 1919. El material no fue favorecido debido a la alta tasa de infección con su uso. En la década de 1980, el uso de disco de aloinjerto de cadáver para rellenar pequeños agujeros recibió un resultado satisfactorio y hubo un resurgimiento del uso de hueso de cadáver. Sin embargo, los huesos de cadáveres y los aloinjertos, en general, no son los materiales preferidos en las operaciones modernas.El uso de metacrilato de metilo (PMMA) para la craneoplastia se ha desarrollado desde la Segunda Guerra Mundial, cuando había una gran demanda de este material para tratar heridas de combate, y se ha utilizado ampliamente desde 1954. El PMMA se vuelve maleable cuando se produce una reacción exotérmica entre su forma en polvo y el peróxido de benzoilo, lo que permite moldearlo al defecto craneal. Las ventajas de su uso son su maleabilidad, bajo coste, alta resistencia y alta durabilidad. Las desventajas incluyen su vulnerabilidad a las infecciones, ya que las bacterias pueden adherirse a su capa fibrosa, así como su naturaleza frágil y la ausencia de potencial de crecimiento.
Otros materiales sintéticos comunes para la craneoplastia incluyen el titanio y la hidroxiapatita. El titanio se utilizó por primera vez para la craneoplastia en 1965. Se puede utilizar como placa o malla e imprimir en 3D como una forma porosa. El titanio no es ferromagnético ni corrosivo, lo que evita que el huésped sufra reacciones inflamatorias. También es robusto, lo que evita que los pacientes sufran traumatismos. El uso de titanio se asocia con una menor tasa de infecciones. Las desventajas de usar titanio incluyen su alto costo, su mala maleabilidad y la alteración de las imágenes de tomografía computarizada.
La hidroxiapatita es un compuesto de fosfato de calcio dispuesto en una estructura hexagonal. Se adhiere bien químicamente a los huesos y provoca poca reacción inflamatoria en el huésped, además de tener una buena osteointegración. Se puede expandir y se utiliza en craneoplastias pediátricas. Se puede moldear suavemente y tiene resultados cosméticos atractivos. Sin embargo, el material es frágil y tiene una baja resistencia a la tracción, por lo que solo es adecuado para su uso en defectos craneales pequeños. Su uso también se asocia a una alta tasa de infecciones. La hidroxiapatita se utiliza a menudo con una malla de titanio para prevenir fracturas y para una mejor osteointegración.
Véase también
- cráneo humano
- Craniotomía
- craniectomía descompresiva
- Cirugía oral y maxilofacial
- Cirugía plástica
- Cirugía craneofacial
Referencias
- ^ a b c d e f h i j k l m n o p q r s t u v w x Piazza M, Grady MS (abril de 2017). "Cranioplastia". Clínicas de Neurocirugía de América del Norte. 28 (2): 257–265. doi:10.1016/j.nec.2016.11.008. PMID 28325460.
- ^ a b c d e f h i j k l m n o p q r s Sanan A, Haines SJ (marzo de 1997). "Reparación de agujeros en la cabeza: una historia de cranioplastia". Neurocirugía. 40 (3): 588-603. doi:10.1097/00006123-199703000-00033. PMID 9055300.
- ^ a b c d e Dujovny M, Aviles A, Agner C, Fernandez P, Charbel FT (marzo de 1997). "Cranioplastia: cosmética o terapéutica?". Neurología quirúrgica. 47 (3): 238–41. doi:10.1016/s0090-3019(96)00013-4. PMID 9068693.
- ^ a b c d e f g Acciarri N, Nicolini F, Martinoni M (diciembre 2016). "¿Cranioplastia: procedimiento quirúrgico rutinario o operación de riesgo?". World Journal of Surgical Research. 5 (5).
- ^ "Cranioplastia". Oxford English Dictionary (Online ed.). Oxford University Press. (Se requiere suscripción o afiliación a instituciones participantes).
- ^ a b c "Cranioplastia". Johns Hopkins Medicine. Retrieved 25 de mayo 2020.
- ^ Lee L, Ker J, Quah BL, Chou N, Choy D, Yeo TT (octubre de 2013). "Un análisis retrospectivo y revisión de la experiencia de una institución con las complicaciones de la cranioplastia". British Journal of Neurosurgery. 27 (5): 629–35. doi:10.3109/02688697.2013.815313. PMID 23879443. S2CID 2037637.
- ^ a b c Yadla S, Campbell PG, Chitale R, Maltenfort MG, Jabbour P, Sharan AD (abril de 2011). "Efecto de la cirugía temprana, el material y el método de preservación de aletas en infecciones de cranioplastia: una revisión sistemática". Neurocirugía. 68 (4): 1124–9, discusión 1130. doi:10.1227/NEU.0b013e31820a5470. PMID 21242830. S2CID 4505995.
- ^ a b c d e Malcolm JG, Rindler RS, Chu JK, Grossberg JA, Pradilla G, Ahmad FU (noviembre 2016). "Complicaciones tras la cranioplastia y la relación al tiempo: Una revisión sistemática y metaanálisis". Journal of Clinical Neuroscience. 33: 39–51. doi:10.1016/j.jocn.2016.04.017. PMID 27499122. S2CID 32109527.
- ^ a b c d e f h i j k l m n Shah AM, Jung H, Skirboll S (abril de 2014). "Materiales utilizados en la cranioplastia: historia y análisis". Enfoque neuroquirúrgico. 36 (4): E19. doi:10.3171/2014.2.FOCUS13561. PMID 24684331. S2CID 22048837.
- ^ a b Lam S, Kuether J, Fong A, Reid R (junio de 2015). "Cranioplastia para defectos calvariales de gran tamaño en la población pediátrica: una revisión". Craniomaxillofacial Trauma " Reconstruction. 8 (2): 159–70. doi:10.1055/s-0034-1395880. PMC 4428737. PMID 26000090.
- ^ a b Josan VA, Sgouros S, Walsh AR, Dover MS, Nishikawa H, Hockley AD (marzo de 2005). "Cranioplastia en niños". Sistema nervioso infantil. 21 (3): 200-4. doi:10.1007/s00381-004-1068-2. PMID 15616854. S2CID 7604976.
- ^ Williams LR, Fan KF, Bentley RP (mayo de 2015). "Crenioplastia de titanio personalizada: complicaciones tempranas y tardías de 151 cranioplastias y revisión de la literatura". International Journal of Oral and Maxillofacial Surgery. 44 (5): 599–608. doi:10.1016/j.ijom.2014.09.006. PMID 25482456.
- ^ Tasiou A, Vagkopoulos K, Georgiadis I, Brotis AG, Gatos H, Fountas KN (diciembre de 2014). "Cranioplastia tiempo óptimo en casos de craniectomía descompresiva después de lesiones graves en la cabeza: revisión sistemática de la literatura". Interdisciplinary Neurocirugía. 1 (4): 107–11. doi:10.1016/j.inat.2014.06.005.
- ^ a b Stula D (diciembre de 2012). Cranioplastia: indicaciones, técnicas y resultados. Springer Science & Business Media. ISBN 978-3-7091-8764-7.
- ^ Aciduman A, Belen D (septiembre 2007). "El primer documento sobre la historia de la cranioplastia de la era otomana". Neurología quirúrgica. 68 (3): 349–52, discusión 352–3. doi:10.1016/j.surneu.2006.10.073. PMID 17719987.
- ^ a b c Bonfield CM, Kumar AR, Gerszten PC (abril de 2014). "La historia de la cranioplastia militar". Enfoque neuroquirúrgico. 36 (4): E18. doi:10.3171/2014.1.FOCUS13504. PMID 24684330.
- ^ a b c d e Aydin S, Kucukyuruk B, Abuzayed B, Aydin S, Sanus GZ (julio de 2011). "Cranioplastia: revisión de materiales y técnicas". Journal of Neurosciences in Rural Practice. 2 (2): 162-7. doi:10.4103/0976-3147.83584. PMC 3159354. PMID 21897681.
- ^ a b Iaccarino C, Kolias AG, Roumy LG, Fountas K, Adeleye AO (2019). "Cranioplastia tras la craniectomía descompresiva". Fronteras en Neurología. 10: 1357. doi:10.3389/fneur.2019.01357. PMC 7000464. PMID 32063880.