Contraión

En química, un contraión (a veces escrito como "contraión", pronunciado como tal) es el ion que acompaña a una especie iónica en para mantener la neutralidad eléctrica. En la sal de mesa (NaCl, también conocida como cloruro de sodio), el ion sodio (cargado positivamente) es el contraión del ion cloruro (cargado negativamente) y viceversa.
Un contraión se denominará más comúnmente anión o catión, dependiendo de si tiene carga negativa o positiva. Por tanto, el contraión de un anión será un catión y viceversa.
En bioquímica, los contraiones generalmente están vagamente definidos. Dependiendo de su carga, las proteínas se asocian con una variedad de aniones y cationes más pequeños. En las células vegetales, el anión malato a menudo se acumula en la vacuola para disminuir el potencial hídrico e impulsar la expansión celular. Para mantener la neutralidad, los iones K+ a menudo se acumulan como contraión. La permeación de iones a través de las paredes celulares hidrófobas está mediada por canales de transporte de iones. Los ácidos nucleicos son aniónicos, los cationes correspondientes suelen ser poliaminas protonadas.
Química interfacial
Los contraiones son los iones móviles en los polímeros y coloides de intercambio iónico. Las resinas de intercambio iónico son polímeros con una carga neta negativa o positiva. Las resinas de intercambio catiónico consisten en un polímero aniónico con contracationes, típicamente Na+ (sodio). La resina tiene una mayor afinidad por los contracationes altamente cargados, por ejemplo por Ca2+ (calcio) en el caso del ablandamiento del agua. De manera correspondiente, las resinas de intercambio aniónico se presentan normalmente en forma de cloruro Cl-, que es un contraanión muy móvil.
Los contraiones se utilizan en la catálisis de transferencia de fase. En una aplicación típica, el contracatión lipófilo, como el benzalconio, solubiliza los reactivos en disolventes orgánicos.
Química de la solución
La solubilidad de las sales en disolventes orgánicos es función tanto del catión como del anión. La solubilidad de los cationes en disolventes orgánicos puede mejorarse cuando el anión es lipófilo. De manera similar, la solubilidad de los aniones en disolventes orgánicos aumenta con cationes lipófilos. Los cationes lipófilos más comunes son los cationes de amonio cuaternario, llamados "sales quat".
- Contensiones litófilas
- Lithium tetrakis (pentafluorofenilo)borate es la sal de litio de una anión tetraarylborate altamente lipofílica, a menudo conocida como un anión de coordinación débil.
- El tetrafenilboato es menos lipofílico que el derivado perfluorinado, pero ampliamente utilizado como agente precipitante.
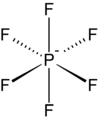
- El hexafluorofosfato es un anión común de coordinación débil.
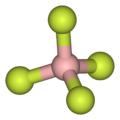
- Como ilustrado por el pequeño tetrafluoroboato de contraanión (BF−
4), las caciones lipofílicas tienden a ser simétricas y cargadas de canto.
- Contracaciones litóficas
- El cloruro de bis(triphenylphosphine)iminium es la sal de cloruro de una cación de fosfonio lipofílico voluminoso [Ph3PNPPh3]+.
- Cloruro de tetrafenilfosfonio (C)6H5)4PCl, abreviado Ph4PCl o PPh4Cl es el cloruro de una cación simétrica de fosfonio que se utiliza a menudo en la química organometállica. La sal de arsonio también es bien conocida.
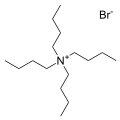
- La sal bromida de tetrabutylammonium, una de las caciones de contador más comunes. Se conocen muchas sales analógicas.
- Las caciones metálicas de Alkali ligadas por éteres de corona son contracaciones lipofílicas comunes, como ilustran [Li(12-crown-4)2]+.
Muchos complejos organometálicos catiónicos se aíslan con contraiones inertes y no coordinantes. El tetrafluoroborato de ferrocenio es un ejemplo de ello.
Electroquímica
Para lograr una alta conductividad iónica, se realizan mediciones electroquímicas en presencia de electrolitos excedentes. En el agua el electrolito es a menudo una sal simple como el cloruro de potasio. Para mediciones en soluciones nonacuosas, se emplean sales compuestas de caciones lipofílicas y aniones, por ejemplo, hexafluorofosfato de tetrabutilammonio. Incluso en tales casos los potenciales están influenciados por el ion-pairing, un efecto que se acentua en disolventes de baja constante dieléctrica.
Estabilidad de la lucha
Para muchas aplicaciones, el contraión simplemente proporciona carga y lipofilicidad que permite la manipulación de su ion asociado. Se espera que el contraión sea químicamente inerte. Para los contraaniones, la inercia se expresa en términos de baja basicidad de Lewis. Lo ideal es que los contraiones sean resistentes y no reactivos. Para los contracationes de amonio cuaternario y fosfonio, la inercia está relacionada con su resistencia a la degradación por bases fuertes y nucleófilos fuertes.
![Lithium tetrakis(pentafluorophenyl)borate is the lithium salt of a highly lipophilic tetraarylborate anion, often referred to as a weakly coordinating anion.[2]](https://upload.wikimedia.org/wikipedia/commons/thumb/9/90/Lithium-tetrakis%28pentafluorophenyl%29borate-2D-skeletal.png/152px-Lithium-tetrakis%28pentafluorophenyl%29borate-2D-skeletal.png)

![Bis(triphenylphosphine)iminium chloride is the chloride salt of a bulky lipophilic phosphonium cation [Ph3PNPPh3]+.](https://upload.wikimedia.org/wikipedia/commons/thumb/9/99/PPNCl.png/180px-PPNCl.png)

![Alkali metal cations bound by crown ethers are common lipophilic countercations, as illustrated by [Li(12-crown-4)2]+.](https://upload.wikimedia.org/wikipedia/commons/thumb/d/da/Bis%2812-crown-4%29lithium-cation-from-xtal-3D-balls-B.png/118px-Bis%2812-crown-4%29lithium-cation-from-xtal-3D-balls-B.png)