Constante de disociación ácida
En química, una constante de disociación de ácido (también conocido como constante de acidez, o constante de acidización; denotado Ka{displaystyle K_{a}) es una medida cuantitativa de la fuerza de un ácido en la solución. Es la constante del equilibrio para una reacción química
conocido como disociación en el contexto de las reacciones ácido-base. La especie química HA es un ácido que se disocia en A−, la base conjugada del ácido y un iones de hidrógeno, H+. Se dice que el sistema está en equilibrio cuando las concentraciones de sus componentes no cambian con el tiempo, porque tanto las reacciones directas como las inversas ocurren a la misma velocidad.
La constante de disociación está definida por
- Ka=[A− − ][H+][HA],{displaystyle K_{text{a}=mathrm {fnMicroc {} {fnK}} {fnMicrosoft}} {fnMicrosoft}}} {fn}} {fnK}}} {fnMicroc {fnK}}} {fn}} {fnMicroc {f}} {fnMicroc {f}}}}}} {f}}}}}} {f}}}}}}}} {f} {f}}}}}}}} {f}}}}}} {f}}}} {f} {f}}} {f}}}}}}}}} {f}} {f} {f}} {f} {f}}}}}}}}}}} {f}}}}}f}}}} {f}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} o
- pKa=− − log10 Ka=log10 [HA][A− − ][H+]{displaystyle mathrm {p} K_{ce {a}=-log ¿Por qué? {fn}} {fn}}} {fnK}}}}} {fn}}}}} {fn}}}}}} {fn}}}} {fn}}}}}}}}
donde las cantidades entre corchetes representan las concentraciones de las especies en equilibrio.
Antecedentes teóricos
La constante de disociación ácida de un ácido es una consecuencia directa de la termodinámica subyacente de la reacción de disociación; el valor de pKa es directamente proporcional al cambio de energía libre de Gibbs estándar para la reacción. El valor de pKa cambia con la temperatura y puede entenderse cualitativamente en base al principio de Le Châtelier: cuando la reacción es endotérmica, Ka aumenta y pKa disminuye con el aumento de la temperatura; lo contrario es cierto para las reacciones exotérmicas.
El valor de pKa también depende de la estructura molecular del ácido de muchas maneras. Por ejemplo, Pauling propuso dos reglas: una para pKa sucesivos de ácidos polipróticos (ver Ácidos polipróticos a continuación), y otra para estimar el pKa de oxiácidos en función del número de grupos =O y −OH (ver Factores que afectan los valores de pKa a continuación). Otros factores estructurales que influyen en la magnitud de la constante de disociación ácida incluyen efectos inductivos, efectos mesoméricos y enlaces de hidrógeno. Las ecuaciones de tipo Hammett se han aplicado con frecuencia a la estimación de pKa.
El comportamiento cuantitativo de ácidos y bases en solución solo se puede entender si se conocen sus valores de pKa. En particular, el pH de una solución se puede predecir cuando se conocen la concentración analítica y los valores de pKa de todos los ácidos y bases; a la inversa, es posible calcular la concentración de equilibrio de los ácidos y bases en solución cuando se conoce el pH. Estos cálculos encuentran aplicación en muchas áreas diferentes de la química, la biología, la medicina y la geología. Por ejemplo, muchos compuestos utilizados para la medicación son ácidos o bases débiles, y se puede utilizar el conocimiento de los valores de pKa, junto con el coeficiente de partición octanol-agua. para estimar la medida en que el compuesto entra en el torrente sanguíneo. Las constantes de disociación ácida también son esenciales en química acuática y oceanografía química, donde la acidez del agua juega un papel fundamental. En los organismos vivos, la homeostasis ácido-base y la cinética enzimática dependen de los valores de pKa de los muchos ácidos y bases presentes en la célula y en el cuerpo. En química, el conocimiento de los valores de pKa es necesario para la preparación de soluciones tampón y también es un requisito previo para una comprensión cuantitativa de la interacción entre ácidos o bases y metales. iones para formar complejos. Experimentalmente, los valores de pKa pueden determinarse mediante valoración potenciométrica (pH), pero para valores de pKa menos de aproximadamente 2 o más de aproximadamente 11, es posible que se requieran mediciones espectrofotométricas o de RMN debido a las dificultades prácticas con las mediciones de pH.
Definiciones
Según la definición molecular original de Arrhenius, un ácido es una sustancia que se disocia en una solución acuosa y libera el ion hidrógeno H (un protón):
- <math alttext="{displaystyle {ce {HA A- + H+}}}" xmlns="http://www.w3.org/1998/Math/MathML">HA↽ ↽ − − − − ⇀ ⇀ A− − +H+{displaystyle {ce {fnMicrosoft Sans Serif} A- + H+}}<img alt="{displaystyle {ce {HA A- + H+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/963f015ff617dc95a47e35c5d64c5e1515e72fc1" style="vertical-align: -0.505ex; width:17.482ex; height:2.843ex;"/>
La constante de equilibrio para esta reacción de disociación se conoce como constante de disociación. El protón liberado se combina con una molécula de agua para dar un ion hidronio (u oxonio) H3O+ (los protones desnudos no existen en solución), por lo que Arrhenius propuso más tarde que la disociación debería escribirse como una reacción ácido-base:
- <math alttext="{displaystyle {ce {HA + H2O A- + H3O+}}}" xmlns="http://www.w3.org/1998/Math/MathML">HA+H2O↽ ↽ − − − − ⇀ ⇀ A− − +H3O+{displaystyle {ce {HA + H2O = {}}}<img alt="{displaystyle {ce {HA + H2O A- + H3O+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/f9f929b936fa45ebaf589df959a776126dbda39a" style="vertical-align: -1.005ex; width:27.791ex; height:3.343ex;"/>
Brønsted y Lowry generalizaron esto a una reacción de intercambio de protones:
- <math alttext="{displaystyle {text{acid}}+{text{base }}{ce {}}{text{ conjugate base}}+{text{conjugate acid}}}" xmlns="http://www.w3.org/1998/Math/MathML">ácido+base↽ ↽ − − − − ⇀ ⇀ base conyugal+ácido conjugado{displaystyle {text{acid}+{text{base # {ce {c} {text{ conjugate base}}{text{conjugate acid}}}}}<img alt="{displaystyle {text{acid}}+{text{base }}{ce {}}{text{ conjugate base}}+{text{conjugate acid}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/990a22f22c6c1ca62978ab86b2d7f8296a038fc8" style="vertical-align: -0.671ex; width:47.944ex; height:3.009ex;"/>
El ácido pierde un protón, dejando una base conjugada; el protón se transfiere a la base, creando un ácido conjugado. Para soluciones acuosas de un ácido HA, la base es agua; la base conjugada es A− y el ácido conjugado es el ion hidronio. La definición de Brønsted-Lowry se aplica a otros solventes, como el sulfóxido de dimetilo: el solvente S actúa como una base, acepta un protón y forma el ácido conjugado SH+.
- <math alttext="{displaystyle {ce {HA + S A- + SH+}}}" xmlns="http://www.w3.org/1998/Math/MathML">HA+S↽ ↽ − − − − ⇀ ⇀ A− − +SH+{displaystyle {ce {HA + S =} A- + SH+}}<img alt="{displaystyle {ce {HA + S A- + SH+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/b36e9ac02f052610d0e069623d6ca0cef1731343" style="vertical-align: -0.505ex; width:22.908ex; height:2.843ex;"/>
En química de soluciones, es común usar H+ como abreviatura de hidrógeno solvatado ión, independientemente del disolvente. En solución acuosa, H+ denota un ion hidronio solvatado en lugar de un protón.
La designación de un ácido o base como "conjugado" depende del contexto. El ácido conjugado BH+ de una base B se disocia según
- <math alttext="{displaystyle {ce {BH+ + OH- B + H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">BH++Oh.− − ↽ ↽ − − − − ⇀ ⇀ B+H2O{displaystyle {ce {BH+ + OH- } {cH0}}}<img alt="{displaystyle {ce {BH+ + OH- B + H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/8fc8af2c412bb12c03d46837a4bbae30c1a60170" style="vertical-align: -1.005ex; width:26.541ex; height:3.343ex;"/>
que es el reverso del equilibrio
- <math alttext="{displaystyle {ce {H2O}}{text{ (acid)}}+{ce {B}}{text{ (base) }}{ce { OH-}}{text{ (conjugate base)}}+{ce {BH+}}{text{ (conjugate acid)}}}" xmlns="http://www.w3.org/1998/Math/MathML">H2O(ácido)+B(base)↽ ↽ − − − − ⇀ ⇀ Oh.− − (Base conyugal)+BH+(ácido conyugal){fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif}} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif}} {fnMicrosoft Sans Serif} {f}}} {fnMicrosoft Sans Serif}} {f}}}} {f}}}}}} {f}}}}}}f}}}}}}}}}}}}}}}}}}}}}}}}}}}}\\\\\\f}}}}}}}}}}}}}}}}}}}}} {f}}}}}}}}}}}}}}}\\\\\\\\f}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {B}{text{ (base)}}{ce {c}{text{text{ (conjugate base)}}}+{ce {BH+}}}{text{ (conjugate acid)}}}}}}}} {f} {f}}} {f}}}}} {f}}} {f}}}}}}} {f}}}}}} {f}}}}}} {f}}}}}} {f}}}}}}}}}}}}} {f}} {f} {f}}}}}}}}}} {f}}}}}}}}}} {f} {f}} {f}}}}}}} {f}}}}}}}}}}}}}} {f}}}}}}}}}}}}}}} {f}}}}}}}}}}}}}}}}}}}}}}<img alt="{displaystyle {ce {H2O}}{text{ (acid)}}+{ce {B}}{text{ (base) }}{ce { OH-}}{text{ (conjugate base)}}+{ce {BH+}}{text{ (conjugate acid)}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/2550397c64354664b21587d6f23834ed4c3a995f" style="vertical-align: -1.005ex; width:73.781ex; height:3.343ex;"/>
El ion hidróxido OH−, una base bien conocida, actúa aquí como base conjugada del agua ácida. Por lo tanto, los ácidos y las bases se consideran simplemente donantes y aceptores de protones, respectivamente.
Una definición más amplia de disociación ácida incluye la hidrólisis, en la que los protones se producen mediante la división de las moléculas de agua. Por ejemplo, el ácido bórico (B(OH)3) produce H3O+ como si fuera un donante de protones, pero se ha confirmado por espectroscopia Raman que esto se debe al equilibrio de hidrólisis:
- <math alttext="{displaystyle {ce {B(OH)3 + 2 H2O B(OH)4- + H3O+}}}" xmlns="http://www.w3.org/1998/Math/MathML">B()Oh.)3+2H2O↽ ↽ − − − − ⇀ ⇀ B()Oh.)4− − +H3O+{displaystyle {ce {B(OH)3 + 2 H2O = {fnMicrosoft Sans Serif}}}}<img alt="{displaystyle {ce {B(OH)3 + 2 H2O B(OH)4- + H3O+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/ed23a610a75938ad6ebe2d6a20a8075ec6e12651" style="vertical-align: -1.005ex; width:39.177ex; height:3.343ex;"/>
Del mismo modo, la hidrólisis de iones metálicos provoca iones como [Al(H2O)6]3+ para comportarse como ácidos débiles:
- <math alttext="{displaystyle {ce {[Al(H2O)6]^3+ + H2O [Al(H2O)5(OH)]^2+ + H3O+}}}" xmlns="http://www.w3.org/1998/Math/MathML">[Al()H2O)6]3++H2O↽ ↽ − − − − ⇀ ⇀ [Al()H2O)5()Oh.)]2++H3O+{displaystyle {ce {[Al(H2O)6]^3+ + H2O }}}}<img alt="{displaystyle {ce {[Al(H2O)6]^3+ + H2O [Al(H2O)5(OH)]^2+ + H3O+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/b1c60923d504a87f8bbd22293ac8eaad8341ea41" style="vertical-align: -1.005ex; width:53.382ex; height:3.509ex;"/>
Según la definición original de Lewis, un ácido es una sustancia que acepta un par de electrones para formar un enlace covalente coordinado.
Constante de equilibrio
Una constante de disociación ácida es un ejemplo particular de una constante de equilibrio. La disociación de un ácido monoprótico, HA, en solución diluida se puede escribir como
- <math alttext="{displaystyle {ce {HA A- + H+}}}" xmlns="http://www.w3.org/1998/Math/MathML">HA↽ ↽ − − − − ⇀ ⇀ A− − +H+{displaystyle {ce {fnMicrosoft Sans Serif} A- + H+}}<img alt="{displaystyle {ce {HA A- + H+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/963f015ff617dc95a47e35c5d64c5e1515e72fc1" style="vertical-align: -0.505ex; width:17.482ex; height:2.843ex;"/>
La constante del equilibrio termodinámico K⊖ ⊖ {displaystyle K^{ominus } puede definirse
- K⊖ ⊖ ={}A− − }{}H+}{}HA}{displaystyle K^{ominus }={frac {ccccccHFF} {fnK}f} {fnK}} {fnK}}}\\f}\\\cH00} {cH00}} {ccHFF} {cHFF}}}}}}\\\\\\\cHFF} {cccHFF}}}}}}\\\\\\\\\\\\\\\\\\cc\\cc\\c\\\ccc\\\\c\\ccccc\ccc\ccccccccccccHFF}}}}}}}}}}}}}}}\cc\cc\\ccH {H+} {fn} {fnK}} {fn}}} {f}} {f}}} {f}} {f}}}} {f}}}}} {f}}}}} {f}}}} {cf}}}} {f}}}}}}}} {c}}}}}}}} {}}}}}}}}} {\\}}}}}}}} {}}}}}}}}}} {}}}} {}}}} {} {}}}}}}}}}}}}}}} {\\\\\\\\\\\\}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {\ {fnK}}}} {f}}}} {f}}}}}}}}}}} {}}}}}}}} { {f}}}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}} {}}}}}}}}} {}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}
Donde {X} representa la actividad, en equilibrio, de la especie química X. K⊖ ⊖ {displaystyle K^{ominus } no tiene dimensión, ya que la actividad no tiene dimensión. Las actividades de los productos de disociación se colocan en el numerador, las actividades de los reaccionarios se colocan en el denominador. Vea el coeficiente de actividad para una derivación de esta expresión.
Dado que la actividad es el producto de la concentración y el coeficiente de actividad (γ), la definición también podría escribirse como
- K⊖ ⊖ =[A− − ][H+][HA].. ,.. =γ γ A− − γ γ H+γ γ HA{displaystyle K^{ominus {fnMicroc {}} {fnh}} {fnh}} {fnh}}} {fnh}}}}} {fn}}} {fn}}} {fn}}} {fn}}}}}}} {f}}}}}} {f}}}}}} {\\f}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {\\\\\\}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {\\\\\\\\\\\\\\\\\\}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} Gamma },quad Gamma ={frac {gamma} ¿Qué? {A^-}} gamma _{ce {H+}}{gamma ¿Qué? }
Donde [HA]{displaystyle [{text{HA}}} representa la concentración de HA y .. {displaystyle "Gamma" es un coeficiente de actividad.
Para evitar las complicaciones implicadas en el uso de actividades, las constantes de disociación se determinan, cuando sea posible, en un medio de alta resistencia iónica, es decir, en condiciones en las que .. {displaystyle "Gamma" se puede suponer que siempre es constante. Por ejemplo, el medio podría ser una solución de 0.1 molar (M) nitrato de sodio o perclorado de potasio de 3 M. Con esta suposición,
- Ka=K⊖ ⊖ .. =[A− − ][H+][HA]{displaystyle K_{text{a}={frac {K^{ominus {fnMicrosoft Sans Serif} {fnMicroc {fnh} {fnh}} {}} {fn}}}
- pKa=− − log10 [A− − ][H+][HA]=log10 [HA][A− − ][H+]{displaystyle mathrm {p} K_{ce [{ce {ce {ce {ce {ce {c}] [{ce {ce {c}} {c}} {c}}}}}=log _{10}frac {ce {ce {c}}}}} {c}}} {c}}}} {cccc}}}}}}}} {cc}}}}}}}}}} {cccccc}}}}}}} {c}}}}}}}}}}} {cccccccccc}}}}}}}}}}}}}}}}}}}} {c}}}}}}}}} {cccc}}}}}}}}}}}}}}}}}} {ccc}}}}}}}}}}}}}} {cc [A^-}] [{ce {c}}} {c}}} {c}}} {c}}} {c}}}}}}} {c}}}}}}} {c}}}}}}} {c}}}}}}}} {c}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}} {}}}}}}}} {}}}}}}}}}}} {}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}
se obtiene. Tenga en cuenta, sin embargo, que todos los valores constantes de disociación publicados se refieren al medio iónico específico utilizado en su determinación y que se obtienen diferentes valores con diferentes condiciones, como se muestra para el ácido acético en la ilustración anterior. Cuando las constantes publicadas se refieren a una fuerza iónica diferente a la requerida para una aplicación particular, se pueden ajustar mediante la teoría de iones específicos (SIT) y otras teorías.
Constantes acumulativas y paso a paso
Un equilibrio acumulativo constante, denotado por β β ,{displaystyle mathrm {beta } está relacionado con el producto de las constantes de paso, denotado por K.{displaystyle mathrm {K} Para un ácido dibásico la relación entre las constantes paso a paso y las constantes globales es la siguiente
- <math alttext="{displaystyle {ce {H2A A^2- + 2H+}}}" xmlns="http://www.w3.org/1998/Math/MathML">H2A↽ ↽ − − − − ⇀ ⇀ A2− − +2H+{displaystyle {ce {ce {cH2A } {cH2A}}}}<img alt="{displaystyle {ce {H2A A^2- + 2H+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/14a583ebc8ff6cd998ff00246bc3cf93e2071dd0" style="vertical-align: -1.005ex; width:20.908ex; height:3.343ex;"/>
- β β 2=[H2A][A2− − ][H+]2{displaystyle beta {fnK} {fnMicroc {cH2A} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} {A^2-}} [{ce {c}}}} {c}}} {c}} {c}}} {c}} {c}}}} {c}}}}}}}} {c}}}} {c}}}}}} {c}}}}}}} {c}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {c}}} {}}}}}}}}}}}}}}} {}}}}}}}} {}}}}}}}}}}}}} {}}}}}}}}}}}}}}}} {}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}
- log β β 2=pKa1+pKa2{displaystyle log beta ¿Qué? {fnK} {fnK}}} {fnK}}}}} {f}}}} {f}}}}} {f}}}}}}}}} {f}}}} {fn}}}}}}}}}}}}}}}}} {f} {f}}}}} {}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}
Obsérvese que en el contexto de la formación de metal-ligand compleja, las constantes de equilibrio para la formación de complejos metálicos se definen generalmente como Asociación constantes. En ese caso, las constantes de equilibrio para la protonación de ligando también se definen como constantes de asociación. La numeración de constantes de asociación es el reverso de la numeración de constantes de disociación; en este ejemplo log β β 1=pKa2{displaystyle log beta ¿Qué?
Constantes de asociación y disociación
Cuando se analizan las propiedades de los ácidos, es habitual especificar las constantes de equilibrio como constantes de disociación ácida, indicadas por Ka, con valores numéricos dados con el símbolo p Ka.
- Kdisoc=[A− − ][H+][HA]:pKa=− − log Kdisoc{displaystyle K_{text{dissoc}={frac {ce {fn} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif}}} {fnMicrosoft Sans Serif}}} {fnMicrosoft}} {f}}} {f}}}}} {cccH}}}}} {f}}}}}}}} {cf}}} {cccccccccccccccccccccccccccc}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {cccccccccccc}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {[HA]}}}mathrm {p} K_{text{a}=-log K_{text{dissoc}}
Por otro lado, las constantes de asociación se utilizan para las bases.
- Kassoc=[HA][A− − ][H+]:pKb=− − log Kassoc{displaystyle K_{text{assoc}={frac {fnz {fn}} {fnh}}}mhm {fnh} {fnh} {fn}}=-log K_{text{assoc}}}} {fnfnfnK}}} {fnf}}} {fnfnKf}}}} {f}}}}}}}}}}}} {f}}}}}}}} {f}}}}}}}}} {f}}}}}} {f}}}}}}}}}}} {f}}}}}}}}}}} {f}}}}} {f}}}}}} {f}}}}}}}}}}}}}}}}}}}}}}}}}} {f}}}}}}} {f}}}}}}}}}}}}}}}}} {f}}}}}}}
Sin embargo, los programas informáticos de uso general que se utilizan para derivar valores constantes de equilibrio a partir de datos experimentales utilizan constantes de asociación tanto para ácidos como para bases. Debido a que las constantes de estabilidad para un complejo metal-ligando siempre se especifican como constantes de asociación, la protonación del ligando también debe especificarse como una reacción de asociación. Las definiciones muestran que el valor de una constante de disociación ácida es el recíproco del valor de la correspondiente constante de asociación.
- Kdisoc=1Kassoc{displaystyle K_{text{dissoc}={frac {1} {K_{text{assoc}}}} {f}} {f}}}} {f}}}}}} {f}}}}}}}} {f}} {f}}}} {f}}}}}}} {}}}}}}}}}} {f}}}}}} {}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}
- log Kdisoc=− − log Kassoc{displaystyle log K_{text{dissoc}=-log K_{text{assoc}}
- pKdisoc=log Kassoc{displaystyle mathrm {p} K_{text{dissoc}=log K_{text{assoc}}
Notas
- Para un ácido o base dado pKa + pKb = pKw, la constante de auto-ionización del agua.
- La constante asociación para la formación de un complejo supramolecular puede ser denotada como Ka; en tales casos "a" significa "asociación", no "ácido".
- Para los ácidos polipóticos, la numeración de constantes de asociación escalonada es el reverso de la numeración de las constantes de disociación. Por ejemplo, para el ácido fósforo (detalles en ácidos #polyprotic, abajo)
- log Kassoc,1=pKdisoc,3log Kassoc,2=pKdisoc,2log Kassoc,3=pKdisoc,1{displaystyle {begin{aligned}log ¿Qué? ¿Qué? ¿Qué?
Dependencia de la temperatura
Todas las constantes de equilibrio varían con la temperatura según la ecuación de van 't Hoff
- dIn ()K)dT=Δ Δ H⊖ ⊖ RT2{displaystyle {frac {mathrm {d} ln left(Kright)}{mathrm {d} T}={frac {Delta H^{ominus } {RT^{2}}}
R{displaystyle R. es la constante del gas y T{displaystyle T} es la temperatura absoluta. Así, para las reacciones exotérmicas, el cambio de enthalpy estándar, Δ Δ H⊖ ⊖ {displaystyle Delta H^{ominus }, es negativo K disminuye con temperatura. Para las reacciones endotérmicas, Δ Δ H⊖ ⊖ {displaystyle Delta H^{ominus } es positivo K aumenta con temperatura.
El cambio de entalpía estándar para una reacción es en sí mismo una función de la temperatura, de acuerdo con la ley termoquímica de Kirchhoff:
- ()∂ ∂ Δ Δ H∂ ∂ T)p=Δ Δ Cp{displaystyle left({frac {partial Delta H}{partial T}right)_{p}= Delta C_{p}
Donde Δ Δ Cp{displaystyle Delta C_{p} es el cambio de capacidad de calor a presión constante. En la práctica Δ Δ H⊖ ⊖ {displaystyle Delta H^{ominus } se puede tomar para ser constante sobre un pequeño rango de temperatura.
Dimensionalidad
En la ecuación
- Ka=[A− − ][H+][HA],{displaystyle K_{mathrm}=mathrm {frac} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif}
Ka parece tener dimensiones de concentración. Sin embargo, desde entonces Δ Δ G=− − RTIn K{displaystyle Delta G=-RTln K}, el equilibrio constante, K{displaystyle K}, no tienen una dimensión física. Esta aparente paradoja puede resolverse de varias maneras.
- Supongamos que el cociente de coeficientes de actividad tiene un valor numérico de 1, de modo que K{displaystyle K} tiene el mismo valor numérico que la constante del equilibrio termodinámico K⊖ ⊖ {displaystyle K^{ominus }.
- Expresar cada valor de concentración como la relación c/c0, donde c0 es la concentración en un estado estándar [hipotético], con un valor numérico de 1, por definición.
- Expresar las concentraciones en la escala de la fracción del topo. Dado que la fracción del topo no tiene dimensión, el cociente de las concentraciones será, por definición, un número puro.
Los procedimientos, (1) y (2), dan valores numéricos idénticos para una constante de equilibrio. Además, desde una concentración ci{displaystyle C_{i} es simplemente proporcional a la fracción del topo xi{displaystyle x_{i}} y densidad *** *** {displaystyle rho }:
- ci=xi*** *** M{displaystyle C_{i}={frac {x_{i}rho } {M}}
y desde la masa molar M{displaystyle M} es una constante en soluciones diluidas, un valor constante de equilibrio determinado mediante (3) será simplemente proporcional a los valores obtenidos con (1) y (2).
Es una práctica común en bioquímica citar un valor con una dimensión como, por ejemplo, "Ka = 30 mM" para indicar la escala, milimolar (mM) o micromolar (μM) de los valores de concentración utilizados para su cálculo.
Ácidos y bases fuertes
Un ácido se clasifica como "fuerte" cuando la concentración de sus especies no disociadas es demasiado baja para ser medida. Cualquier ácido acuoso con un valor de pKa inferior a 0 está casi completamente desprotonado y se considera un ácido fuerte. Todos estos ácidos transfieren sus protones al agua y forman la especie catiónica solvente (H3O+ en solución acuosa) de modo que todos tienen esencialmente la misma acidez, un fenómeno conocido como nivelador de solvente. Se dice que están totalmente disociados en solución acuosa porque la cantidad de ácido no disociado, en equilibrio con los productos de disociación, está por debajo del límite de detección. Asimismo, cualquier base acuosa con una constante de asociación pKb inferior a 0, correspondiente a pKa mayor que aproximadamente 14, se iguala a OH− y se considera una base fuerte.
Ácido nítrico, con un valor pK de ca. -1,7, se comporta como un ácido fuerte en soluciones acuosas con un pH superior a 1. A valores de pH inferiores se comporta como un ácido débil.
Los valores depKa para ácidos fuertes se han estimado por medios teóricos. Por ejemplo, el valor pKa del HCl acuoso se ha estimado en −9,3.
Ácidos monopróticos
Después de reorganizar la expresión definiendo Ka, y poniendo pH = −log10[H+], se obtiene
- pH=pKa+log [A− − ][HA]{displaystyle mathrm {pH} =mathrm {p} K_{text{a}}+log mathrm {frac {frac}{-}}}} {f}}
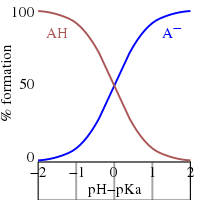
Esta es la ecuación de Henderson-Hasselbalch, de la que se pueden sacar las siguientes conclusiones.
- A media neutralización la relación [A−]/[HA] = 1; desde log(1) = 0, el pH a media neutralización es numéricamente igual a pKa. Por el contrario, cuando pH = pKa, la concentración de HA es igual a la concentración de A−.
- La región de amortiguación se extiende sobre el rango aproximado pKa± 2. Buffering es débil fuera del rango pKa± 1. A pH ≤ pKa − 2 se dice que la sustancia está completamente protonada y a pH ≥ pKa + 2 está totalmente disociado (deprotonado).
- Si se conoce el pH, se puede calcular la relación. Esta relación es independiente de la concentración analítica del ácido.
En el agua, los valores medibles de pKa van desde aproximadamente −2 para un ácido fuerte hasta aproximadamente 12 para un ácido muy débil (o base fuerte).
Se puede preparar una solución tampón de un pH deseado como una mezcla de un ácido débil y su base conjugada. En la práctica, la mezcla se puede crear disolviendo el ácido en agua y agregando la cantidad necesaria de ácido o base fuerte. Cuando se conocen el pKa y la concentración analítica del ácido, el grado de disociación y el pH de una solución de un ácido monoprótico se pueden calcular fácilmente utilizando una tabla ICE.
Ácidos polipróticos
Un ácido poliprótico es un compuesto que puede perder más de 1 protón. Cada una de las constantes de disociación paso a paso se define para la pérdida de un solo protón. La constante de disociación del primer protón se puede denotar como Ka1 y las constantes de disociación de protones sucesivos como Ka2, etc. Ácido fosfórico, H3PO4 , es un ejemplo de ácido poliprótico ya que puede perder tres protones.
Equilibrio pK definición y valor <math alttext="{displaystyle {ce {H3PO4 H2PO4- + H+}}}" xmlns="http://www.w3.org/1998/Math/MathML">H3PO4↽ ↽ − − − − ⇀ ⇀ H2PO4− − +H+{displaystyle {ce {cH3PO4 } {cH3PO4}}}<img alt="{displaystyle {ce {H3PO4 H2PO4- + H+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/0bad230e36d044bc40cd6e601449ac3f51492584" style="vertical-align: -1.005ex; width:25.684ex; height:3.343ex;"/> pKa1=log10 [H3PO4][H2PO4− − ][H+]=2.14{displaystyle mathrm {p} K_{ce {fnK}}=log _{10}{s {ce {ce {fnh_3PO_4}{c} {cc} {c}} {cc}} {cc}}} {cc}}} {ccccc}}}} {c}}}}}} {ccg}}}}} {ccccccccc}}}}}} {c}}}}} {ccccccc}}}}}}}}}}}} {ccccccccccccccccccccccc}}}}}}}}}}}} {cccccccccccccc [H_2PO_4^{-}] [{ce {H^+}}=2.14} <math alttext="{displaystyle {ce {H2PO4- HPO4^2- + H+}}}" xmlns="http://www.w3.org/1998/Math/MathML">H2PO4− − ↽ ↽ − − − − ⇀ ⇀ HPO42− − +H+{displaystyle {ce {e {cH2PO4-0}}}}<img alt="{displaystyle {ce {H2PO4- HPO4^2- + H+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/89871c24183c4690cfb8474b6c32f74ac1a9e05f" style="vertical-align: -1.005ex; width:25.908ex; height:3.343ex;"/> pKa2=log10 [H2PO4− − ][HPO42− − ][H+]=7.2{displaystyle mathrm {p} K_{ce {a2}=log _{10}{frac {cHFF} {H_2PO_4^{-}}} {{ce {c} {c}} {cc}}}}=}= 7.2} <math alttext="{displaystyle {ce {HPO4^2- PO4^3- + H+}}}" xmlns="http://www.w3.org/1998/Math/MathML">HPO42− − ↽ ↽ − − − − ⇀ ⇀ PO43− − +H+{displaystyle {ce {cHPO4^2- }}}}}<img alt="{displaystyle {ce {HPO4^2- PO4^3- + H+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/2cd229dc9b810e10d869d9955b0661aec845dfc4" style="vertical-align: -0.838ex; width:23.933ex; height:3.176ex;"/> pKa3=log10 [HPO42− − ][PO43− − ][H+]=12.37{displaystyle mathrm {p} K_{ce {fnK}} {fnMicroc {cHPO4^2-}}}{ {ce {f}}} {f}}} {cc}}}}}=12.37}}}}} {ccH00}}}} {ccc}}}}}} {ccH00}}}}}}}}}} {ccccH}}}}}}}}}}}}}}}} {ccccccccccccccccccccccc}}}}}}}}}}}}}}}}}}}}}}}}}}}} {ccccc}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {ccc
Cuando la diferencia entre valores sucesivos de pK es de cuatro o más, como en este ejemplo, cada especie puede considerarse como un ácido por derecho propio; De hecho, sales de H
2PO−
4 puede cristalizarse a partir de una solución ajuste del pH a aproximadamente 5,5 y sales de HPO2−4 puede cristalizarse a partir de una solución ajustando el pH a aproximadamente 10. El diagrama de distribución de especies muestra que las concentraciones de los dos iones son máximas en pH 5,5 y 10.
Cuando la diferencia entre los valores sucesivos de pK es menor que aproximadamente cuatro, existe una superposición entre el rango de pH de existencia de las especies en equilibrio. Cuanto menor sea la diferencia, mayor será la superposición. El caso del ácido cítrico se muestra a la derecha; Las soluciones de ácido cítrico se tamponan en todo el rango de pH de 2,5 a 7,5.
Según la primera regla de Pauling, los valores sucesivos de pK de un ácido determinado aumentan (pK a2 > pKa1). Para los oxiácidos con más de un hidrógeno ionizable en el mismo átomo, los valores de pKa a menudo aumentan alrededor de 5 unidades por cada protón eliminado, como en el ejemplo del ácido fosfórico. arriba.
Se puede ver en la tabla anterior que el segundo protón se elimina de una especie cargada negativamente. Dado que el protón lleva una carga positiva, se necesita trabajo adicional para eliminarlo. Por eso pKa2 es mayor que pKa1. pKa3 es mayor que pKa2 porque hay más separación de carga. Cuando se encuentra una excepción a la regla de Pauling, indica que también se está produciendo un cambio importante en la estructura. En el caso de VO+2 (aq), el vanadio es octaédrico, de 6 coordenadas, mientras que el ácido vanádico es tetraédrico, de 4 coordenadas. Esto significa que cuatro "partículas" se liberan con la primera disociación, pero solo dos "partículas" se liberan con las otras disociaciones, lo que da como resultado una contribución de entropía mucho mayor al cambio de energía libre estándar de Gibbs para la primera reacción que para las otras.
Equilibrio pKa <math alttext="{displaystyle {ce {[VO2(H2O)4]+ H3VO4 + H+ + 2H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">[VO2()H2O)4]+↽ ↽ − − − − ⇀ ⇀ H3VO4+H++2H2O{displaystyle {ce {[VO2(H2O)4]+}}<img alt="{displaystyle {ce {[VO2(H2O)4]+ H3VO4 + H+ + 2H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/0b5fcdc28e4fbd98292ebd608643c231844a334f" style="vertical-align: -1.005ex; width:42.02ex; height:3.343ex;"/> pKa1=4.2{displaystyle mathrm {p} K_{a_{1}=4.2} <math alttext="{displaystyle {ce {H3VO4 H2VO4- + H+}}}" xmlns="http://www.w3.org/1998/Math/MathML">H3VO4↽ ↽ − − − − ⇀ ⇀ H2VO4− − +H+{displaystyle {ce {cH3VO4 } {cH3VO4}}}<img alt="{displaystyle {ce {H3VO4 H2VO4- + H+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/82e204dede10cc8bbe3c5c9f9ec19aad64e86744" style="vertical-align: -1.005ex; width:26.005ex; height:3.343ex;"/> pKa2=2.60{displaystyle mathrm {p} K_{a_{2}=2.60} <math alttext="{displaystyle {ce {H2VO4- HVO4^2- + H+}}}" xmlns="http://www.w3.org/1998/Math/MathML">H2VO4− − ↽ ↽ − − − − ⇀ ⇀ HVO42− − +H+{displaystyle {ce {e {cH2VO4-0}}}}}<img alt="{displaystyle {ce {H2VO4- HVO4^2- + H+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/74f85df8ae3b991e20e4904d2557c71d49b180fa" style="vertical-align: -1.005ex; width:26.229ex; height:3.343ex;"/> pKa3=7.92{displaystyle mathrm {p} K_{a_{3}=7.92} <math alttext="{displaystyle {ce {HVO4^2- VO4^3- + H+}}}" xmlns="http://www.w3.org/1998/Math/MathML">HVO42− − ↽ ↽ − − − − ⇀ ⇀ VO43− − +H+{displaystyle {ce {ce {cHVO4^2- }}}}<img alt="{displaystyle {ce {HVO4^2- VO4^3- + H+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/58d9b1ee5e0e1420119a8705d09be0bdabfaa667" style="vertical-align: -0.838ex; width:24.253ex; height:3.176ex;"/> pKa4=13.27{displaystyle mathrm {p} K_{a_{4}=13.27}
Punto isoeléctrico
Para sustancias en solución, el punto isoeléctrico (pI) se define como el pH en el que la suma, ponderada por el valor de la carga, de concentraciones de especies con carga positiva es igual a la suma ponderada de concentraciones de especies cargadas negativamente. En el caso de que exista una especie de cada tipo, el punto isoeléctrico se puede obtener directamente de los valores de pK. Tomemos el ejemplo de la glicina, definida como AH. Hay dos equilibrios de disociación a considerar.
- <math alttext="{displaystyle {ce {AH2+AH+H+qquad [AH][H+]={mathit {K}}_{1}[AH2+]}}}" xmlns="http://www.w3.org/1998/Math/MathML">AH2+↽ ↽ − − − − ⇀ ⇀ AH+H+[AH][H+]=K1[AH2+]{displaystyle {ce {AH2+2}= {cH+qquad [AH]={matit {K}_{1} [AH2+]}}<img alt="{displaystyle {ce {AH2+AH+H+qquad [AH][H+]={mathit {K}}_{1}[AH2+]}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/c7e0e1989f3f6207ba6f5398c6e46fd996ce1921" style="vertical-align: -1.005ex; width:42.809ex; height:3.343ex;"/>
- <math alttext="{displaystyle {ce {AHA-+H+qquad [A-][H+]={mathit {K}}_{2}[AH]}}}" xmlns="http://www.w3.org/1998/Math/MathML">AH↽ ↽ − − − − ⇀ ⇀ A− − +H+[A− − ][H+]=K2[AH]{displaystyle {ce {} {cH+H+qquad [A-][H+]={matit {K}_{2} [AH]}}<img alt="{displaystyle {ce {AHA-+H+qquad [A-][H+]={mathit {K}}_{2}[AH]}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/2bdf0a972f1094effd44243c1e09314d7887d512" style="vertical-align: -1.005ex; width:41.247ex; height:3.343ex;"/>
Sustituya la expresión de [AH] de la segunda ecuación en la primera ecuación
- [A− − ][H+]2=K1K2[AH2+]{fnMitit {fnMitit} {fnMitit} {fnMitit} {fnMitit} {fnMitit}} {fnMitit}} {fnMitit} {f}} {fnMitit} {f}} {fnMitit} {f} {f}f}}}}}}}}}}f} {f} {f} {f}f}f}f}f}f}f}f}f}f}fnMitit}f}f}f}f}f}f}f} {fnMitf}}}}}}}}f}f}}f}f}f}f}f}f}}fnMitfnMitf}f}f}f}f}}}}f}}} {K}_{2} [AH2+]}}
En el punto isoeléctrico, la concentración de las especies con carga positiva, AH+2, es igual a la concentración de las especies cargadas negativamente, A− , entonces
- [H+]2=K1K2{displaystyle [{ce {H+} {2}=K_{1}K_{2}
Por lo tanto, tomando cologaritmos, el pH viene dado por
- pI=pK1+pK22{displaystyle mathrm {p} I={frac {mathrm {p} K_{1}+mathrm {p} K_{2}{2}}}
pI para los aminoácidos se enumeran en el aminoácido proteinogénico. Cuando más de dos especies cargadas están en equilibrio entre sí, puede ser necesario un cálculo de especiación completo.
Bases y basicidad
La constante de equilibrio Kb para una base generalmente se define como la constante de asociación para la protonación de la base, B, para formar la ácido conjugado, HB+.
- <math alttext="{displaystyle {ce {B + H2O HB+ + OH-}}}" xmlns="http://www.w3.org/1998/Math/MathML">B+H2O↽ ↽ − − − − ⇀ ⇀ HB++Oh.− − {displaystyle {ce {B + H2O = {}}}<img alt="{displaystyle {ce {B + H2O HB+ + OH-}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/909f5ab4aba71c3ae912189c432d4cbbc5f053f7" style="vertical-align: -1.005ex; width:26.541ex; height:3.343ex;"/>
Usando un razonamiento similar al usado antes
- Kb=[HB+][OH− − ][B]pKb=− − log10 ()Kb){displaystyle {begin{aligned}K_{text{b} [frac {[HB^{+] [ Oh. {p} ¿Qué?
Kb está relacionado con Ka para el ácido conjugado. En el agua, la concentración del ion hidróxido, [OH−], está relacionada con la concentración de el ion hidrógeno por Kw = [H+][OH−], por lo tanto
- [OH− − ]=Kw[H+]{displaystyle mathrm {}} ={frac {K_{mathrm {fnK} {fnK}} {fnK}} {fnK}} {fnK}}} {fn}} {fn}}} {fn}}} {fnK}}}} {fn}}}} {fnK}}}}}}} {m}}}}} {m}}}} {m}}}}}}}}}}}}} {m} {m}}}}}}}}}}} {m}}}}}} {m}}}}} {m}}} {m}}}}}}}}}}}}}}}}}} {m} {m}} {m}} {m} {m}}}}} {m}}}}}}} {m}}}}}}}}} {m}}}}}}}}}}}}}} {m}}}}}}}}} { }
Sustitución de la expresión de [OH−] en la expresión de Kb da
- Kb=[HB+]Kw[B][H+]=KwKa{displaystyle K_{text{b}={frac [mathrm {cHB^{+}}K_{text{w}{m}{m} {m}} {m}} {fn}}}}} {fn}}}}} {m}}}}}} {m}} {m}}} {m}}}}}}}} {m}}}}}}} {m}}}}}}}}} {m}} {m} {m}}}}}}}} {m}}}}}} {m} {m} {m}}}}}} {m}}}}}}}}}}}}}}}}}} {m} {m} {m} {m}}}}}}}}} {m}} {m}}}}}}}}}}} {m}}}} {m}}}}}}}}}}}}}}}}} {m}}}} [B] [H^{+]] }={frac {K_{text{w}} {K_{text{a}}} {f}} {f}}} {f}}} {f}}}} {f}}}}}} {f}}}}}}}}}}}}}}}}}}} {f}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {
Cuando Ka, Kb y Kw se determinan bajo las mismas condiciones de temperatura y fuerza iónica, se sigue, tomando cologaritmos, que pKb = pK w − pKa. En soluciones acuosas a 25 °C, pKw es 13,9965, por lo que
- pKb.. 14− − pKa{displaystyle mathrm {p} K_{text{b}approx 14-mathrm {p} K_{text{a}}
con suficiente precisión para la mayoría de los propósitos prácticos. En efecto, no hay necesidad de definir pKb por separado de pKa, pero se hace aquí ya que a menudo solo se pueden encontrar valores de pKb en la literatura más antigua.
Para un ion metálico hidrolizado, Kb también se puede definir como una constante de disociación paso a paso
- Mp()Oh.)q⇋ ⇋ Mp()Oh.)q− − 1++Oh.− − {displaystyle mathrm {fnMicrosoft Sans Serif} ################################################################################################################################################################################################################################################################ {fnK})_{q-1} {+}{c} {c} {c}} {c}}}} {cc}}} {c} {c}}} {c}}}} {cc}}}} {cc}}}}c}}}cccc}}}}} {cc}}}}}}}}}}}}}\\ccc}}}}}}}}}}}}}}}}}\\c\\\\\\cc}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}\\\\\\\\\c}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {OH-}}
- Kb=[Mp()Oh.)q− − 1+][Oh.− − ][Mp()Oh.)q]{displaystyle K_{mathrm}={frac {mathrm} _{f} {f} {f} {f}} {f}f}f}} [OH}]_{q-1} {+}] [{ce {fn}} {m}}}} {c}}}}} {cH}}}}} {cH}}}}}
Este es el recíproco de una constante de asociación para la formación del complejo.
Basicidad expresada como constante de disociación del ácido conjugado
Porque la relación pKb = pKw − pKa se mantiene solo en soluciones acuosas (aunque se aplican relaciones análogas para otros solventes anfóteros), las subdisciplinas de la química como la química orgánica que generalmente se ocupan de soluciones no acuosas generalmente no usan pK b como medida de basicidad. En cambio, el pKa del ácido conjugado, denotado por pKaH, se cita cuando la basicidad necesita ser cuantificado. Para la base B y su ácido conjugado BH+ en equilibrio, esto se define como
- pKaH()B)=pKa()BH+)=− − log10 ()[B][H+][BH+]){fnMicrosoft} {fnMicrosoft} {fnMicrosoft} {fnMicrom {f} {fn} {fnMicrom} {fn} {fnMicrosoft}} {fnMicrosoft}} {f}} {f}} {fnMicroc} {f}}} {f} {f} {f}}}} {f}}}} {f}}}}}}} {f} {f}}}}}}}} {f} {f} {f} {f}}}}}}}}}}}} {f}}}}} {f} {f} {f}}}}}} {f}}}} {f} {f}}f}}}}}}}}}}}}}} {f} {f} {f}f}}}}}}}}}}}}}}}} {BH+}}} {Big)}}
Un valor más alto para pKaH corresponde a una base más fuerte. Por ejemplo, los valores pKaH (C5H5N) = 5,25 y pK aH ((CH3CH2)3N) = 10.75 indican que (CH3CH2)3N (trietilamina) es una base más fuerte que C5H5N (piridina).
Sustancias anfóteras
Una sustancia anfótera es aquella que puede actuar como ácido o como base, dependiendo del pH. El agua (abajo) es anfótera. Otro ejemplo de una molécula anfótera es el ion bicarbonato HCO−3 que es la base conjugada de la molécula de ácido carbónico H2CO3 en el equilibrio
- <math alttext="{displaystyle {ce {H2CO3 + H2O HCO3- + H3O+}}}" xmlns="http://www.w3.org/1998/Math/MathML">H2CO3+H2O↽ ↽ − − − − ⇀ ⇀ HCO3− − +H3O+{displaystyle {ce {cH2CO3 + H2O }}}<img alt="{displaystyle {ce {H2CO3 + H2O HCO3- + H3O+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/057b8f579fd09792e0d83547ee505be9c67961fa" style="vertical-align: -1.005ex; width:35.128ex; height:3.343ex;"/>
pero también el ácido conjugado del ion carbonato CO2−3 en (el reverso de) el equilibrio
- <math alttext="{displaystyle {ce {HCO3- + OH- CO3^2- + H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">HCO3− − +Oh.− − ↽ ↽ − − − − ⇀ ⇀ CO32− − +H2O{displaystyle {ce {ce {cHCO3- + OH- }}}}}<img alt="{displaystyle {ce {HCO3- + OH- CO3^2- + H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/7a0bedf8d26dbac0831641468cf29d710bee152d" style="vertical-align: -1.005ex; width:32.555ex; height:3.343ex;"/>
Los equilibrios del ácido carbónico son importantes para la homeostasis ácido-base en el cuerpo humano.
Un aminoácido también es anfótero con la complicación adicional de que la molécula neutra está sujeta a un equilibrio ácido-base interno en el que el grupo amino básico atrae y se une al protón del grupo carboxilo ácido, formando un zwitterión.
- <math alttext="{displaystyle {ce {NH2CHRCO2H NH3+CHRCO2-}}}" xmlns="http://www.w3.org/1998/Math/MathML">NH2CHRCO2H↽ ↽ − − − − ⇀ ⇀ NH3+CHRCO2− − {displaystyle {ce {NH2CHRCO2H } NH3+CHRCO2-}}<img alt="{displaystyle {ce {NH2CHRCO2H NH3+CHRCO2-}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/90fcae69e091ad28ca99b4d7db1e70fbc1260543" style="vertical-align: -1.005ex; width:35.73ex; height:3.343ex;"/>
A un pH inferior a aproximadamente 5, tanto el grupo carboxilato como el grupo amino están protonados. A medida que aumenta el pH, el ácido se disocia de acuerdo con
- <math alttext="{displaystyle {ce {NH3+CHRCO2H NH3+CHRCO2- + H+}}}" xmlns="http://www.w3.org/1998/Math/MathML">NH3+CHRCO2H↽ ↽ − − − − ⇀ ⇀ NH3+CHRCO2− − +H+{displaystyle {ce {NH3+CHRCO2H = ilse= NH3+CHRCO2- + H+}}<img alt="{displaystyle {ce {NH3+CHRCO2H NH3+CHRCO2- + H+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/c57b18b588663ab6f1663f7d0bfdea438f7563a7" style="vertical-align: -1.005ex; width:42.28ex; height:3.343ex;"/>
A un pH alto puede tener lugar una segunda disociación.
- <math alttext="{displaystyle {ce {NH3+CHRCO2- NH2CHRCO2- + H+}}}" xmlns="http://www.w3.org/1998/Math/MathML">NH3+CHRCO2− − ↽ ↽ − − − − ⇀ ⇀ NH2CHRCO2− − +H+{displaystyle {ce {NH3+CHRCO2- }}}<img alt="{displaystyle {ce {NH3+CHRCO2- NH2CHRCO2- + H+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/9a35edad84394fb2ee02b77a37b459630b77c990" style="vertical-align: -1.005ex; width:40.537ex; height:3.343ex;"/>
Por lo tanto, la molécula de aminoácido es anfótera porque puede estar protonada o desprotonada.
Autoionización del agua
La molécula de agua puede ganar o perder un protón. Se dice que es anfiprótico. El equilibrio de ionización se puede escribir
- <math alttext="{displaystyle {ce {H2O OH- + H+}}}" xmlns="http://www.w3.org/1998/Math/MathML">H2O↽ ↽ − − − − ⇀ ⇀ Oh.− − +H+{displaystyle {ce {fnMicrosoft Sans Serif}}<img alt="{displaystyle {ce {H2O OH- + H+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/108572cba335be22ebb605fb7a239fc81b08f8af" style="vertical-align: -1.005ex; width:20.41ex; height:3.343ex;"/>
donde en solución acuosa H+ denota un protón solvatado. A menudo, esto se escribe como el ion hidronio H3O+, pero esta fórmula no es exacta porque de hecho hay solvatación por más de una molécula de agua y especies como H5O+2, H7O+3 y H9O+4 también están presentes.
La constante de equilibrio viene dada por
- Ka=[H+][OH− − ][H2O]{displaystyle ¿Qué? Oh... ¿Qué?
Con soluciones en las que las concentraciones de soluto no son muy altas, la concentración [H2O] se puede suponer que es constante, independientemente de los solutos; esta expresión puede entonces ser reemplazada por
- Kw=[H+][OH− − ]{displaystyle [texto {fn}= [mhhhh}] [mhm {fnh}
La constante de autoionización del agua, Kw, es solo un caso especial de una constante de disociación ácida. También se puede definir una forma logarítmica análoga a pKa
- pKw=− − log10 ()Kw){displaystyle mathrm {p} K_{text{w}=-log _{10}left(K_{text{w}right)}
| T (°C) | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| pKw | 14.943 | 14.734 | 14.535 | 14.346 | 14.167 | 13.997 | 13.830 | 13.680 | 13.535 | 13.396 | 13.262 |
Estos datos se pueden representar mediante una parábola con
- pKw=14.94− − 0,04209T+0,0001718T2{displaystyle mathrm {p}=14.94-0.04209 T+0.0001718 T^{2}
De esta ecuación, pKw = 14 a 24,87 °C. A esa temperatura, tanto los iones de hidrógeno como los de hidróxido tienen una concentración de 10−7 M.
Acidez en soluciones no acuosas
Es más probable que un solvente promueva la ionización de una molécula ácida disuelta en las siguientes circunstancias:
- Es un solvente protico, capaz de formar bonos de hidrógeno.
- Tiene un alto número de donante, lo que lo convierte en una fuerte base de Lewis.
- Tiene una alta constante dieléctrica (permisibilidad relativa), lo que lo convierte en un buen solvente para las especies iónicas.
pKa de los compuestos orgánicos a menudo se obtienen utilizando los disolventes apróticos dimetilsulfóxido (DMSO) y acetonitrilo (ACN).
| Solvent | Número de donante | Constante dieléctrico |
|---|---|---|
| Acetonitrile | 14 | 37 |
| Dimethylsulfoxide | 30 | 47 |
| Agua | 18 | 78 |
El DMSO se usa ampliamente como una alternativa al agua porque tiene una constante dieléctrica más baja que el agua y es menos polar, por lo que disuelve las sustancias hidrofóbicas no polares más fácilmente. Tiene un rango medible de pKa de aproximadamente 1 a 30. El acetonitrilo es menos básico que el DMSO y, por lo tanto, en general, los ácidos son más débiles y las bases son más fuertes en este solvente. Algunos valores de pKa a 25 °C para acetonitrilo (ACN) y dimetilsulfóxido (DMSO). se muestran en las siguientes tablas. Los valores para el agua se incluyen para la comparación.
| HA ⇌ A− + H+ | ACN | DMSO | Agua |
|---|---|---|---|
| p-Toluenesulfónico ácido | 8,5 | 0.9 | Fuerte |
| 2,4-Dinitrophenol | 16.66 | 5.1 | 3.9 |
| Ácido benzoico | 21.51 | 11.1 | 4.2 |
| Ácido acético | 23.51 | 12.6 | 4.756 |
| Phenol | 29.14 | 18.0 | 9.99 |
| BH+ ⇌ B + H+ | ACN | DMSO | Agua |
| Pyrrolidine | 19.56 | 10.8 | 11.4 |
| Triethylamine | 18.82 | 9.0 | 10.72 |
| Esponja protona | 18.62 | 7.5 | 12.1 |
| Pyridine | 12.53 | 3.4 | 5.2 |
| Aniline | 10.62 | 3.6 | 4.6 |
La ionización de los ácidos es menor en un disolvente ácido que en el agua. Por ejemplo, el cloruro de hidrógeno es un ácido débil cuando se disuelve en ácido acético. Esto se debe a que el ácido acético es una base mucho más débil que el agua.
- <math alttext="{displaystyle {ce {HCl + CH3CO2H Cl- + CH3C(OH)2+}}}" xmlns="http://www.w3.org/1998/Math/MathML">HCl+CH3CO2H↽ ↽ − − − − ⇀ ⇀ Cl− − +CH3C()Oh.)2+{displaystyle {ce {cHCl + CH3CO2H Cl- + CH3C(OH)2+}}<img alt="{displaystyle {ce {HCl + CH3CO2H Cl- + CH3C(OH)2+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/0c192c824159eaefd6102eb6f8bd2b126379ce4a" style="vertical-align: -1.005ex; width:42.016ex; height:3.343ex;"/>
- <math alttext="{displaystyle {text{acid}}+{text{base }}{ce {}}{text{ conjugate base}}+{text{conjugate acid}}}" xmlns="http://www.w3.org/1998/Math/MathML">ácido+base↽ ↽ − − − − ⇀ ⇀ base conyugal+ácido conjugado{displaystyle {text{acid}+{text{base # {ce {c} {text{ conjugate base}}{text{conjugate acid}}}}}<img alt="{displaystyle {text{acid}}+{text{base }}{ce {}}{text{ conjugate base}}+{text{conjugate acid}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/990a22f22c6c1ca62978ab86b2d7f8296a038fc8" style="vertical-align: -0.671ex; width:47.944ex; height:3.009ex;"/>
Compare esta reacción con lo que sucede cuando el ácido acético se disuelve en el solvente más ácido ácido sulfúrico puro:
- <math alttext="{displaystyle {ce {H2SO4 + CH3CO2H HSO4- + CH3C(OH)2+}}}" xmlns="http://www.w3.org/1998/Math/MathML">H2SO4+CH3CO2H↽ ↽ − − − − ⇀ ⇀ HSO4− − +CH3C()Oh.)2+{displaystyle {ce {cH2SO4 + CH3CO2H}}}}}<img alt="{displaystyle {ce {H2SO4 + CH3CO2H HSO4- + CH3C(OH)2+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/7a96118b0c5464bf40c77397817f581088b0a3da" style="vertical-align: -1.005ex; width:47.419ex; height:3.343ex;"/>
La improbable especie de diol geminal CH3C(OH)+2 es estable en estos entornos. Para soluciones acuosas, la escala de pH es la función de acidez más conveniente. Se han propuesto otras funciones de acidez para medios no acuosos, siendo la más notable la función de acidez de Hammett, H0, para medios superácidos y su versión modificada H− para medios superbásicos.
En disolventes apróticos, los oligómeros, como el conocido dímero de ácido acético, pueden formarse mediante enlaces de hidrógeno. Un ácido también puede formar enlaces de hidrógeno con su base conjugada. Este proceso, conocido como homoconjugación, tiene el efecto de aumentar la acidez de los ácidos, reduciendo sus valores efectivos de pKa, al estabilizar la base conjugada. La homoconjugación aumenta el poder donador de protones del ácido toluenosulfónico en solución de acetonitrilo en un factor de casi 800.
En soluciones acuosas, la homoconjugación no ocurre porque el agua forma enlaces de hidrógeno más fuertes con la base conjugada que el ácido.
Disolventes mixtos
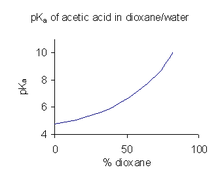
Cuando un compuesto tiene una solubilidad limitada en agua, es una práctica común (en la industria farmacéutica, por ejemplo) determinar los valores de pKa en una mezcla de solventes como agua/dioxano o agua/metanol, en los que el compuesto es más soluble. En el ejemplo que se muestra a la derecha, el valor de pKa aumenta abruptamente con el aumento del porcentaje de dioxano a medida que disminuye la constante dieléctrica de la mezcla.
Un valor de pKa obtenido en un disolvente mixto no se puede utilizar directamente para soluciones acuosas. La razón de esto es que cuando el solvente está en su estado estándar, su actividad se define como una. Por ejemplo, el estado estándar de una mezcla de agua:dioxano con una proporción de mezcla de 9:1 es precisamente esa mezcla de disolventes, sin solutos añadidos. Para obtener el valor de pKa para su uso con soluciones acuosas, debe extrapolarse a una concentración de codisolvente cero a partir de los valores obtenidos de varias mezclas de codisolventes.
Estos hechos están oscurecidos por la omisión del solvente de la expresión que normalmente se usa para definir pKa, pero pK Los valores de a obtenidos en un solvente mixto dado se pueden comparar entre sí, lo que da la fuerza ácida relativa. Lo mismo ocurre con los valores de pKa obtenidos en un disolvente no acuoso particular tal como DMSO.
No se ha desarrollado una escala universal, independiente del solvente, para las constantes de disociación ácida, ya que no existe una forma conocida de comparar los estados estándar de dos solventes diferentes.
Factores que afectan los valores de pKa
La segunda regla de Pauling es que el valor de la primera pKa para ácidos de fórmula XOm(OH)n depende principalmente del número de grupos oxo m, y es aproximadamente independiente del número de grupos hidroxi n, y también del átomo central X. Los valores aproximados de pKa son 8 para m = 0, 2 para m = 1, −3 para m = 2 y < −10 para m = 3. Alternativamente, se han propuesto varias fórmulas numéricas que incluyen pKa = 8 − 5m (conocida como regla de Bell), pKa = 7 − 5m, o pKa = 9 − 7m. La dependencia de m se correlaciona con el estado de oxidación del átomo central, X: cuanto mayor es el estado de oxidación, más fuerte es el oxiácido. Por ejemplo, pKa para HClO es 7,2, para HClO2 es 2,0, para HClO3 es − 1 y HClO4 es un ácido fuerte (pKa ≪ 0). El aumento de la acidez al agregar un grupo oxo se debe a la estabilización de la base conjugada por la deslocalización de su carga negativa sobre un átomo de oxígeno adicional. Esta regla puede ayudar a asignar la estructura molecular: por ejemplo, el ácido fosforoso (H3PO3) tiene un pKa cerca de 2, lo que sugiere que la estructura es HPO(OH)2, como se confirmó posteriormente mediante espectroscopia de RMN, y no P(OH)3, que se esperaría que tener un pKa cerca de 8.
Con los ácidos orgánicos, los efectos inductivos y los efectos mesoméricos afectan los valores de pKa. Un ejemplo simple lo proporciona el efecto de reemplazar los átomos de hidrógeno en el ácido acético por el átomo de cloro más electronegativo. El efecto atractor de electrones del sustituyente facilita la ionización, por lo que los valores sucesivos de pKa disminuyen en la serie 4.7, 2.8, 1.4 y 0.7 cuando 0, 1, 2, o 3 átomos de cloro están presentes. La ecuación de Hammett proporciona una expresión general para el efecto de los sustituyentes.
- log(Ka) = log(K0
a) + ρσ.
Ka es la constante de disociación de un compuesto sustituido, K0
a es la constante de disociación cuando el sustituyente es hidrógeno, ρ es una propiedad del compuesto no sustituido y σ tiene un valor particular para cada sustituyente. Una gráfica de log(Ka) contra σ es una línea recta con intersección log(K0
a ) y pendiente ρ. Este es un ejemplo de una relación de energía libre lineal, ya que log(Ka) es proporcional al cambio de energía libre estándar. Hammett formuló originalmente la relación con los datos del ácido benzoico con diferentes sustituyentes en las posiciones orto- y para-: algunos valores numéricos están en la ecuación de Hammett. Este y otros estudios permitieron ordenar los sustituyentes de acuerdo con su poder de extracción o liberación de electrones, y distinguir entre efectos inductivos y mesoméricos.
Los alcoholes normalmente no se comportan como ácidos en el agua, pero la presencia de un doble enlace adyacente al grupo OH puede disminuir sustancialmente el pKa por el mecanismo de tautomerismo ceto-enol. El ácido ascórbico es un ejemplo de este efecto. La dicetona 2,4-pentanodiona (acetilacetona) también es un ácido débil debido al equilibrio ceto-enólico. En los compuestos aromáticos, como el fenol, que tiene un sustituyente OH, la conjugación con el anillo aromático en su conjunto aumenta mucho la estabilidad de la forma desprotonada.
Los efectos estructurales también pueden ser importantes. La diferencia entre el ácido fumárico y el ácido maleico es un ejemplo clásico. El ácido fumárico es el ácido (E)-1,4-but-2-enodioico, un isómero trans, mientras que el ácido maleico es el correspondiente isómero cis, es decir, (Z)- Ácido 1,4-but-2-enodioico (ver isomería cis-trans). El ácido fumárico tiene valores de pKa de aproximadamente 3,0 y 4,5. Por el contrario, el ácido maleico tiene valores de pKa de aproximadamente 1,5 y 6,5. La razón de esta gran diferencia es que cuando se elimina un protón del isómero cis (ácido maleico), se forma un fuerte enlace de hidrógeno intramolecular con el grupo carboxilo restante cercano. Esto favorece la formación del maleato H+ y se opone a la eliminación del segundo protón de esa especie. En el isómero trans, los dos grupos carboxilo siempre están muy separados, por lo que no se observan enlaces de hidrógeno.
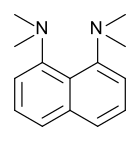
La esponja de protones, 1,8-bis(dimetilamino)naftaleno, tiene un valor de pKa de 12,1. Es una de las bases de amina más fuertes conocidas. La alta basicidad se atribuye al alivio de la tensión tras la protonación y al fuerte enlace de hidrógeno interno.
Los efectos del solvente y la solvatación también deben mencionarse en esta sección. Resulta que estas influencias son más sutiles que las de un medio dieléctrico mencionado anteriormente. Por ejemplo, el orden esperado (por efectos electrónicos de los sustituyentes metilo) y observado en la fase gaseosa de basicidad de las metilaminas, Me3N > Me2NH > MeNH2 > NH3, es transformado por el agua en Me2NH > MeNH2 > Yo3N > NH3. Las moléculas de metilamina neutra están unidas por hidrógeno a las moléculas de agua principalmente a través de la interacción de un aceptor, N-HOH, y solo ocasionalmente solo un enlace donante más, NH-OH2. Por tanto, las metilaminas se estabilizan aproximadamente en la misma medida por hidratación, independientemente del número de grupos metilo. En marcado contraste, los cationes de metilamonio correspondientes siempre utilizan todos los protones disponibles para el enlace donante NH–OH2. La estabilización relativa de los iones de metilamonio disminuye con el número de grupos metilo, lo que explica el orden de basicidad del agua de las metilaminas.
Termodinámica
Una constante de equilibrio está relacionada con el cambio de energía estándar de Gibbs para la reacción, por lo que para una constante de disociación ácida
- Δ Δ G⊖ ⊖ =− − RTIn Ka.. 2.303RTpKa{displaystyle Delta G^{ominus }=-RTln K_{text{a}approx 2.303RT mathrm {p} K_{text{a}}}.
R es la constante de los gases y T es la temperatura absoluta. Tenga en cuenta que pKa = −log(Ka) y 2.303 ≈ ln(10). A 25 °C, ΔG⊖ en kJ·mol−1 ≈ 5,708 pKa (1 kJ·mol−1 = 1000 julios por mol). La energía libre se compone de un término de entalpía y un término de entropía.
- Δ Δ G⊖ ⊖ =Δ Δ H⊖ ⊖ − − TΔ Δ S⊖ ⊖ {displaystyle Delta G^{ominus }=Delta H^{ominus }-TDelta S^{ominus }
El cambio de entalpía estándar puede determinarse mediante calorimetría o utilizando la ecuación de van 't Hoff, aunque es preferible el método calorimétrico. Cuando se han determinado tanto el cambio de entalpía estándar como la constante de disociación ácida, el cambio de entropía estándar se calcula fácilmente a partir de la ecuación anterior. En la siguiente tabla, los términos de entropía se calculan a partir de los valores experimentales de pKa y ΔH⊖. Los datos fueron seleccionados críticamente y se refieren a 25 °C y fuerza iónica cero, en agua.
| Compuesto | Equilibrio | pKa | ΔG⊖ (kJ·mol−1) | ΔH⊖ (kJ·mol−1) | −TΔS⊖ (kJ·mol−1) |
|---|---|---|---|---|---|
| HA = Ácido acético | H+ + A− | 4.756 | 27.147 | −0.41 | 27.56 |
| H2A+ = GlycineH+ | H2A+ ⇌ HA + H+ | 2.351 | 13.420 | 4.00 | 9.419 |
| H+ + A− | 9.78 | 55.825 | 44.20 | 11.6 | |
| H2A = ácido masculino | H2A ⇌ HA− + H+ | 1.92 | 10.76 | 1.10 | 9.85 |
| HA− ⇌ H+ + A2 - 2 | 6.27 | 35.79 | −3.60 | 39.4 | |
| H3A = Ácido cítrico | H3A ⇌ H2A− + H+ | 3.128 | 17.855 | 4.07 | 13.78 |
| H2A− ⇌ HA2 - 2 + H+ | 4.76 | 27.176 | 2.23 | 24.9 | |
| HA2 - 2 ⇌ A3 - 3 + H+ | 6.40 | 36.509 | −3.38 | 39.9 | |
| H3A = Ácido bórico | H3A ⇌ H2A− + H+ | 9.237 | 52.725 | 13.80 | 38.92 |
| H3A = Ácido fósforo | H3A ⇌ H2A− + H+ | 2.148 | 12.261 | 8.00 - | 20.26 |
| H2A− ⇌ HA2 - 2 + H+ | 7.20 | 41.087 | 3.60 | 37,5 | |
| HA2 - 2 ⇌ A3 - 3 + H+ | 12.35 | 80.49 | 16.00 | 54.49 | |
| HA− Sulfato de hidrógeno | HA− ⇌ A2 - 2 + H+ | 1.99 | 11.36 | −22 - 40 | 33.74 |
| H2A = ácido oxálico | H2A ⇌ HA− + H+ | 1.27 | 7.27 | −3.90 | 11.15 |
| HA− ⇌ A2 - 2 + H+ | 4.266 | 24.351 | 7.00 | 31.35 |
- ^ El iión de hidrógeno no existe como tal en la solución. Se combina con una molécula solvente; cuando el disolvente es agua se forma un ión de hidronio: H+ + H2O → H3O+. Esta reacción es cuantitativa y por lo tanto se puede ignorar en el contexto del equilibrio químico.
- ^ Es práctica común citar pK valores en lugar de K valores. pK = −log10 K. pKa a menudo se conoce como una constante de disociación de ácido, pero esto es, estrictamente hablando, incorrecto como pKa es el cologaritmo de la constante de disociación.
- ^ Es implícito en esta definición que el cociente de coeficientes de actividad, γ γ AHγ γ A− − γ γ H+,{displaystyle {frac {gamma} ¿Qué? ¿Qué? ¿Qué? es una constante con un valor de 1 bajo un determinado conjunto de condiciones experimentales.
- ^ ΔG⊖ ■ 2.303RTpKa
- ^ Computado aquí, desde ΔH y ΔG valores suministrados en la citación, utilizando −TΔS⊖ = ΔG⊖ − ΔH⊖
| Compuesto | Equilibrio | pKa | ΔH⊖ (kJ·mol−1) | −TΔS⊖ (kJ·mol−1) |
|---|---|---|---|---|
| B = amoníaco | HB+ ⇌ B + H+ | 9.245 | 51.95 | 0.8205 |
| B = metalamina | HB+ ⇌ B + H+ | 10.645 | 55.34 | 5.422 |
| B = Triethylamine | HB+ ⇌ B + H+ | 10.72 | 43.13 | 18.06 |
El primer punto a tener en cuenta es que, cuando pKa es positivo, el cambio de energía libre estándar para la reacción de disociación también es positivo. En segundo lugar, algunas reacciones son exotérmicas y otras endotérmicas, pero cuando ΔH⊖ es negativo TΔS⊖ es el factor dominante, que determina que ΔG⊖ sea positivo. Por último, la contribución de la entropía siempre es desfavorable (ΔS⊖ < 0) en estas reacciones. Los iones en solución acuosa tienden a orientar las moléculas de agua circundantes, lo que ordena la solución y disminuye la entropía. La contribución de un ion a la entropía es la entropía molar parcial que suele ser negativa, especialmente para iones pequeños o muy cargados. La ionización de un ácido neutro implica la formación de dos iones para que la entropía disminuya (ΔS⊖ < 0). En la segunda ionización del mismo ácido, ahora hay tres iones y el anión tiene carga, por lo que la entropía vuelve a disminuir.
Tenga en cuenta que el cambio de energía libre estándar para la reacción es para los cambios de los reactivos en sus estados estándar a los productos en sus estados estándar. El cambio de energía libre en el equilibrio es cero ya que los potenciales químicos de los reactivos y los productos son iguales en el equilibrio.
Determinación experimental
La determinación experimental de los valores de pKa se realiza comúnmente mediante titulaciones, en un medio de alta fuerza iónica ya temperatura constante. Un procedimiento típico sería el siguiente. Una solución del compuesto en el medio se acidifica con un ácido fuerte hasta el punto en que el compuesto se protona por completo. Luego se titula la solución con una base fuerte hasta que se hayan eliminado todos los protones. En cada punto de la titulación, el pH se mide utilizando un electrodo de vidrio y un medidor de pH. Las constantes de equilibrio se encuentran ajustando los valores de pH calculados a los valores observados, usando el método de mínimos cuadrados.
El volumen total de la base fuerte agregada debe ser pequeño en comparación con el volumen inicial de la solución titulada para mantener la fuerza iónica casi constante. Esto asegurará que pKa permanezca invariable durante la titulación.
A la derecha se muestra una curva de titulación calculada para el ácido oxálico. El ácido oxálico tiene valores de pKa de 1,27 y 4,27. Por lo tanto, las regiones tampón estarán centradas en aproximadamente pH 1,3 y pH 4,3. Las regiones de amortiguamiento llevan la información necesaria para obtener los valores de pKa a medida que cambian las concentraciones de ácido y base conjugada a lo largo de una región de amortiguamiento.
Entre las dos regiones amortiguadoras hay un punto final, o punto de equivalencia, aproximadamente a pH 3. Este punto final no es nítido y es típico de un ácido diprótico cuyas regiones amortiguadoras se superponen en una pequeña cantidad: pKa2 − pKa1 es aproximadamente tres en este ejemplo. (Si la diferencia en los valores de pK fuera de aproximadamente dos o menos, el punto final no se notaría). El segundo punto final comienza con un pH de aproximadamente 6,3 y es nítido. Esto indica que se han eliminado todos los protones. Cuando esto es así, la solución no se tampona y el pH aumenta abruptamente al agregar una pequeña cantidad de base fuerte. Sin embargo, el pH no continúa aumentando indefinidamente. Una nueva región tampón comienza aproximadamente a pH 11 (pKw − 3), que es donde la autoionización del agua se vuelve importante.
Es muy difícil medir valores de pH inferiores a dos en una solución acuosa con un electrodo de vidrio, porque la ecuación de Nernst falla en valores de pH tan bajos. Para determinar los valores de pK de menos de aproximadamente 2 o más de aproximadamente 11, pueden usarse medidas espectrofotométricas o de RMN en lugar de, o combinadas con, medidas de pH.
Cuando no se puede emplear el electrodo de vidrio, como ocurre con las soluciones no acuosas, se utilizan con frecuencia métodos espectrofotométricos. Estos pueden implicar mediciones de absorbancia o fluorescencia. En ambos casos, se supone que la cantidad medida es proporcional a la suma de las contribuciones de cada especie fotoactiva; con mediciones de absorbancia se supone que se aplica la ley de Beer-Lambert.
La calorimetría de titulación isotérmica (ITC) se puede utilizar para determinar tanto un valor pK como la entalpía estándar correspondiente para la disociación ácida. Los fabricantes de instrumentos suministran el software para realizar los cálculos para sistemas simples.
Las soluciones acuosas con agua normal no se pueden usar para mediciones de RMN de 1H pero sí agua pesada, D2 O, debe usarse en su lugar. Sin embargo, los datos de 13C RMN se pueden usar con agua normal y los espectros de 1H RMN se pueden usar con medios no acuosos. Las cantidades medidas con RMN son desplazamientos químicos promediados en el tiempo, ya que el intercambio de protones es rápido en la escala de tiempo de RMN. Se pueden medir otros cambios químicos, como los de 31P.
Microconstantes
Para algunas moléculas, la disociación (o asociación) puede ocurrir en más de un sitio no equivalente, y el equilibrio macroscópico observado constante o macroconstante es una combinación de microconstantes que involucran especies distintas. Cuando uno reaccionante forma dos productos en paralelo, el macroconstant es una suma de dos microconstantes, K=KX+KY.{displaystyle K=K_{X}+K_{Y} Esto es cierto por ejemplo para la deprotonación de la cisteína aminoácida, que existe en la solución como un zwitterion neutral HS−CH2(NH)+3) CO−O−. Los dos microconstantes representan la deprotonación ya sea en azufre o en nitrógeno, y la suma macroconstante aquí es la constante de disociación de ácido Ka=Ka()− − SH)+Ka()− − NH3+).{displaystyle K_{mathrm} }=K_{mathrm {} {ce {cH3+)}}} {fnuncio} {fnuncio}}} {cH3+)}}
Del mismo modo, una base como la espermina tiene más de un sitio donde puede ocurrir la protonación. Por ejemplo, la monoprotonación puede ocurrir en un grupo terminal −NH2 o en un grupo interno −NH−. Los valores de Kb para la disociación de la espermina protonada en uno u otro de los sitios son ejemplos de microconstantes. No pueden determinarse directamente mediante mediciones de pH, absorbancia, fluorescencia o RMN; un valor de Kb medido es la suma de los valores de K para las microrreacciones.
- Kb=Kterminal+Kinterna{displaystyle K_{text{b}=K_{text{terminal}=K_{text{internal}}
Sin embargo, el sitio de protonación es muy importante para la función biológica, por lo que se han desarrollado métodos matemáticos para la determinación de microconstantes.
Cuando dos reaccionarios forman un solo producto en paralelo, el macroconstant 1/K=1/KX+1/KY.{displaystyle 1/K=1/K_{X}+1/K_{Y} Por ejemplo, el equilibrio mencionado para el espermatozoides puede considerarse en términos de Ka valores de dos ácidos conjugados tautoméricos, con macroconstant En este caso 1/Ka=1/Ka,terminal+1/Ka,interna.{displaystyle 1/K_{text{a}}=1/K_{text{a},{text{terminal}}}+1/K_{text{a}},{text{internal}}}} Esto equivale a la expresión anterior desde entonces Kb{displaystyle K_{mathrm {b}} es proporcional a 1/Ka.{displaystyle 1/K_{mathrm {a}
Cuando un reaccionante sufre dos reacciones en serie, el macroconstant para la reacción combinada es el producto del microconstant para los dos pasos. Por ejemplo, la citada cysteine zwitterion puede perder dos protones, uno de azufre y uno de nitrógeno, y el macroconstant general para perder dos protones es el producto de dos constantes de disociación K=Ka()− − SH)Ka()− − NH3+).{displaystyle K=K_{mathrm {} {ce {-SH)}K_{mathrm {}{ce {ce {-NH3+)}}}} Esto también se puede escribir en términos de constantes logarítmicas como pK=pKa()− − SH)+pKa()− − NH3+).{displaystyle mathrm {p} K=mathrm {p}K_{mathrm {a}{ce {}}+mathrm {p} K_{mathrm {a} {}{ce {-NH3+)}}}}}
Aplicaciones y significado
El conocimiento de los valores de pKa es importante para el tratamiento cuantitativo de los sistemas que involucran equilibrios ácido-base en solución. Existen muchas aplicaciones en bioquímica; por ejemplo, los valores de pKa de proteínas y cadenas laterales de aminoácidos son de gran importancia para la actividad de las enzimas y la estabilidad de las proteínas. Los valores de pKa de proteínas no siempre se pueden medir directamente, pero se pueden calcular utilizando métodos teóricos. Las soluciones tampón se utilizan ampliamente para proporcionar soluciones en o cerca del pH fisiológico para el estudio de reacciones bioquímicas; el diseño de estas soluciones depende del conocimiento de los valores pKa de sus componentes. Las soluciones tampón importantes incluyen MOPS, que proporciona una solución con un pH de 7,2, y tricina, que se utiliza en la electroforesis en gel. La amortiguación es una parte esencial de la fisiología ácido-base, incluida la homeostasis ácido-base, y es clave para comprender trastornos como el trastorno ácido-base. El punto isoeléctrico de una molécula dada es una función de sus valores pK, por lo que diferentes moléculas tienen diferentes puntos isoeléctricos. Esto permite una técnica llamada enfoque isoeléctrico, que se utiliza para la separación de proteínas mediante electroforesis en gel de poliacrilamida en gel bidimensional.
Las soluciones tampón también juegan un papel clave en la química analítica. Se utilizan siempre que existe la necesidad de fijar el pH de una solución en un valor particular. En comparación con una solución acuosa, el pH de una solución tampón es relativamente insensible a la adición de una pequeña cantidad de ácido fuerte o base fuerte. La capacidad amortiguadora de una solución amortiguadora simple es máxima cuando el pH = pKa. En la extracción ácido-base, la eficiencia de extracción de un compuesto en una fase orgánica, como un éter, se puede optimizar ajustando el pH de la fase acuosa con un tampón apropiado. Al pH óptimo, se maximiza la concentración de las especies eléctricamente neutras; dicha especie es más soluble en disolventes orgánicos que tienen una constante dieléctrica baja que en agua. Esta técnica se utiliza para la purificación de ácidos y bases débiles.
Un indicador de pH es un ácido débil o una base débil que cambia de color en el rango de pH de transición, que es aproximadamente pKa ± 1. El diseño de un indicador universal El indicador requiere una mezcla de indicadores cuyos valores pKa adyacentes difieran en aproximadamente dos, de modo que sus rangos de pH de transición se superpongan.
En farmacología, la ionización de un compuesto altera su comportamiento físico y macropropiedades como la solubilidad y la lipofilicidad, log p). Por ejemplo, la ionización de cualquier compuesto aumentará la solubilidad en agua, pero disminuirá la lipofilia. Esto se aprovecha en el desarrollo de fármacos para aumentar la concentración de un compuesto en la sangre ajustando el pKa de un grupo ionizable.
El conocimiento de los valores pKa es importante para comprender los complejos de coordinación, que se forman por la interacción de un ion metálico, Mm+, actuando como un ácido de Lewis, con un ligando, L, actuando como una base de Lewis. Sin embargo, el ligando también puede sufrir reacciones de protonación, por lo que la formación de un complejo en solución acuosa podría representarse simbólicamente por la reacción
- <math alttext="{displaystyle [{ce {M(H2O)_{mathit {n}}}}]^{m+}+{ce {LH}} [{ce {M(H2O)}}_{n-1}{ce {L}}]^{(m-1)+}+{ce {H3O+}}}" xmlns="http://www.w3.org/1998/Math/MathML">[M()H2O)n]m++LH↽ ↽ − − − − ⇀ ⇀ [M()H2O)n− − 1L]()m− − 1)++H3O+{fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} {fn} {fn} {fn}}} {fn}}} {fn}}}} {fn}}} {fn}}}}}} {fn}}}}}}} {fn}}}}}}}}} {m+ {c}} {c}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {\\m}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {\\\\\\\c}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {LH = {fn}fn} [{ce {cH2O]}_{n-1}{ce {L}} {m-1)+{ce} {H3O+}}<img alt="{displaystyle [{ce {M(H2O)_{mathit {n}}}}]^{m+}+{ce {LH}} [{ce {M(H2O)}}_{n-1}{ce {L}}]^{(m-1)+}+{ce {H3O+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/696ff04eb241a2f6a358b8dd1b9c373ea3a8c91d" style="vertical-align: -1.171ex; width:54.47ex; height:3.676ex;"/>
Para determinar la constante de equilibrio de esta reacción, en la que el ligando pierde un protón, se debe conocer el pKa del ligando protonado. En la práctica, el ligando puede ser poliprótico; por ejemplo, EDTA4− puede aceptar cuatro protones; en ese caso, todos los valores de pKa deben ser conocidos. Además, el ion metálico está sujeto a hidrólisis, es decir, se comporta como un ácido débil, por lo que también se deben conocer los valores de pK para las reacciones de hidrólisis.
La evaluación del peligro asociado con un ácido o una base puede requerir un conocimiento de los valores de pKa. Por ejemplo, el cianuro de hidrógeno es un gas muy tóxico porque el ion cianuro inhibe la enzima citocromo c oxidasa que contiene hierro. El cianuro de hidrógeno es un ácido débil en solución acuosa con un pKa de aproximadamente 9. En soluciones fuertemente alcalinas, por encima de pH 11, por ejemplo, se deduce que el cianuro de sodio es &# 34;totalmente disociado" por lo que el peligro debido al gas de cianuro de hidrógeno se reduce mucho. Una solución ácida, por otro lado, es muy peligrosa porque todo el cianuro está en su forma ácida. La ingestión de cianuro por vía oral es potencialmente mortal, independientemente del pH, debido a la reacción con la citocromo c oxidasa.
En la ciencia ambiental, los equilibrios ácido-base son importantes para lagos y ríos; por ejemplo, los ácidos húmicos son componentes importantes de las aguas naturales. Otro ejemplo ocurre en oceanografía química: para cuantificar la solubilidad del hierro(III) en agua de mar a varias salinidades, los valores de pKa para la formación del hierro(III) productos de hidrólisis Fe(OH)2+, Fe(OH)+2 y Fe(OH)3 y el producto de solubilidad del hidróxido de hierro.
Valores para sustancias comunes
Existen múltiples técnicas para determinar el pKa de una sustancia química, lo que genera algunas discrepancias entre las distintas fuentes. Los valores bien medidos suelen tener una diferencia de 0,1 unidades entre sí. Los datos presentados aquí se tomaron a 25 °C en agua. Se pueden encontrar más valores en la sección Termodinámica, arriba. Puede encontrar una tabla de pKa de ácidos de carbono, medidos en DMSO, en la página sobre carbaniones.
| Productos químicos | Equilibrio | pKa |
|---|---|---|
| BH = Adenina | BH ⇌ B− + H+ | 4.17 |
| BH+ 2 ⇌ BH + H+ | 9.65 | |
| H3A = ácido arsénico | H3A ⇌ H2A− + H+ | 2.22 |
| H2A− ⇌ HA2 - 2 + H+ | 6.98 | |
| HA2 - 2 ⇌ A3 - 3 + H+ | 11.53 | |
| HA = Ácido benzoico | H+ + A− | 4.204 |
| HA = Ácido butírico | H+ + A− | 4.82 |
| H2A = Ácido cromico | H2A ⇌ HA− + H+ | 0.98 |
| HA− ⇌ A2 - 2 + H+ | 6.5 | |
| B = Codeine | BH+ ⇌ B + H+ | 8.17 |
| HA = Cresol | H+ + A− | 10.29 |
| HA = Ácido formic | H+ + A− | 3.751 |
| HA = Ácido hidrofluorico | H+ + A− | 3.17 |
| HA = Ácido hidrocínico | H+ + A− | 9.21 |
| HA = selenida de hidrógeno | H+ + A− | 3.89 |
| HA = peróxido de hidrógeno (90%) | H+ + A− | 11.7 |
| HA = Ácido láctico | H+ + A− | 3.86 |
| HA = ácido propiónico | H+ + A− | 4.87 |
| HA = Phenol | H+ + A− | 9.99 |
| H2A = L-(+)-Ascorbic Acid | H2A ⇌ HA− + H+ | 4.17 |
| HA− ⇌ A2 - 2 + H+ | 11.57 |
Contenido relacionado
Cianuro de hidrógeno
Escisión del éter
Ley de dalton

![{displaystyle K_{text{a}}=mathrm {frac {[A^{-}][H^{+}]}{[HA]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7cdd9efda0e3a32060020b5c9e5b2c78981b2a93)
![{displaystyle mathrm {p} K_{{ce {a}}}=-log _{10}K_{text{a}}=log _{10}{frac {{ce {[HA]}}}{[{ce {A^-}}][{ce {H+}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d7af05bf129db2f9bc618fe809660b6e4ff8dce9)



![{displaystyle K^{ominus }={{frac {[{ce {A^-}}][{ce {H+}}]}{{ce {[HA]}}}}Gamma },quad Gamma ={frac {gamma _{{ce {A^-}}} gamma _{{ce {H+}}}}{gamma _{{ce {HA}}} }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e9373db7091aeb4f51a26757a677b420f0a8418)
![{displaystyle [{text{HA}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3cfe8305c0735d25de8cef20edf09ef5144d700a)

![{displaystyle K_{text{a}}={frac {K^{ominus }}{Gamma }}=mathrm {frac {[A^{-}][H^{+}]}{[HA]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/2a5a59c740de89347ec4c96d982292fc05c64b2f)
![{displaystyle mathrm {p} K_{{ce {a}}}=-log _{10}{frac {[{ce {A^-}}][{ce {H^+}}]}{[{ce {HA}}]}}=log _{10}{frac {{ce {[HA]}}}{[{ce {A^-}}][{ce {H+}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bed5fbab82167a42994a6d735931d08b06f1e7a5)


![{displaystyle beta _{2}={frac {{ce {[H2A]}}}{[{ce {A^2-}}][{ce {H+}}]^{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/08598ffd39aa7af9e4d7ca73764ada00fdc0882f)


![{displaystyle K_{text{dissoc}}={frac {{ce {[A- ][H+]}}}{{ce {[HA]}}}}:mathrm {p} K_{text{a}}=-log K_{text{dissoc}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c115ab88c5f847b2fe5c3250d9e5c9134d125080)
![{displaystyle K_{text{assoc}}={frac {{ce {[HA]}}}{{ce {[A- ][H+]}}}}:mathrm {p} K_{text{b}}=-log K_{text{assoc}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3deb846eb4a74f9bef1dbc88d83d1060e9aabcb6)










![{displaystyle K_{mathrm {a} }=mathrm {frac {[A^{-}][H^{+}]}{[HA]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/441ece0dee32e0a14fe14d4b1678785804486a92)







![{displaystyle mathrm {pH} =mathrm {p} K_{text{a}}+log mathrm {frac {[A^{-}]}{[HA]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/25e874f2b8ea8e4127605788c356393cfd7fff37)

![{displaystyle mathrm {p} K_{{ce {a1}}}=log _{10}{frac {[{ce {H_3PO_4}}]}{[{ce {H_2PO_4^{-}}}][{ce {H^+}}]}}=2.14}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dff6e67381cb8a691b8873fbf884dad30b001352)
![{displaystyle mathrm {p} K_{{ce {a2}}}=log _{10}{frac {[{ce {H_2PO_4^{-}}}]}{[{ce {HPO_4^{2-}}}][{ce {H^+}}]}}=7.2}](https://wikimedia.org/api/rest_v1/media/math/render/svg/efe9f5a620a62c8de4a6567f58faf01e66829903)
![{displaystyle mathrm {p} K_{{ce {a3}}}=log _{10}{frac {[{ce {HPO4^2-}}]}{[{ce {PO4^3-}}][{ce {H+}}]}}=12.37}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dfac57be595c190a1dc60479c2538e575488de02)
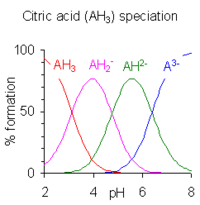




![{displaystyle {ce {[A-][H+]^{2}={mathit {K}}_{1}{mathit {K}}_{2}[AH2+]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/09e3c6432dbe164b30130ce86deaa45a3fc1e559)
![{displaystyle [{ce {H+}}]^{2}=K_{1}K_{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3dfa9985f2d6769f35f98f98153ac6cabd9c011b)

![{displaystyle {begin{aligned}K_{text{b}}&=mathrm {frac {[HB^{+}][OH^{-}]}{[B]}} \mathrm {p} K_{text{b}}&=-log _{10}left(K_{text{b}}right)end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5dea1aac629a595476e18c042a8f4365a50f0efc)
![{displaystyle mathrm {[OH^{-}]} ={frac {K_{mathrm {w} }}{mathrm {[H^{+}]} }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ab7f583da9f8b50145990ffa4342919930edfa16)
![{displaystyle K_{text{b}}={frac {[mathrm {HB^{+}} ]K_{text{w}}}{mathrm {[B][H^{+}]} }}={frac {K_{text{w}}}{K_{text{a}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/921c3abd37a1c5c00c31831509d3b090394c0d47)


![{displaystyle K_{mathrm {b} }={frac {[mathrm {M} _{p}({ce {OH}})_{q-1}^{+}][{ce {OH-}}]}{[mathrm {M} _{p}({ce {OH}})_{q}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8391968e700e57f56f6041dd839f0fdb5e93780e)
![{displaystyle mathrm {p} K_{mathrm {aH} }(mathrm {B})=mathrm {p} K_{mathrm {a} }({ce {BH+}})=-log _{10}{Big (}{frac {[{ce {B}}][{ce {H+}}]}{[{ce {BH+}}]}}{Big)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b76149bc3dbc3d0375d6355bdf2342394a568776)
![{displaystyle K_{text{a}}=mathrm {frac {[H^{+}][OH^{-}]}{[H_{2}O]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cdc540ad193c8f1661c1897698be93153fc5fb84)
![{displaystyle K_{text{w}}=[mathrm {H} ^{+}][mathrm {OH} ^{-}],}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c0039f77db244ea2f6d03d3475dc7a232a8ccb16)