Conrotatorio y disrotatorio
Una reacción electrocíclica puede clasificarse como conrotatoria o disrotatoria según la rotación en cada extremo de la molécula. En el modo conrotatorio, ambos orbitales atómicos de los grupos finales giran en la misma dirección (por ejemplo, ambos orbitales atómicos giran en sentido horario o antihorario). En el modo disrotatorio, los orbitales atómicos de los grupos finales giran en direcciones opuestas (un orbital atómico gira en el sentido de las agujas del reloj y el otro en el sentido contrario). La geometría cis/trans del producto final se decide directamente por la diferencia entre conrotación y disrotación.
Determinar si una reacción en particular es conrotatoria o disrotatoria se puede lograr examinando los orbitales moleculares de cada molécula y mediante un conjunto de reglas. Solo se requieren dos datos para determinar la conrotación o disrotación usando el conjunto de reglas: cuántos electrones hay en el sistema pi y si la reacción es inducida por calor o por luz. Este conjunto de reglas también se puede derivar de un análisis de los orbitales moleculares para predecir la estereoquímica de las reacciones electrocíclicas.
| Sistema | Térmico | Fotoquímico |
|---|---|---|
| electrones "4n" | conrotatorio | disrotatorio |
| "4n + 2" electrones | disrotatorio | conrotatorio |
Ejemplo de una reacción fotoquímica
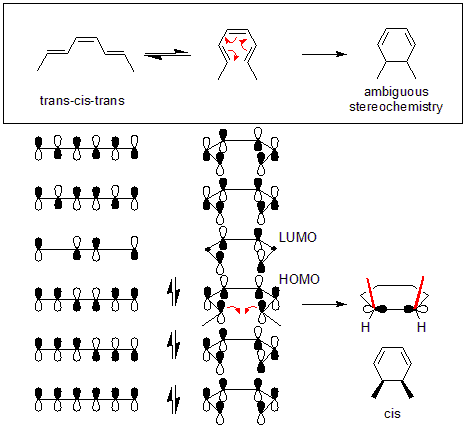
El análisis de una reacción electrocíclica fotoquímica involucra los diagramas HOMO, LUMO y de correlaciones.
Un electrón es promovido al LUMO cambiando el orbital molecular fronterizo involucrado en la reacción.
Ejemplo de una reacción térmica
Suponga que el trans-cis-trans-2,4,6-octatrieno se convierte en dimetilciclohexadieno en condiciones térmicas. Dado que el sustrato octatrieno es una molécula "4n + 2", las reglas de Woodward-Hoffmann predicen que la reacción ocurre en un mecanismo disrotatorio.
Dado que las reacciones electrocíclicas térmicas ocurren en el HOMO, primero es necesario dibujar los orbitales moleculares apropiados. Luego, el nuevo enlace carbono-carbono se forma tomando dos de los orbitales p y girándolos 90 grados (ver diagrama). Dado que el nuevo enlace requiere una superposición constructiva, los orbitales deben rotarse de cierta manera. Realizar una disrotación hará que los dos lóbulos negros se superpongan, formando un nuevo enlace. Por lo tanto, la reacción con el octatrieno ocurre a través de un mecanismo disrotatorio.
Por el contrario, si se hubiera realizado una conrotación, un lóbulo blanco se superpondría con un lóbulo negro. Esto habría causado una interferencia destructiva y no se habría formado ningún nuevo enlace carbono-carbono.
Además, también se puede determinar la geometría cis/trans del producto. Cuando los orbitales p se rotaron hacia adentro, también provocó que los dos grupos metilo rotaran hacia arriba. Dado que ambos metilos apuntan "hacia arriba", el producto es cis -dimetilciclohexadieno.
Contenido relacionado
Richard R Ernst
Polimerización
Estifnato de plomo