Coniina
La coniina es un compuesto químico venenoso, un alcaloide presente y aislable de la cicuta venenosa (Conium maculatum), donde su presencia ha sido una fuente importante de beneficios económicos y médicos., e interés histórico-cultural; La coniina también es producida por la planta jarra amarilla (Sarracenia flava) y el perejil de los tontos (Aethusa cynapium). Su ingestión y exposición prolongada son tóxicas para los humanos y todo tipo de ganado; su mecanismo de envenenamiento implica la alteración del sistema nervioso central, con la muerte causada por parálisis respiratoria. La biosíntesis de coniína contiene como penúltimo paso la ciclación no enzimática de 5-oxooctilamina a γ-coniceína, una base de Schiff que se diferencia de la coniina sólo por su doble enlace carbono-nitrógeno en el anillo. Esta vía da como resultado una coniina natural que es una mezcla (un racemato) compuesta de dos enantiómeros, los estereoisómeros (S)-(+)-coniina y (R)-(−)-coniina, dependiendo del sentido que tome la cadena que se bifurca del anillo. Ambos enantiómeros son tóxicos, siendo el enantiómero (R) el más biológicamente activo y tóxico de los dos en general. La coniina ocupa un lugar en la historia de la química orgánica por ser la primera de una importante clase de alcaloides sintetizada por Albert Ladenburg en 1886, y se ha sintetizado en el laboratorio de diversas formas únicas hasta los tiempos modernos.
El envenenamiento por cicuta ha sido una preocupación humana periódica, una preocupación veterinaria habitual y ha tenido acontecimientos importantes en la historia humana y cultural. En particular, en el año 399 a. C., Sócrates fue condenado a muerte por beber una mezcla de cicuta venenosa que contenía conina.
Orígenes naturales

Hemlock venenosoConium maculatum) contiene cantidades altamente tóxicas de coniina. Su presencia en tierras agrícolas es un problema para los ganaderos porque los animales lo comerán si no están bien alimentados o el hemlock se mezcla con pasto. El coniine está presente en Conium maculatum como una mezcla de los R-(−)- y S-(+)-enantiomers.

Coniine también se encuentra en Sarracenia flavaLa planta de jarra amarilla. La planta de lanzador amarillo es una planta carnívora endémica al sureste de Estados Unidos. La planta utiliza una mezcla de azúcar y coniina para atraer y envenenar simultáneamente insectos, que luego caen en un tubo digestivo. Coniine también se encuentra en Aethusa cynapium, comúnmente conocido como el perejil del tonto.
Historia de los aislamientos naturales
La historia de la coniina está comprensiblemente ligada a la planta venenosa de la cicuta, ya que el producto natural no fue sintetizado hasta la década de 1880. Los judíos en el Medio Oriente fueron envenenados por coniina después de consumir codornices en el área que normalmente comía semillas de cicuta, y los griegos en la isla de Lesbos que también consumían codornices sufrieron el mismo envenenamiento, causando mioglobinuria y lesión renal aguda. El envenenamiento por cicuta más famoso ocurrió en el año 399 a. C., cuando se cree que el filósofo Sócrates consumió un líquido con infusión de cicuta para ejecutar su sentencia de muerte, habiendo sido declarado culpable de impiedad hacia los dioses y corrupción de la juventud. El jugo de cicuta se utilizaba a menudo para ejecutar a criminales en la antigua Grecia.
La cicuta ha tenido un uso médico limitado a lo largo de la historia. Los griegos lo utilizaban no sólo como pena capital, sino también como antiespasmódico y tratamiento para la artritis. Libros del siglo X dan testimonio del uso médico por parte de los anglosajones. En la Edad Media se creía que la cicuta podía usarse para curar la rabia; en la época europea posterior llegó a asociarse con ungüentos voladores en la brujería. Los nativos americanos utilizaban extracto de cicuta como veneno para flechas.
Mientras que la planta de jarra amarilla y el perejil del tonto también contienen coniina, no hay informes de usos tradicionales para estas plantas.
Farmacología y toxicología
ElR)-(−) enantiómero de coniina es el más activo biológicamente, al menos en un sistema (TE-671 células que expresan receptores neuromusculares fetales humanos), y en el bioassay del ratón, el mismo enantiómero y la mezcla racemica son aproximadamente dos veces más tóxicos que el (S)-(+) enantiómero (ver abajo).
La coniina, como racemato o como enantiómero puro, comienza uniéndose y estimulando el receptor nicotínico en la membrana postsináptica de la unión neuromuscular. La despolarización posterior produce toxicidad nicotínica; A medida que la coniina permanece unida al receptor, el nervio permanece despolarizado, inactivándolo. Esto resulta, sistémicamente, en una parálisis fláccida, acción similar a la de la succinilcolina ya que ambos son bloqueadores neuromusculares despolarizantes. Los síntomas de la parálisis generalmente ocurren en media hora, aunque la muerte puede tardar varias horas. El sistema nervioso central no se ve afectado: la persona permanece consciente y alerta hasta que la parálisis respiratoria provoca el cese de la respiración. La parálisis muscular flácida es una parálisis ascendente, afectando en primer lugar a las extremidades inferiores. La persona puede tener una convulsión hipóxica justo antes de la muerte, disfrazada de parálisis muscular, de modo que la persona puede simplemente estremecerse débilmente. La causa de la muerte es la falta de oxígeno al cerebro y al corazón como consecuencia de una parálisis respiratoria, por lo que una persona envenenada puede recuperarse si se puede mantener la ventilación artificial hasta que se elimine la toxina del sistema de la víctima.
Los valores LD50 (en ratones, administrados por vía intravenosa) para los enantiómeros R-(−) y S-(+), y el racemato, son aproximadamente 7, 12 y 8 miligramos por kilogramo, respectivamente.
Propiedades químicas
(+/–)-Coniine fue aislada por primera vez por Giesecke, pero la fórmula fue sugerida por Blyth y definitivamente establecida por Hofmann.
Desde entonces se ha determinado que laD-(S)-Coniina es un líquido alcalino incoloro, de olor penetrante y sabor a quemado; tiene D0° 0.8626 y D19° 0.8438, índice de refracción n< sup>23°D 1.4505, y es dextrógiro, [α]19°D +15.7° (ver comentarios relacionados en Sección de rotación específica a continuación). L-(R)-Coniine tiene [α]21°D 15° y en otros aspectos se parece a su isómero D, pero las sales tienen puntos de fusión ligeramente diferentes; el platinicloruro tiene pf. 160 °C (Löffler y Friedrich informan 175 °C), el pf de auricloruro. 59°C.
Solubilidad
La coniina es ligeramente soluble (1 en 90) en agua fría, menos en agua caliente, por lo que una solución fría transparente se vuelve turbia cuando se calienta. Por otro lado, la base disuelve alrededor del 25% del agua a temperatura ambiente. Se mezcla con alcohol en todas proporciones, es fácilmente soluble en éter y en la mayoría de disolventes orgánicos. La coniina se disuelve en disulfuro de carbono, formando un tiocarbamato complejo.
Cristalización
La coniina se solidifica formando una masa cristalina blanda a -2 °C. Se oxida lentamente en el aire. Las sales cristalizan bien y son solubles en agua o alcohol. El clorhidrato, B·HCl, cristaliza en agua en rombos, pf. 220 °C, [α]20°D +10,1°; el bromhidrato, en agujas, pf. 211 °C, y el tartrato del ácido D, B•C4H6O6•2 H 2O, en cristales rómbicos, pf. 54°C. El clorhidrato de platino, (B•HCl)2•PtCl4•H2O, se separa de la solución concentrada en forma de aceite, que solidifica hasta formar un masa de cristales de color amarillo anaranjado, pf. 175 °C (seco). El auricloruro, B•HAuCl4, cristaliza al reposar, pf. 77°C. El picrato forma pequeñas agujas amarillas, pf. 75 °C, con agua caliente. Los derivados de 2,4-dinitrobenzoílo y 3,5-dinitrobenzoílo tienen pf. 139,0–139,5 °C y 108–9 °C respectivamente. El precipitado producido por la solución de yoduro de potasio y cadmio es cristalino, pf. 118 °C, mientras que la que da la nicotina con este reactivo es amorfa.
Cambios de color
Coniine no da coloración con ácido sulfúrico o nítrico. El nitroprusiato de sodio da un color rojo intenso, que desaparece al calentarse, pero reaparece al enfriarse y los aldehídos lo cambian a azul o violeta.
Rotación específica
La composición estereoquímica de la "coniina" Es una cuestión de cierta importancia, ya que sus dos enantiómeros no tienen propiedades biológicas idénticas, y muchos de los estudios farmacológicos más antiguos sobre este compuesto se llevaron a cabo utilizando la mezcla isomérica natural. S-(+)-Coniine tiene una rotación específica, [α]D, de +8,4° (c = 4,0, en CHCl3). Estos autores señalan que el valor de Ladenburg, +15°, es para una muestra "pura", es decir, sin diluir. Un valor igualmente alto de +16° para la [α]D de "coniine" se proporciona, sin cita explícita de la fuente, en The Merck Index. El valor de +7,7° (c = 4,0, CHCl3) para S-(+)-coniina sintética y -7,9° (c = 0,5, CHCl3) para Otros químicos proporcionan la R-(-)-coniina sintética. Las sales clorhidrato de los enantiómeros (S)-(+) y (R)-(-) de la coniina tienen valores de [α]D de +4,6° y -5,2°, respectivamente (c = 0,5, en metanol).
Síntesis
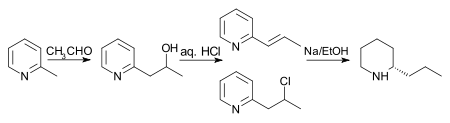
La síntesis original (que se muestra a continuación) de Coniine fue realizada por Ladenburg en 1886. Ladenburg calentó yoduro de N-metilpiridina a 250 °C para obtener 2-metilpiridina. Luego realizó una condensación de Knoevenagel con acetaldehído en cloruro de zinc anhidro para producir 2-propenilpiridina. De hecho, Ladenburg utilizó paraldehído, un trímero cíclico de acetaldehído que forma fácilmente acetaldehído al calentarlo. Finalmente, se redujo 2-propenilpiridina con sodio metálico en etanol para proporcionar conina racémica (±). La cristalización fraccionada de conina racémica con ácido (+)-tartárico produjo conina enantiopura.

El plan propuesto por Ladenburg dio malos resultados, por lo que la búsqueda de rutas alternativas estaba abierta. Se observa un rendimiento ligeramente mejor si se calientan 2-metilpiridina y acetaldehído en un tubo sellado con ácido clorhídrico durante 10 horas. Se forma una mezcla de 2-propenilpiridina y 2-cloropropilpiridina y posteriormente se reduce con sodio en etanol para dar rac-coniina. Nota: aunque el siguiente esquema muestra un solo enantiómero de coniina, la reacción final produce una mezcla racémica que luego se separa
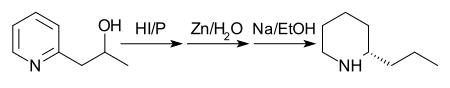
En 1907 se propuso otra ruta con mejor rendimiento. En primer lugar, la 2-(2'-hidroxipropil)piridina se reduce con fósforo y ácido yodhídrico fumante a 125 °C. En segundo lugar, el producto se trata con polvo de zinc y agua. Finalmente, el producto del segundo paso se trata con sodio en etanol. Nota: aunque el siguiente gráfico muestra un único enantiómero de coniina, esta reacción produce una mezcla racémica que luego se purifica y separa.
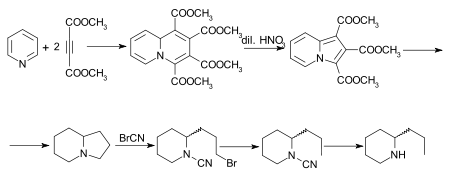
Se han realizado otras síntesis de coniina, de las cuales la de Diels y Alder es de especial interés. El aducto inicial de piridina y acetilendicarboxilato de dimetilo es 1,2,3,4-tetracarboxilato de tetrametilquinolizina, que al oxidarse con ácido nítrico diluido se convierte en indolizina-tricarboxilato de trimetilo. Este, por hidrólisis y descarboxilación, proporciona indolizina, cuyo octahidroderivado, también conocido como octahidropirrocolina, se convierte mediante el método del bromuro de cianógeno sucesivamente en bromocianamida, cianamida y rac.-coniina. Ochiai y Tsuda describen una síntesis del alcaloide a partir de indolizina (pirrocolina).
La preparación de L-(R)-coniina mediante la reducción de β-coniceína (L-propenilpiperidina) por Löffler y Friedrich proporciona medios para convertir conhidrina en L-(R)-coniina. Hess y Eichel informaron, incorrectamente, que la peletierina era el aldehído (β-2-piperidil-propaldehído) correspondiente a la coniina, y produjo rac-coni>ina cuando su hidrazona se calentó con etóxido de sodio en etanol a 156- 170°C. Según estos autores, la D-(S)-coniina se vuelve casi ópticamente inactiva cuando se calienta con hidróxido de bario y alcohol a 180-230 °C. Leithe ha demostrado mediante la observación de la rotación óptica del ácido (+)-pipecólico (ácido piperidina-2-carboxílico) y algunos de sus derivados en diferentes condiciones, que debe pertenecer a la serie D de aminoácidos.
Actualmente, la coniina y muchos otros alcaloides se pueden sintetizar de forma estereoselectiva. Por ejemplo, la reacción de transferencia de quiralidad 1,3 catalizada por Pd puede transformar estereoespecíficamente un único enantiómero de un alcohol alílico en una estructura cíclica (en este caso, una piperidina). De esta manera, a partir de alcohol (S) se obtiene un enantiómero (S) de Coniine y viceversa. Sorprendentemente, la separación del alcohol racémico en diferentes enantiómeros se realiza con la ayuda de la lipasa Candida antarctica.
Biosíntesis
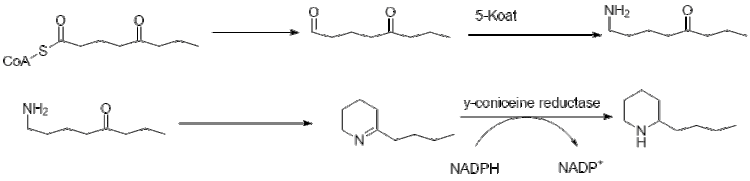
La biosíntesis de la coniina aún se está investigando, pero gran parte de la vía ha sido dilucidada. Originalmente se pensó que usaba 4 grupos acetilo como compuestos de alimentación para la policétido sintasa que forma coniina, de hecho se deriva de dos malonilo y un butiril CoA, que se derivan de la forma habitual de acetil-CoA.
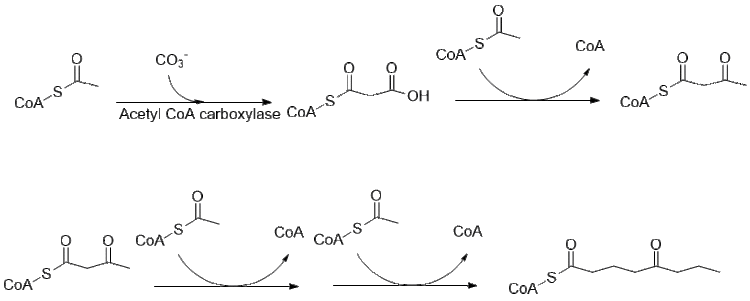
Un mayor alargamiento de butiril-CoA utilizando 2 malonil-CoA forma 5-cetooctal. Luego, el cetooctanal se somete a transaminación utilizando alanina: 5-ceto-octanal aminotransferasa. Luego, la amina se cicla espontáneamente y se deshidrata para formar el precursor de la coniína γ-coniceína. Luego se reduce utilizando la y-coniceína reductasa dependiente de NADPH para formar coniina.
En la cultura popular
Coniine es el arma homicida en la novela de misterio de Agatha Christie Cinco cerditos.
Los estereoisómeros R y S de 2-propilpiperidina son una neurotoxina presente en una forma de vida parecida a una babosa en The Expanse. En el programa se muestra que la toxina causa una muerte casi instantánea al entrar en contacto con la piel.