Compuestos de uranio
Los compuestos de uranio son compuestos formados por el elemento uranio (U). Aunque el uranio es un actínido radiactivo, sus compuestos están muy estudiados debido a su larga vida media y sus aplicaciones. Se forma habitualmente en los estados de oxidación +4 y +6, aunque también puede formarse en otros estados de oxidación.
estados de oxidación y óxidos
Oxides
La torta amarilla de uranio calcinada, tal como se produce en muchas plantas de gran tamaño, contiene una distribución de especies de oxidación de uranio en diversas formas que van desde las más oxidadas a las menos oxidadas. Las partículas con tiempos de residencia cortos en un calcinador generalmente estarán menos oxidadas que aquellas con tiempos de retención largos o las partículas recuperadas en el depurador de chimenea. El contenido de uranio se suele referenciar a U
3O
8, que data de los días del Proyecto Manhattan cuando U
3O
8 se utilizó como estándar de informes de química analítica.
Las relaciones de fases en el sistema uranio-oxígeno son complejas. Los estados de oxidación más importantes del uranio son el uranio (IV) y el uranio (VI), y sus dos óxidos correspondientes son, respectivamente, el dióxido de uranio (UO
2) y el trióxido de uranio (UO
3). Otros óxidos de uranio como el monóxido de uranio (UO), el pentóxido de diuranio (U
2O
5) y peróxido de uranio (UO
2O) también existen.
Las formas más comunes de óxido de uranio son el octóxido de triuranio (U
3OUO
8) y UO
2. Ambas formas de óxido son sólidos que tienen baja solubilidad en agua y son relativamente estables en una amplia gama de condiciones ambientales. El octóxido de triuranio es (dependiendo de las condiciones) el compuesto más estable del uranio y es la forma que se encuentra más comúnmente en la naturaleza. El dióxido de uranio es la forma en la que el uranio se usa más comúnmente como combustible para reactores nucleares. A temperatura ambiente, UO
2 se convertirá gradualmente en U
3O
8. Debido a su estabilidad, los óxidos de uranio se consideran generalmente la forma química preferida para el almacenamiento o la eliminación.
Química acuosa

Las sales de muchos estados de oxidación del uranio son solubles en agua y pueden estudiarse en soluciones acuosas. Las formas iónicas más comunes son U3+
(marrón rojizo), U4+
(verde), UOUO2+
2 (amarillo), para U(III), U(IV), U(V) y U(VI), respectivamente. Existen algunos compuestos sólidos y semimetálicos como UO y US para el estado de oxidación formal uranio(II), pero no se sabe que existan iones simples en solución para ese estado. Los iones de U3+
liberan hidrógeno del agua y, por lo tanto, se consideran altamente inestables. El ion UO2+
2 representa el estado de uranio (VI) y se sabe que forma compuestos como carbonato de uranilo, cloruro de uranilo y sulfato de uranilo. UO2+
2 también forma complejos con varios agentes quelantes orgánicos, el más común de los cuales es el acetato de uranilo.
A diferencia de las sales de uranio de uranio y de las formas catiónicas de óxido de uranio poliatómico, los uranatos, sales que contienen un anión de óxido de uranio poliatómico, generalmente no son solubles en agua.
Carbonates
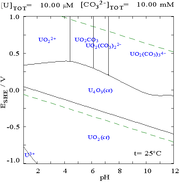
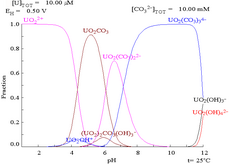
Las interacciones de los aniones carbonato con el uranio(VI) hacen que el diagrama de Pourbaix cambie considerablemente cuando el medio cambia de agua a una solución que contiene carbonato. Si bien la gran mayoría de los carbonatos son insolubles en agua (a menudo se les enseña a los estudiantes que todos los carbonatos, excepto los de metales alcalinos, son insolubles en agua), los carbonatos de uranio suelen ser solubles en agua. Esto se debe a que un catión U(VI) puede unirse a dos óxidos terminales y tres o más carbonatos para formar complejos aniónicos.
Efectos del pH
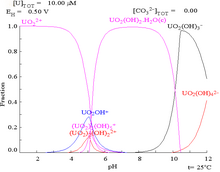
Los diagramas de fracciones de uranio en presencia de carbonato ilustran esto aún más: cuando el pH de una solución de uranio (VI) aumenta, el uranio se convierte en un hidróxido de óxido de uranio hidratado y, a pH altos, se convierte en un complejo de hidróxido aniónico.
Cuando se añade carbonato, el uranio se convierte en una serie de complejos de carbonato si se aumenta el pH. Un efecto de estas reacciones es el aumento de la solubilidad del uranio en el rango de pH de 6 a 8, un hecho que tiene una relación directa con la estabilidad a largo plazo de los combustibles nucleares de dióxido de uranio gastado.
Hidridos, carburos y nitridos
El metal de uranio calentado a una temperatura de entre 250 y 300 °C (482 y 572 °F) reacciona con el hidrógeno para formar hidruro de uranio. Incluso a temperaturas más altas se eliminará de forma reversible el hidrógeno. Esta propiedad hace que los hidruros de uranio sean materiales de partida convenientes para crear polvo de uranio reactivo junto con diversos compuestos de carburo, nitruro y haluros de uranio. Existen dos modificaciones cristalinas del hidruro de uranio: una forma α que se obtiene a bajas temperaturas y una forma β que se crea cuando la temperatura de formación es superior a 250 °C.
Los carburos de uranio y los nitruros de uranio son compuestos semimetálicos relativamente inertes que son mínimamente solubles en ácidos, reaccionan con el agua y pueden encenderse en el aire para formar U
3O
8. Los carburos de uranio incluyen el monocarburo de uranio (U C), el dicarburo de uranio (UC
2) y el tricarburo de diuranio (U
2C
3). Tanto el UC como el UC
2 se forman añadiendo carbono al uranio fundido o exponiendo el metal al monóxido de carbono a altas temperaturas. Estable por debajo de 1800 °C, U
2C
3 se prepara sometiendo una mezcla calentada de UC y UC
2 al estrés mecánico. Los nitruros de uranio obtenidos por exposición directa del metal al nitrógeno incluyen el mononitruro de uranio (UN), el dinitruro de uranio (UN
2) y el trinitruro de diuranio (U
2N
3).
Halides

Todos los fluoruros de uranio se crean utilizando tetrafluoruro de uranio (UF
4); El UF
4 se prepara mediante hidrofluoración de dióxido de uranio. La reducción de UF
4 con hidrógeno a 1000 °C produce trifluoruro de uranio (UF
3). En las condiciones adecuadas de temperatura y presión, la reacción del UF
4 sólido con hexafluoruro de uranio gaseoso (UF
6) puede formar los fluoruros intermedios de U
2F
9, U
4F
UF
5.
A temperatura ambiente, el UF
6 tiene una alta presión de vapor, lo que lo hace útil en el proceso de difusión gaseosa para separar el raro uranio-235 del isótopo común uranio-238. Este compuesto se puede preparar a partir de dióxido de uranio e hidruro de uranio mediante el siguiente proceso:
- UO
2 + 4 HF → UF
4 + 2 H
2O (500 °C, endotérmica) - UF
4 + F
2 → UF
6 (350 °C, endotérmica)
El UF
6 resultante, un sólido blanco, es altamente reactivo (por fluoración), se sublima fácilmente (emite un vapor que se comporta como un gas casi ideal) y es el compuesto de uranio más volátil que se conoce.
Un método para preparar tetracloruro de uranio (UCl
4) es combinar directamente el cloro con uranio metálico o hidruro de uranio. La reducción de UCl
4 por hidrógeno produce tricloruro de uranio (UCl
3), mientras que los cloruros de uranio superiores se preparan por reacción con cloro adicional. Todos los cloruros de uranio reaccionan con agua y aire.
Los bromuros y yoduros de uranio se forman por reacción directa de, respectivamente, bromo y yodo con uranio o añadiendo UH
3 a los ácidos de esos elementos. Los ejemplos conocidos incluyen: UBr
3, UBr
4, IUIU
3 y IU
4. La interfaz de usuario
5 nunca ha estado preparada. Los oxihaluros de uranio son solubles en agua e incluyen UO
2FUOCl
2, ...
2ClUO
2, y UO
2Br
2. La estabilidad de los oxihaluros disminuye a medida que aumenta el peso atómico del haluro componente.
Véase también
- Compuestos de neodimio
- Compuestos de protactinio
- Compuestos de neoptunio
Citaciones
- ^ Kloprogge 2021, págs. 861 a 862.
- ^ Seaborg 1968, pág. 779.
- ^ a b c Argonne Nat.
- ^ a b Seaborg 1968, pág. 778.
- ^ a b c d Puigdomenech, Ignasi Hydra/Medusa Chemical Equilibrium Database and Plotting Software (2004) KTH Royal Institute of Technology, free downloadable software at (Department of Chemistry)
- ^ a b c d e f h i j Seaborg 1968, pág. 782.
- ^ a b Seaborg 1968, pág. 780.
Fuentes
- "Chemical Equilibrium Software". Departamento de Química, KTH Royal Institute of Technology. Archivado desde el original el 29 de septiembre de 2007. Retrieved 29 de septiembre 2007.
- " Formas químicas del uranio". Laboratorio Nacional Argonne. Archivado desde el original el 22 de septiembre de 2006. Retrieved 18 de febrero 2007.
- Kloprogge, J. Theo (2021). La tabla periódica: bloques de construcción de la naturaleza: una introducción a los elementos naturales, sus orígenes y sus usos. Concepción P. Ponce, Tom A. Loomis. Amsterdam: Elsevier. pp. 861–862. ISBN 978-0-12-821538-8. OCLC 1223058470.
- Seaborg, Glenn T. (1968). "Uranio". La enciclopedia de los elementos químicos. Skokie, Illinois: Reinhold Book Corporation. pp. 773–786. LCCN 68029938.