Compuestos de nitrógeno
El nitrógeno es uno de los elementos más abundantes en el universo y puede formar muchos compuestos. Puede adoptar varios estados de oxidación, pero los más comunes son -3 y +3. El nitrógeno puede formar iones nitruro y nitrato. También forma parte del ácido nítrico y de las sales de nitrato. Los compuestos nitrogenados también tienen un papel importante en la química orgánica, ya que el nitrógeno forma parte de las proteínas, los aminoácidos y el trifosfato de adenosina.
Complejos de dintrógeno

El primer ejemplo de un complejo de dinitrógeno que se descubrió fue [Ru(NH3)5(N2)]2+ (ver figura a la derecha), y pronto se descubrieron muchos otros complejos similares. Estos complejos, en los que una molécula de nitrógeno dona al menos un par solitario de electrones a un catión metálico central, ilustran cómo el N2 podría unirse al metal o metales en la nitrogenasa y el catalizador para el proceso Haber: estos procesos que implican la activación del dinitrógeno son de vital importancia en biología y en la producción de fertilizantes.
El dinitrógeno puede coordinarse con los metales de cinco formas diferentes. Las formas mejor caracterizadas son la M←N≡N en el extremo (η1) y la M←N≡N→M (μ, bis-η1), en las que los pares solitarios de los átomos de nitrógeno se donan al catión metálico. Las formas menos caracterizadas implican que el dinitrógeno done pares de electrones del triple enlace, ya sea como ligando puente a dos cationes metálicos (μ, bis-η2) o a uno solo (η2). El quinto y único método implica la triple coordinación como ligando puente, donando los tres pares de electrones del triple enlace (μ3-N2). Algunos complejos presentan múltiples ligandos N2 y algunos presentan N2 unidos de múltiples maneras. Dado que el N2 es isoelectrónico con el monóxido de carbono (CO) y el acetileno (C2H2), la unión en los complejos de dinitrógeno está estrechamente relacionada con la de los compuestos carbonílicos, aunque el N2 es un donador σ y un aceptor π más débil que el CO. Los estudios teóricos muestran que la donación σ es un factor más importante que permite la formación del enlace M–N que la donación inversa π, que en la mayoría de los casos solo debilita el enlace N–N, y la donación de extremo (η1) se logra más fácilmente que la donación de lado (η2).
En la actualidad, se conocen complejos de dinitrógeno para casi todos los metales de transición, lo que representa varios cientos de compuestos. Normalmente se preparan mediante tres métodos:
- Replacing labile ligands such as H2O, H−, or CO directly by nitrogen: these are often reversible reactions that proceed at mild conditions.
- Reducir complejos metálicos en presencia de un coligante adecuado en exceso bajo gas nitrógeno. Una opción común incluye reemplazar los ligandos de cloruro por dimetilfenilfosfina (PMe2Ph) para compensar el menor número de ligandos de nitrógeno unidos que los ligandos de cloro original.
- Convertir un ligando con enlaces N–N, como la hidroazina o la azida, directamente en un ligando dinitrogen.
En ocasiones, el enlace N≡N puede formarse directamente dentro de un complejo metálico, por ejemplo, mediante la reacción directa de amoníaco coordinado (NH3) con ácido nitroso (HNO2), pero esto no es generalmente aplicable. La mayoría de los complejos de dinitrógeno tienen colores dentro del rango blanco-amarillo-naranja-rojo-marrón; se conocen algunas excepciones, como el azul [{Ti(η5-C5H5)2}2-(N2)].
Nitridas, azides y complejos de nitrido
El nitrógeno se enlaza con casi todos los elementos de la tabla periódica, excepto los tres primeros gases nobles, helio, neón y argón, y algunos de los elementos de vida muy corta después del bismuto, creando una inmensa variedad de compuestos binarios con propiedades y aplicaciones variables. Se conocen muchos compuestos binarios: con la excepción de los hidruros, óxidos y fluoruros de nitrógeno, estos se denominan típicamente nitruros. Muchas fases estequiométricas suelen estar presentes para la mayoría de los elementos (por ejemplo, MnN, Mn6N5, Mn3N2, Mn2N, Mn4N y MnxN para 9,2 < x < 25,3). Pueden clasificarse como "similares a las sales" (en su mayoría iónicos), covalentes, "similares al diamante" y metálicos (o intersticiales), aunque esta clasificación tiene limitaciones que generalmente se derivan de la continuidad de los tipos de enlace en lugar de los tipos discretos y separados que implica. Normalmente se preparan mediante la reacción directa de un metal con nitrógeno o amoníaco (a veces después de calentar), o mediante la descomposición térmica de amidas metálicas:
- 3 Ca + N2 → Ca3N2
- 3 Mg + 2 NH3 → Mg3N2 + 3 H2 (a 900 °C)
- 3 Zn(NH)2)2 → Zn3N2 + 4 NH3
Son posibles muchas variantes de estos procesos. Los nitruros más iónicos son los de los metales alcalinos y alcalinotérreos, Li3N (Na, K, Rb y Cs no forman nitruros estables por razones estéricas) y M3N2 (M = Be, Mg, Ca, Sr, Ba). Estos pueden considerarse formalmente como sales del anión N3−, aunque la separación de cargas en realidad no es completa ni siquiera para estos elementos altamente electropositivos. Sin embargo, las azidas de metales alcalinos NaN3 y KN3, que presentan el anión lineal N−
3, son bien conocidas, al igual que Sr(N3)2 y Ba(N3)2. Las azidas de los metales del subgrupo B (los de los grupos 11 a 16) son mucho menos iónicas, tienen estructuras más complicadas y detonan fácilmente cuando se las somete a un choque.
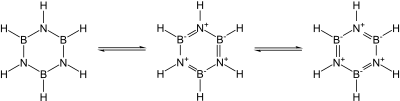
Se conocen muchos nitruros binarios covalentes. Entre los ejemplos se incluyen el cianógeno ((CN)2), el pentanitruro de trifósforo (P3N5), el dinitruro de disulfuro (S2N2) y el tetranitruro de tetrasulfuro (S4N4). También se conocen el nitruro de silicio (Si3N4) y el nitruro de germanio (Ge3N4), que son esencialmente covalentes. El nitruro de silicio, en particular, sería un material cerámico prometedor si no fuera por la dificultad de trabajarlo y sinterizarlo. En particular, los nitruros del grupo 13, la mayoría de los cuales son semiconductores prometedores, son isoelectrónicos con el grafito, el diamante y el carburo de silicio y tienen estructuras similares: su enlace cambia de covalente a parcialmente iónico y metálico a medida que se desciende en el grupo. En particular, dado que la unidad B–N es isoelectrónica con respecto a C–C, y el carbono es esencialmente de tamaño intermedio entre el boro y el nitrógeno, gran parte de la química orgánica encuentra un eco en la química boro-nitrógeno, como en la borazina ("benceno inorgánico"). Sin embargo, la analogía no es exacta debido a la facilidad de ataque nucleofílico en el boro debido a su deficiencia de electrones, lo que no es posible en un anillo que contiene completamente carbono.
La categoría más grande de nitruros son los nitruros intersticiales de fórmulas MN, M2N y M4N (aunque es perfectamente posible que tengan una composición variable), en los que los pequeños átomos de nitrógeno se encuentran en los huecos de una red metálica compacta, cúbica o hexagonal. Son opacos, muy duros y químicamente inertes, fundiéndose sólo a temperaturas muy altas (generalmente superiores a 2500 °C). Tienen un brillo metálico y conducen la electricidad como los metales. Se hidrolizan sólo muy lentamente para dar amoníaco o nitrógeno.
El anión nitruro (N3−) es el donante de π más fuerte conocido entre los ligandos (el segundo más fuerte es O2−). Los complejos de nitruro se forman generalmente por descomposición térmica de azidas o por desprotonación de amoníaco, y suelen incluir un grupo terminal {≡N}3−. El anión azida lineal (N−
3), al ser isoelectrónico con el óxido nitroso, el dióxido de carbono y el cianato, forma muchos complejos de coordinación. Es poco frecuente que se produzcan más concatenaciones, aunque se conoce la presencia de N4−
4 (isoelectrónica con carbonato y nitrato).
Hidrides

El amoniaco (NH3) es el compuesto más importante del nitrógeno en la industria y se prepara en mayores cantidades que cualquier otro compuesto, ya que contribuye significativamente a las necesidades nutricionales de los organismos terrestres al servir como precursor de alimentos y fertilizantes. Es un gas alcalino incoloro con un olor penetrante característico. La presencia de enlaces de hidrógeno tiene efectos muy significativos en el amoniaco, lo que le confiere sus altos puntos de fusión (−78 °C) y ebullición (−33 °C). Como líquido, es un muy buen disolvente con un alto calor de vaporización (lo que permite su uso en frascos de vacío), que también tiene una baja viscosidad y conductividad eléctrica y una constante dieléctrica alta, y es menos denso que el agua. Sin embargo, el enlace de hidrógeno en NH3 es más débil que en H2O debido a la menor electronegatividad del nitrógeno en comparación con el oxígeno y la presencia de solo un par solitario en NH3 en lugar de dos en H2O. Es una base débil en solución acuosa (pKb 4,74); su ácido conjugado es amonio, NH+
4. También puede actuar como un ácido extremadamente débil, perdiendo un protón para producir el anión amida, NH−
2. Por lo tanto, sufre una autodisociación, similar al agua, para producir amonio y amida. El amoníaco arde en aire u oxígeno, aunque no fácilmente, para producir gas nitrógeno; arde en flúor con una llama de color amarillo verdoso para dar trifluoruro de nitrógeno. Las reacciones con otros no metales son muy complejas y tienden a dar lugar a una mezcla de productos. El amoníaco reacciona con los metales al calentarlo para formar nitruros.
Se conocen muchos otros hidruros de nitrógeno binarios, pero los más importantes son la hidracina (N2H4) y la azida de hidrógeno (HN3). Aunque no es un hidruro de nitrógeno, la hidroxilamina (NH2OH) es similar en propiedades y estructura al amoníaco y a la hidracina. La hidracina es un líquido incoloro y humeante que huele de manera similar al amoníaco. Sus propiedades físicas son muy similares a las del agua (punto de fusión 2,0 °C, punto de ebullición 113,5 °C, densidad 1,00 g/cm3). A pesar de ser un compuesto endotérmico, es cinéticamente estable. Arde rápidamente y completamente en el aire de manera muy exotérmica para dar nitrógeno y vapor de agua. Es un agente reductor muy útil y versátil y es una base más débil que el amoníaco. También se usa comúnmente como combustible para cohetes.
La hidrazina se obtiene generalmente por reacción del amoníaco con hipoclorito de sodio alcalino en presencia de gelatina o pegamento:
- NH3 + OCl− → NH2Cl + OH−
- NH2Cl + NH3 → N
2H+
5 + Cl− (slow) - N
2H+
5 + OH− → N2H4 + H2O (rápido)
(Los ataques del hidróxido y el amoníaco pueden revertirse, pasando así a través del intermediario NHCl−). La razón para agregar gelatina es que elimina iones metálicos como Cu2+ que cataliza la destrucción de la hidrazina por reacción con monocloramina (NH2Cl) para producir cloruro de amonio y nitrógeno.
La azida de hidrógeno (HN3) se produjo por primera vez en 1890 mediante la oxidación de hidrazina acuosa con ácido nitroso. Es muy explosiva e incluso las soluciones diluidas pueden ser peligrosas. Tiene un olor desagradable e irritante y es un veneno potencialmente letal (pero no acumulativo). Puede considerarse el ácido conjugado del anión azida y es análogo a los ácidos hidrohalogenados.
Halidos y oxohalides

Se conocen los cuatro trihaluros de nitrógeno simples. Se conocen algunos haluros mixtos e hidrohaluros, pero en su mayoría son inestables; algunos ejemplos son NClF2, NCl2F, NBrF2, NF2H, NFH2, NCl2H y NClH2.
Se conocen cinco fluoruros de nitrógeno. El trifluoruro de nitrógeno (NF3, preparado por primera vez en 1928) es un gas incoloro e inodoro, termodinámicamente estable, que se produce más fácilmente mediante la electrólisis del fluoruro de amonio fundido disuelto en fluoruro de hidrógeno anhidro. Al igual que el tetrafluoruro de carbono, no es en absoluto reactivo y es estable en agua o en ácidos o álcalis acuosos diluidos. Sólo cuando se calienta actúa como agente fluorante y reacciona con cobre, arsénico, antimonio y bismuto al contacto a altas temperaturas para dar tetrafluorohidrazina (N2F4). Los cationes NF+
4 y N
2F+
3 también se conocen (este último por la reacción de tetrafluorohidrazina con fuertes aceptores de fluoruro como El pentafluoruro de arsénico (ONF3) ha despertado interés debido a la corta distancia N–O que implica un doble enlace parcial y al enlace N–F muy polar y largo. La tetrafluorohidrazina, a diferencia de la propia hidrazina, puede disociarse a temperatura ambiente y superior para dar el radical NF2. La azida de flúor (FN3) es muy explosiva y térmicamente inestable. El difluoruro de dinitrógeno (N2F2) existe como isómeros cis y trans térmicamente interconvertibles y se encontró por primera vez como producto de la descomposición térmica de FN3.
Se conocen dos series de oxohaluros de nitrógeno: los haluros de nitrosilo (XNO) y los haluros de nitrilo (XNO2). Los primeros son gases muy reactivos que se pueden obtener halogenando directamente el óxido nitroso. El fluoruro de nitrosilo (NOF) es incoloro y un potente agente fluorante. El fluoruro de nitrosilo puede continuar reaccionando con el flúor para formar trifluoruro de óxido de nitrógeno, que también es un potente agente fluorante. El cloruro de nitrosilo (NOCl) se comporta de forma muy similar y se ha utilizado a menudo como disolvente ionizante. El bromuro de nitrosilo (NOBr) es rojo. Las reacciones de los haluros de nitrilo son en su mayoría similares: el fluoruro de nitrito (FNO2) y el cloruro de nitrito (ClNO2) son igualmente gases reactivos y potentes agentes halogenantes.
Oxides

2 convertidos a tetroxido de dintrógeno incoloroN
2O
4) a bajas temperaturas, y revierte a NO
2 a temperaturas más altas.
El nitrógeno forma nueve óxidos moleculares, algunos de los cuales fueron los primeros gases en ser identificados: N2O (óxido nitroso), NO (óxido nítrico), N2O3 (trióxido de dinitrógeno), NO2 (dióxido de nitrógeno), N2O4 (tetróxido de dinitrógeno), N2O5 (pentóxido de dinitrógeno), N4O (azida de nitrosilo) y N(NO2)3 (trinitramida). Todos son térmicamente inestables a la descomposición de sus elementos. Otro posible óxido que aún no ha sido sintetizado es el oxatetrazol (N4O), un anillo aromático.
El óxido nitroso (N2O), más conocido como gas de la risa, se obtiene por descomposición térmica del nitrato de amonio fundido a 250 °C. Se trata de una reacción redox y, por lo tanto, también se producen óxido nítrico y nitrógeno como subproductos. Se utiliza principalmente como propulsor y agente aireante para la nata montada en lata en aerosol, y antiguamente se utilizaba comúnmente como anestésico. A pesar de las apariencias, no se puede considerar que sea el anhídrido del ácido hiponitroso (H2N2O2) porque ese ácido no se produce por la disolución del óxido nitroso en agua. Es poco reactivo (no reacciona con los halógenos, los metales alcalinos ni el ozono a temperatura ambiente, aunque su reactividad aumenta con el calor) y tiene una estructura asimétrica N–N–O (N≡N+O−↔−N=N+=O): por encima de los 600 °C se disocia rompiendo el enlace N–O más débil. El óxido nítrico (NO) es la molécula estable más simple con un número impar de electrones. En los mamíferos, incluidos los humanos, es una importante molécula de señalización celular implicada en muchos procesos fisiológicos y patológicos. Se forma por oxidación catalítica del amoníaco. Es un gas paramagnético incoloro que, al ser termodinámicamente inestable, se descompone en nitrógeno y oxígeno gaseoso a 1100–1200 °C. Su enlace es similar al del nitrógeno, pero se añade un electrón extra a un orbital antienlazante π* y, por lo tanto, el orden de enlace se ha reducido a aproximadamente 2,5; por lo tanto, la dimerización a O=N–N=O es desfavorable excepto por debajo del punto de ebullición (donde el isómero cis es más estable) porque en realidad no aumenta el orden de enlace total y porque el electrón desapareado está deslocalizado a través de la molécula de NO, lo que le otorga estabilidad. También hay evidencia del dímero rojo asimétrico O=N–O=N cuando el óxido nítrico se condensa con moléculas polares. Reacciona con el oxígeno para dar dióxido de nitrógeno marrón y con halógenos para dar haluros de nitrosilo. También reacciona con compuestos de metales de transición para dar complejos de nitrosilo, la mayoría de los cuales son de color intenso. El trióxido de dinitrógeno azul (N2O3) sólo está disponible en forma sólida porque se disocia rápidamente por encima de su punto de fusión para dar óxido nítrico, dióxido de nitrógeno (NO2) y tetróxido de dinitrógeno (N2O4). Los dos últimos compuestos son algo difíciles de estudiar individualmente debido al equilibrio entre ellos, aunque a veces el tetróxido de dinitrógeno puede reaccionar por fisión heterolítica para formar nitrosonio y nitrato en un medio con una constante dieléctrica alta. El dióxido de nitrógeno es un gas marrón acre y corrosivo. Ambos compuestos se pueden preparar fácilmente descomponiendo un nitrato metálico seco. Ambos reaccionan con agua para formar ácido nítrico. El tetróxido de dinitrógeno es muy útil para la preparación de nitratos metálicos anhidros y complejos de nitratos, y se convirtió en el oxidante almacenable de elección para muchos cohetes tanto en los Estados Unidos como en la URSS a fines de la década de 1950. Esto se debe a que es un propulsor hipergólico en combinación con un combustible para cohetes a base de hidracina y se puede almacenar fácilmente ya que es líquido a temperatura ambiente. El pentóxido de dinitrógeno (N2O5), térmicamente inestable y muy reactivo, es el anhídrido del ácido nítrico y se puede obtener a partir de él por deshidratación con pentóxido de fósforo. Es de interés para la preparación de explosivos. Es un sólido cristalino delicuescente, incoloro y sensible a la luz. En estado sólido es iónico con estructura [NO2]+[NO3]−; como gas y en solución es molecular O2N–O–NO2. La hidratación a ácido nítrico se produce fácilmente, al igual que una reacción análoga con peróxido de hidrógeno que da lugar al ácido peroxonítrico (HOONO2). Es un agente oxidante violento. El pentóxido de dinitrógeno gaseoso se descompone de la siguiente manera:- N2O5 NO2 + NO3 → NO2 + O2 + NO
- N2O5 NO ⇌ 3 NO2
Oxoácidos, oxoaniones y sales de oxoácidos
Se conocen muchos oxoácidos nitrogenados, aunque la mayoría de ellos son inestables como compuestos puros y sólo se conocen como solución acuosa o como sales. El ácido hiponitroso (H2N2O2) es un ácido diprótico débil con la estructura HON=NOH (pKa1 6,9, pKa2 11,6). Las soluciones ácidas son bastante estables, pero por encima de un pH de 4 se produce una descomposición catalizada por bases a través de [HONNO]− hasta óxido nitroso y el anión hidróxido. Hiponitrilos (que involucran el N
2O2−
2 anión) son estables a los agentes reductores y más comúnmente actúan como agentes reductores ellos mismos. Son un paso intermedio en la oxidación del amoníaco a nitrito, que ocurre en el ciclo del nitrógeno. El hiponitrito puede actuar como un ligando bidentado quelante o puente.
El ácido nitroso (HNO2) no se conoce como un compuesto puro, pero es un componente común en los equilibrios gaseosos y es un reactivo acuoso importante: sus soluciones acuosas pueden prepararse a partir de la acidificación de soluciones acuosas frías de nitrito (NO−
2, bent) aunque ya a temperatura ambiente se produce una desproporción con el nitrato y el nítrico. El óxido de nitroso es significativo. Es un ácido débil con pKa 3,35 a 18 °C. Se pueden analizar titulándolos por oxidación a nitrato con permanganato. Se reducen fácilmente a óxido nitroso y óxido nítrico con dióxido de azufre, a ácido hiponitroso con estaño(II) y a amoníaco con sulfuro de hidrógeno. Sales de hidrazinio N
2H+
5 reaccionan con ácido nitroso para producir azidas que reaccionan para dar óxido nitroso y nitrógeno. El nitrito de sodio es ligeramente tóxico en concentraciones superiores a 100 mg/kg, pero a menudo se utilizan pequeñas cantidades para curar la carne y como conservante para evitar el deterioro bacteriano. También se utiliza para sintetizar hidroxilamina y diazotar aminas aromáticas primarias de la siguiente manera:
- ArNH2 + HNO2 → [ArNN]Cl + 2 H2O
El nitrito también es un ligando común que puede coordinarse de cinco maneras. Las más comunes son el nitro (unido a partir del nitrógeno) y el nitrito (unido a partir del oxígeno). La isomería nitro-nitrito es común, donde la forma nitrito suele ser menos estable.

El ácido nítrico (HNO3) es, con diferencia, el más importante y el más estable de los oxoácidos nitrogenados. Es uno de los tres ácidos más utilizados (los otros dos son el ácido sulfúrico y el ácido clorhídrico) y fue descubierto por primera vez por los alquimistas en el siglo XIII. Se obtiene por oxidación catalítica del amoníaco a óxido nítrico, que se oxida a dióxido de nitrógeno y luego se disuelve en agua para dar ácido nítrico concentrado. En los Estados Unidos de América, se producen más de siete millones de toneladas de ácido nítrico cada año, la mayoría de las cuales se utilizan para la producción de nitrato para fertilizantes y explosivos, entre otros usos. El ácido nítrico anhidro se puede obtener destilando ácido nítrico concentrado con pentóxido de fósforo a baja presión en un aparato de vidrio en la oscuridad. Sólo se puede obtener en estado sólido, porque al fundirse se descompone espontáneamente en dióxido de nitrógeno, y el ácido nítrico líquido sufre una autoionización en mayor medida que cualquier otro líquido covalente, como se indica a continuación:
- 2 HNO3 ⇌ H
2NO+
3 + NO−
3 ⇌ H2O + [NO2]+ [NO]3]−
Se sabe que dos hidratos, HNO3·H2O y HNO3·3H2O, pueden cristalizarse. Es un ácido fuerte y las soluciones concentradas son agentes oxidantes fuertes, aunque el oro, el platino, el rodio y el iridio son inmunes al ataque. Una mezcla 3:1 de ácido clorhídrico concentrado y ácido nítrico, llamada agua regia, es aún más fuerte y disuelve con éxito el oro y el platino, porque se forman cloro libre y cloruro de nitrosilo y los aniones cloruro pueden formar complejos fuertes. En el ácido sulfúrico concentrado, el ácido nítrico se protona para formar nitronio, que puede actuar como electrófilo para la nitración aromática:
- HNO3 + 2 H2Así que...4 ⇌ NO+
2 + H3O+ + 2 HSO−
4
La estabilidad térmica de los nitratos (que involucran al anión trigonal planar NO−
3) depende de la basicidad del metal, y también lo hacen los productos de descomposición (termólisis), que pueden variar entre el nitrito (por ejemplo, sodio), el óxido (potasio y plomo) o incluso el metal mismo (plata) dependiendo de su relación Estabilidades. El nitrato también es un ligando común con muchos modos de coordinación.
Por último, aunque el ácido ortonítrico (H3NO4), que sería análogo al ácido ortofosfórico, no existe, el anión ortonitrato tetraédrico NO3−
4 es conocido en sus sales de sodio y potasio:
Estas sales cristalinas blancas son muy sensibles al vapor de agua y al dióxido de carbono del aire:
- Na3NO4 + H2O + CO2 → NaNO3 + NaOH + NaHCO3
A pesar de su química limitada, el anión ortonitrato es interesante desde un punto de vista estructural debido a su forma tetraédrica regular y a las cortas longitudes de enlace N–O, lo que implica un carácter polar significativo en el enlace.
Compuestos de nitrógeno orgánico
Véase también
- Compuestos de hierro
- Nitrates
- Compuestos de carbono
Referencias
- ^ Fryzuk, M. D. " Johnson, S. A. (2000). "La historia continua de la activación dinitrógeno". Análisis de química de coordinación200–202: 379. doi:10.1016/S0010-8545(00)00264-2.
- ^ Schrock, R. R. (2005). "Catalytic Reduction of Dinitrogen to Amonia at a Single Molybdenum Center". Acc. Chem. Res. 38 (12): 955–62. doi:10.1021/ar0501121. PMC 2551323. PMID 16359167.
- ^ a b c d Greenwood, Norman N.; Earnshaw, Alan (1997). Química de los elementos (2a edición). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ a b c d e Greenwood and Earnshaw, págs. 417 a 20
- ^ Greenwood and Earnshaw, págs. 434 a 38
- ^ Greenwood and Earnshaw, págs. 420 a 26
- ^ a b c d Greenwood and Earnshaw, págs. 426 a 33
- ^ Vieira, R.; C. Pham-Huu; N. Keller; M. J. Ledoux (2002). "New carbon nanofiber/graphite fieltro composite for use as a catalyst support for hydrazine catalytic decomposition". Comunicaciones químicas (9): 954–55. doi:10.1039/b202032g. PMID 12123065.
- ^ a b c d Greenwood and Earnshaw, págs. 438 a 42
- ^ Bowden, F. P. (1958). "Iniciación de Explosión por Neutrons, α-Particles y Productos de Fisión". Actos de la Royal Society of London A. 246 (1245): 216–19. Bibcode:1958RSPSA.246..216B. doi:10.1098/rspa.1958.0123. S2CID 137728239.
- ^ Ford, L. A.; Grundmeier, E. W. (1993). Magia química. Dover. p. 76. ISBN 978-0-486-67628-9.
- ^ Frierson, W. J.; Kronrad, J.; Browne, A. W. (1943). "Chlorine Azide, ClN3. I". Journal of the American Chemical Society. 65 (9): 1696–1698. doi:10.1021/ja01249a012.
- ^ Lyhs, Benjamin; Bläser, Dieter; Wölper, Christoph; Schulz, Stephan; Jansen, Georg (20 de febrero de 2012). "Solid-State Structure of Bromine Azide" (PDF). Angewandte Chemie International Edition. 51 (8): 1970–1974. doi:10.1002/anie.201108092. PMID 22250068. Archivado (PDF) original el 25 de agosto de 2021. Retrieved 25 de agosto 2021.
- ^ Fox, W.B.; MacKenzie, J.S.; Vitek, R. (Febrero de 1970). "La química del óxido de trifluoramina. V. Sintesis de F3 no por fluoración fotoquímica del fluoruro de nitrosilo". Cartas de Química Inorgánica y Nuclear. 6 (2): 177–179. doi:10.1016/0020-1650(70)80336-1.
- ^ a b c d e f Greenwood and Earnshaw, págs. 443 a 58
- ^ Rahm, Martin; Dvinskikh, Sergey V.; Furó, István; Brinck, Tore (23 de diciembre de 2010). "Experimental Detection of Trinitramide, N(NO)2)3". Angewandte Chemie International Edition. 50 (5): 1145–48. doi:10.1002/anie.201007047. PMID 21268214. S2CID 32952729.
- ^ Hou, Y. C.; Janczuk, A.; Wang, P. G. (1999). "Tendencias actuales en el desarrollo de donantes de óxido nítrico". Farmacéutica actual Diseño. 5 (6): 417–41. doi:10.2174/138161280506230110111042. PMID 10390607.
- ^ Talawar, M. B.; et al. (2005). "Establecimiento de Tecnología de Procesos para la Fabricación de Pentóxido de Dintrógeno y su Utilidad para la Síntesis de Explosivo Más Poderoso de Hoy – CL-20". Journal of Hazardous Materials. 124 (1–3): 153–64. doi:10.1016/j.jhazmat.2005.04.021. PMID 1597979786.
- ^ a b c d e f g h i Greenwood and Earnshaw, pp. 459–72
- ^ a b Marzo, Jerry (1985), Química Orgánica Avanzada: Reacciones, Mecanismos y Estructura, 3a edición, Nueva York: Wiley, ISBN 9780471854722, OCLC 642506595
- ^ Rédei, George P (2008). "Kjeldahl Method". Enciclopedia de Genética, Genómica, Proteomica e Informática. p. 1063. doi:10.1007/978-1-4020-6754-9_9066. ISBN 978-1-4020-6753-2.
![{\displaystyle {\ce {NaNO3{}+Na2O->[{\ce {Ag~crucible}}][{\ce {300^{\circ }C~for~7days}}]Na3NO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ec729bc88f520e08fdce8a013dec8ae601d28509)