Complejo adaptador AP2
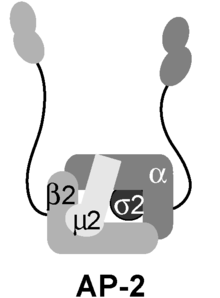
El complejo adaptador AP2 es una proteína multimérica que actúa sobre la membrana celular para internalizar la carga en la endocitosis mediada por clatrina. Es un complejo estable de cuatro adaptinas que dan lugar a una estructura que tiene un dominio central y dos dominios de apéndice unidos al dominio central mediante enlaces polipeptídicos. Estos dominios de apéndice a veces se denominan "orejas". El dominio central se une a la membrana y a la carga destinada a la internalización. Los dominios de apéndice alfa y beta se unen a las proteínas accesorias y a la clatrina. Sus interacciones permiten la regulación temporal y espacial del ensamblaje de vesículas recubiertas de clatrina y su endocitosis.
El complejo AP-2 es un heterotetrámero que consta de dos adaptinas grandes (α y β), una adaptina mediana (μ) y una adaptina pequeña (σ):
- complejo 2
- AP2A1 (unidad alfa 1)
- AP2A2 (unidad alfa 2)
- AP2B1 (unidad beta)
- AP2M1 (unidad de μ)
- AP2S1 (unidad privada)
Estructura
El complejo adaptador AP2 existe en dos conformaciones primarias: la conformación abierta (estado activo) y la conformación cerrada (estado inactivo). En su estado activo, el sitio de unión de la clatrina que se encuentra en la subunidad β y el sitio de unión de la carga que se encuentra en la subunidad μ están expuestos al citosol, lo que permite que se produzcan sus respectivas interacciones. En su estado inactivo, el complejo experimenta un cambio conformacional que hace que ambos sitios queden cubiertos, impidiendo sus funciones primarias. Las cadenas pesadas α y β del complejo constituyen aproximadamente el 60% de la secuencia polipeptídica de AP2 y están estructuradas estrechamente en 14 repeticiones HEAT que forman estructuras α-helicoidales en zigzag que interactúan con las "patas" helicoidales del trímero de clatrina.

Función
AP2 facilita el ensamblaje de las redes de clatrina cuando es necesario que se produzca la endocitosis, al agregarse junto con otros complejos AP2, en su conformación activa. Estos agregados AP2 interactúan con proteínas de clatrina individuales a través de sus sitios β-activos, orientándolas hacia las "jaulas" de clatrina que forman la capa endocítica.
Reglamento
La regulación de la actividad de AP2 se realiza principalmente a través de reordenamientos conformacionales de la estructura en dos conformaciones distintas (y una tercera y una cuarta posibles). La conformación "abierta" es el estado activo del complejo, ya que los "huecos" o sitios de unión activos para las clatrinas y la carga están descubiertos. Por otro lado, la conformación "cerrada" se denota por el cierre o la inaccesibilidad de estos mismos sitios.
Activación
Se ha descubierto que la presencia de clatrinas induce la unión a la carga y, de manera similar, la presencia de carga parece inducir la unión de clatrina. Se cree que esto ocurre por una estabilización secundaria de la estructura compleja, que permitiría la activación parcial, o el acceso, a los respectivos hoyos. El fosfatidilinositol-(4,5)-bisfosfato (PIP2) actúa como una secuencia señal que se une y es reconocida por AP2. PIP2 se puede encontrar dentro de los liposomas que contienen carga, que interactúan con AP2 para luego unirse a la clatrina y ejecutar su función. En la forma cerrada, el sitio de unión de PIP2 está expuesto, lo que permite que se produzca la regulación conformacional. Debido a esto, un cierto orden de ligeros cambios conformacionales provoca la conformación completamente abierta, comenzando con la unión de PIP2, luego la unión de la secuencia de carga y, finalmente, la unión de clatrina. Se cree que una familia de proteínas llamadas muniscinas son los activadores alostéricos primarios del complejo adaptador AP2, debido a su prevalencia en fosas asociadas a AP2 y su inhibición, que resulta en la disminución de la endocitosis mediada por AP2. Además, se ha descubierto que el complejo está regulado y activado por la fosforilación de su subunidad (mu).
Desactivación
La desactivación, o cambio a la conformación "cerrada", aún no está clara. Se cree que las NECAP desempeñan un papel en ella, al unirse a la subunidad α de AP2. No se sabe mucho, pero la conformación abierta de AP2, que está fosforilada, parece ser necesaria para que NECAP1 se una a su núcleo. El proceso de acción aún se desconoce, pero esta interacción provoca la desfosforilación del complejo adaptador AP2, desactivándolo así.
Relevancia médica
Se ha identificado que AP2 participa íntimamente en las vías celulares autofágicas, responsables de la degradación de las proteínas agregadas. De hecho, se ha visto que forma un complejo con el complejo de fosfatidilinositol clatrina en la leucemia linfoide-mieloide (PICALM), que serviría como un grupo receptor importante para la cadena ligera 3 de la proteína 1 asociada a los microtúbulos (LC3). La LC3 tiene un papel importante en algunas vías autofágicas. Debido a esto, existe la sospecha de que la deficiencia o disfunción de AP2 puede ser un precursor del desarrollo de la enfermedad de Alzheimer familiar.
Véase también
- Amphiphysin
- AP180
- Epsin
- Exomer
- Muniscins
Referencias
- ^ Pearse BM, Smith CJ, Owen DJ (abril de 2000). "Clathrin coat construction in endocytosis". Opinión actual en Biología Estructural. 10 (2): 220–228. doi:10.1016/S0959-440X(00)00071-3. PMID 10753805. (suscripción requerida)
- ^ a b c Collins BM, McCoy AJ, Kent HM, Evans PR, Owen DJ (2002-05-17). "Molecular Architecture and Functional Model of the Endocytic AP2 Complex". Celular. 109 (4): 523-535. doi:10.1016/S0092-8674(02)00735-3. PMID 12086608.
- ^ a b Beacham GM, Partlow EA, Lange JJ, Hollopeter G (enero 2018). "NECAPs son reguladores negativos del complejo adaptador de clatrina AP2". eLife. 7: e32242. doi:10.7554/eLife.32242. PMC 5785209. PMID 29345618.
- ^ a b c Kirchhausen T, Owen D, Harrison SC (mayo de 2014). " Estructura molecular, función y dinámica del tráfico de membrana mediada por clathrin". Cold Spring Harbor Perspectives in Biology. 6 (5): a016725. doi:10.1101/cshperspect.a016725. PMC 3996469. PMID 24789820.
- ^ Partlow EA, Baker RW, Beacham GM, Chappie JS, Leschziner AE, Hollopeter G (agosto 2019). "Un mecanismo estructural para la inactivación dependiente de la fosforilación del complejo AP2". eLife. 8: e50003. doi:10.7554/eLife.50003. PMC 6739873. PMID 31464684.
- ^ a b Beacham GM, Partlow EA, Hollopeter G (octubre 2019). "Regulación conformacional de complejos adaptadores AP1 y AP2 clathrin". Tráfico. 20 (10): 741–751. doi:10.1111/tra.12677. PMC 6774827. PMID 31313456.
- ^ Ehrlich M, Boll W, Van Oijen A, Hariharan R, Chandran K, Nibert ML, Kirchhausen T (septiembre de 2004). "Endocitosis por iniciación aleatoria y estabilización de pozos coronados por clathrin". Celular. 118 (5): 591–605. doi:10.1016/j.cell.2004.08.017. PMID 15339664.
- ^ Rapoport I, Miyazaki M, Boll W, Duckworth B, Cantley LC, Shoelson S, Kirchhausen T (mayo de 1997). "Interacciones reguladoras en el reconocimiento de señales de clasificación endocética por complejos AP-2". El Diario EMBO. 16 (9): 2240–2250. doi:10.1093/emboj/16.9.2240. PMC 1169826. PMID 9171339.
- ^ a b Kadlecova Z, Spielman SJ, Loerke D, Mohanakrishnan A, Reed DK, Schmid SL (enero de 2017). "Regulación de la endocitosis mediada por clathrin por activación alosterética jerárquica de AP2". The Journal of Cell Biology. 216 (1): 167–179. doi:10.1083/jcb.201608071. PMC 5223608. PMID 28003333.
- ^ Reider A, Barker SL, Mishra SK, Im YJ, Maldonado-Báez L, Hurley JH, et al. (octubre de 2009). "Syp1 es un adaptador endocético conservado que contiene dominios involucrados en la selección de carga y tubulación de membrana". El Diario EMBO. 28 (20): 3103–3116. doi:10.1038/emboj.2009.248. PMC 2771086. PMID 19713939.
- ^ Henne WM, Boucrot E, Meinecke M, Evergren E, Vallis Y, Mittal R, McMahon HT (junio de 2010). "Las proteínas de FCHo son nucleadores de endocitosis mediada por clathrina". Ciencia. 328 (5983): 1281-1284. doi:10.1126/ciencia.1188462. PMC 2883440. PMID 20448150.
- ^ Cocucci E, Aguet F, Boulant S, Kirchhausen T (agosto 2012). "Los primeros cinco segundos en la vida de un foso claustro". Celular. 150 (3): 495–507. doi:10.1016/j.cell.2012.05.047. PMC 3413093. PMID 22863004.
- ^ Ghosh P, Kornfeld S (marzo de 2003). "AP-1 vinculante para clasificar señales y liberar de las vesículas coronadas por clathrin está regulada por la fosforilación". The Journal of Cell Biology. 160 (5): 699–708. doi:10.1083/jcb.200211080. PMC 2173368. PMID 12604586.
- ^ Ricotta D, Conner SD, Schmid SL, von Figura K, Honing S (marzo de 2002). "Phosphorylation of the AP2 mu subunit by AAK1 media alta afinidad vinculante para las señales de clasificación de proteínas de membrana". The Journal of Cell Biology. 156 (5): 791–795. doi:10.1083/jcb.200111068. PMC 2173304. PMID 11877457.
- ^ a b Tian Y, Chang JC, Fan EY, Flajolet M, Greengard P (octubre de 2013). "Complejo de adaptor AP2/PICALM, a través de la interacción con LC3, apunta el APP-CTF de Alzheimer para la degradación terminal a través de la autofagia". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 110 (42): 17071-17076. doi:10.1073/pnas.1315110. PMC 3801056. PMID 24067654.
- ^ Dhingra A, Alexander D, Reyes-Reveles J, Sharp R, Boesze-Battaglia K (2018). "Microtubule-Asociated Protein 1 Light Chain 3 (LC3) Isoforms in RPE and Retina". Enfermedades degenerativas retinas. Avances en Medicina Experimental y Biología. Vol. 1074. pp. 609–616. doi:10.1007/978-319-75402-4_74. ISBN 978-3-319-75401-7. PMID 29721994.
Enlaces externos
- Modelos y estructuras adaptadores