Cobalto
El cobalto es un elemento químico con el símbolo Co y el número atómico 27. Al igual que el níquel, el cobalto se encuentra en la corteza terrestre solo en forma químicamente combinada, salvo en pequeños depósitos que se encuentran en aleaciones de hierro meteórico natural. El elemento libre, producido por fundición reductora, es un metal gris plateado, duro y lustroso.
Los pigmentos azules a base de cobalto (azul cobalto) se han utilizado desde la antigüedad para joyería y pinturas, y para impartir un tinte azul distintivo al vidrio, pero durante mucho tiempo se pensó que el color se debía al conocido bismuto metálico. Los mineros habían usado durante mucho tiempo el nombre de mineral de kobold (en alemán , mineral de duende) para algunos de los minerales que producen pigmento azul; fueron llamados así porque eran pobres en metales conocidos y emitían vapores venenosos que contenían arsénico cuando se fundían. En 1735, se descubrió que tales minerales eran reducibles a un nuevo metal (el primero descubierto desde la antigüedad), y este finalmente recibió el nombre del kobold.
Hoy en día, algo de cobalto se produce específicamente a partir de una serie de minerales con brillo metálico, como la cobaltita (CoAsS). Sin embargo, el elemento se produce más generalmente como un subproducto de la extracción de cobre y níquel. El cinturón de cobre en la República Democrática del Congo (RDC) y Zambia produce la mayor parte de la producción mundial de cobalto. La producción mundial en 2016 fue de 116 000 toneladas (114 000 toneladas largas; 128 000 toneladas cortas) (según Natural Resources Canada), y solo la RDC representó más del 50%.
El cobalto se utiliza principalmente en baterías de iones de litio y en la fabricación de aleaciones magnéticas, resistentes al desgaste y de alta resistencia. Los compuestos de silicato de cobalto y aluminato de cobalto(II) (CoAl 2 O 4, azul cobalto) dan un distintivo color azul profundo al vidrio, la cerámica, las tintas, las pinturas y los barnices. El cobalto se presenta naturalmente como un solo isótopo estable, el cobalto-59. El cobalto-60 es un radioisótopo comercialmente importante, utilizado como marcador radiactivo y para la producción de rayos gamma de alta energía.
El cobalto es el centro activo de un grupo de coenzimas llamadas cobalaminas. La vitamina B 12, el ejemplo más conocido de este tipo, es una vitamina esencial para todos los animales. El cobalto en forma inorgánica también es un micronutriente para bacterias, algas y hongos.
Características
El cobalto es un metal ferromagnético con una gravedad específica de 8,9. La temperatura de Curie es de 1115 ° C (2039 ° F) y el momento magnético es de 1,6 a 1,7 magnetones de Bohr por átomo. El cobalto tiene una permeabilidad relativa de dos tercios de la del hierro. El cobalto metálico se presenta en dos estructuras cristalográficas: hcp y fcc. La temperatura de transición ideal entre las estructuras hcp y fcc es de 450 °C (842 °F), pero en la práctica la diferencia de energía entre ellas es tan pequeña que es común el intercrecimiento aleatorio de las dos.
El cobalto es un metal débilmente reductor que está protegido de la oxidación por una película de óxido pasivante. Es atacado por halógenos y azufre. El calentamiento en oxígeno produce Co 3 O 4 que pierde oxígeno a 900 °C (1650 °F) para dar el monóxido CoO. El metal reacciona con flúor (F 2) a 520 K para dar CoF 3; con cloro (Cl 2), bromo (Br 2) y yodo (I 2), produciendo haluros binarios equivalentes. No reacciona con hidrógeno gaseoso (H 2) o nitrógeno gaseoso (N 2) incluso cuando se calienta, pero sí reacciona con boro, carbono, fósforo, arsénico y azufre.A temperaturas ordinarias, reacciona lentamente con ácidos minerales y muy lentamente con aire húmedo, pero no seco.
Compuestos
Los estados de oxidación comunes del cobalto incluyen +2 y +3, aunque también se conocen compuestos con estados de oxidación que van de -3 a +5. Un estado de oxidación común para compuestos simples es +2 (cobalto (II)). Estas sales forman el complejo acuoso metálico de color rosa [Co(H2O)6]en agua. La adición de cloruro da el azul intenso [CoCl4]. En una prueba de llama con perlas de bórax, el cobalto muestra un azul profundo tanto en llamas oxidantes como reductoras.
Compuestos de oxígeno y calcógeno
Se conocen varios óxidos de cobalto. El óxido de cobalto verde (II) (CoO) tiene una estructura de sal de roca. Se oxida fácilmente con agua y oxígeno a hidróxido de cobalto(III) marrón (Co(OH) 3). A temperaturas de 600 a 700 °C, el CoO se oxida al óxido de cobalto azul (II, III) (Co 3 O 4), que tiene una estructura de espinela. También se conoce el óxido de cobalto negro (III) (Co 2 O 3). Los óxidos de cobalto son antiferromagnéticos a baja temperatura: CoO (temperatura Néel 291 K) y Co 3 O 4 (temperatura Néel: 40 K), que es análogo a la magnetita (Fe 3 O 4), con una mezcla de oxidación +2 y +3 estados
Los principales calcogenuros de cobalto incluyen los sulfuros de cobalto negro (II), CoS 2, que adopta una estructura similar a la pirita, y el sulfuro de cobalto (III) (Co 2 S 3).
Haluros
Se conocen cuatro dihaluros de cobalto(II): fluoruro de cobalto(II) (CoF 2, rosa), cloruro de cobalto(II) (CoCl 2, azul), bromuro de cobalto(II) (CoBr 2, verde), cobalto(II) yoduro (CoI 2, azul-negro). Estos haluros existen en formas anhidras e hidratadas. Mientras que el dicloruro anhidro es azul, el hidrato es rojo.
El potencial de reducción para la reacción Co+ e → coes +1,92 V, más allá del cloro a cloruro, +1,36 V. En consecuencia, el cloruro de cobalto (III) se reduciría espontáneamente a cloruro de cobalto (II) y cloro. Debido a que el potencial de reducción del flúor a fluoruro es tan alto, +2,87 V, el fluoruro de cobalto (III) es uno de los pocos compuestos de cobalto (III) simples y estables. El fluoruro de cobalto (III), que se utiliza en algunas reacciones de fluoración, reacciona vigorosamente con el agua.
Compuestos de coordinación
Como todos los metales, los compuestos moleculares y los iones poliatómicos del cobalto se clasifican como complejos de coordinación, es decir, moléculas o iones que contienen cobalto unido a uno o más ligandos. Estos pueden ser combinaciones de una variedad potencialmente infinita de moléculas e iones, tales como:
- agua h2O, como en el catión hexaaquocobalt(II) [Co(H2O)6]. Este complejo de color rosa es el catión predominante en el sulfato de cobalto sólido CoSO4· (H2O) x, con x = 6 o 7, así como en soluciones acuosas de los mismos.
- amoníaco NH3, como en cis -diaquotetraamminecobalt(III) [Co(NH3)4(H2O)2], en hexol [Co(Co(NH3)4(HO)2)3], en [Co(NO2)4(NUEVA HAMPSHIRE3)2](el anión de la sal de Erdmann), y en [Co(NH3)5(CO3)].
- carbonato [CO3], como en el triscarbonatocobaltato(III) verde [Co(CO3)3]anión.
- nitrito [NO2]como en [Co(NO2)4(NUEVA HAMPSHIRE3)2].
- hidróxido [HO], como en hexol.
- cloruro [Cl], como en tetracloridocobaltato (II) CoCl4].
- bicarbonato [HCO3], como en [Co(CO3)2(HCO3)(H2O)].
- oxalato [C2O4], como en trisoxalatocobaltato (III) [Co (C2O4)3].
Estos grupos unidos afectan la estabilidad de los estados de oxidación de los átomos de cobalto, según principios generales de electronegatividad y de dureza-blandura. Por ejemplo, los complejos de Co tienden a tener ligandos amínicos. Debido a que el fósforo es más suave que el nitrógeno, los ligandos de fosfina tienden a presentar el Co y el Co más suaves, por ejemplo, el cloruro de tris (trifenilfosfina) cobalto (I) (P (C6H5)3)3CoCl). El óxido y el fluoruro más electronegativos (y más duros) pueden estabilizar el Co y los derivados del Co, por ejemplo, hexafluorocobaltato(IV) de cesio (Cs 2 CoF 6) y percobaltato de potasio (K 3 CoO 4).
Alfred Werner, un pionero ganador del premio Nobel en química de coordinación, trabajó con compuestos de fórmula empírica [Co(NH3)6]. Uno de los isómeros determinados fue el cloruro de cobalto(III) hexamina. Este complejo de coordinación, un complejo tipo Werner típico, consiste en un átomo de cobalto central coordinado por seis ligandos ortogonales de amina y tres contraaniones de cloruro. El uso de ligandos de etilendiamina quelantes en lugar de amoníaco da tris (etilendiamina) cobalto (III) ([Co (en)3]), que fue uno de los primeros complejos de coordinación en resolverse en isómeros ópticos. El complejo existe en las formas para diestros y zurdos de una "hélice de tres palas". Este complejo fue aislado por primera vez por Werner como cristales en forma de aguja de oro amarillo.
Compuestos organometálicos
El cobaltoceno es un análogo estructural del ferroceno, con cobalto en lugar de hierro. El cobaltoceno es mucho más sensible a la oxidación que el ferroceno. El carbonilo de cobalto (Co 2 (CO) 8) es un catalizador en las reacciones de carbonilación e hidrosililación. La vitamina B 12 (ver más abajo) es un compuesto organometálico que se encuentra en la naturaleza y es la única vitamina que contiene un átomo de metal. Un ejemplo de un complejo de alquilcobalto en el poco común estado de oxidación +4 del cobalto es el complejo homoléptico tetrakis (1-norbornil) cobalto (IV) [de] (Co (1-norb) 4), un complejo de metal de transición-alquilo que destaca por su resistencia a la eliminación de β-hidrógeno,de acuerdo con la regla de Bredt. Los complejos de cobalto(III) y cobalto(V) [Li(THF)4][Co(1-norb)4]y [Co(1-norb)4][BF4]también son conocidos.
Isótopos
Co es el único isótopo de cobalto estable y el único isótopo que existe naturalmente en la Tierra. Se han caracterizado veintidós radioisótopos: el más estable, Co, tiene una vida media de 5,2714 años; Co tiene una vida media de 271,8 días; Co tiene una vida media de 77,27 días; and Co tiene una vida media de 70,86 días. Todos los demás isótopos radiactivos de cobalto tienen vidas medias inferiores a 18 horas y, en la mayoría de los casos, inferiores a 1 segundo. Este elemento también tiene 4 metaestados, todos los cuales tienen vidas medias inferiores a 15 minutos.
Los isótopos de cobalto varían en peso atómico de 50 u (Co) a 73 u (Co). El principal modo de decaimiento de los isótopos con valores unitarios de masa atómica menores que los del único isótopo estable, Co, es la captura de electrones y el principal modo de decaimiento de los isótopos con masa atómica superior a 59 unidades de masa atómica es el decaimiento beta. Los principales productos de desintegración por debajo del Co son los isótopos del elemento 26 (hierro); por encima de eso, los productos de desintegración son isótopos del elemento 28 (níquel).
Historia
Los compuestos de cobalto se han utilizado durante siglos para impartir un rico color azul al vidrio, los esmaltes y la cerámica. Se ha detectado cobalto en esculturas egipcias, joyas persas del tercer milenio a. C., en las ruinas de Pompeya, destruidas en el 79 d. C., y en China, que datan de la dinastía Tang (618-907 d. C.) y la dinastía Ming (1368-1644). ANUNCIO).
El cobalto se ha utilizado para colorear el vidrio desde la Edad del Bronce. La excavación del naufragio de Uluburun arrojó un lingote de vidrio azul, fundido durante el siglo XIV a. El vidrio azul de Egipto estaba coloreado con cobre, hierro o cobalto. El vidrio de color cobalto más antiguo es de la dinastía XVIII de Egipto (1550-1292 a. C.). Se desconoce la fuente del cobalto que usaron los egipcios.
La palabra cobalto se deriva del alemán kobalt, de kobold que significa "duende", un término supersticioso usado por los mineros para el mineral de cobalto. Los primeros intentos de fundir esos minerales en busca de cobre o plata fracasaron y, en su lugar, produjeron simplemente polvo (óxido de cobalto (II)). Debido a que los minerales primarios de cobalto siempre contienen arsénico, la fundición del mineral oxida el arsénico en el óxido de arsénico altamente tóxico y volátil, lo que aumenta la notoriedad del mineral.
Al químico sueco Georg Brandt (1694-1768) se le atribuye el descubrimiento del cobalto alrededor de 1735, lo que demuestra que es un elemento previamente desconocido, distinto del bismuto y otros metales tradicionales. Brandt lo llamó un nuevo "semi-metal". Mostró que los compuestos de metal cobalto eran la fuente del color azul en el vidrio, que anteriormente se había atribuido al bismuto que se encuentra con el cobalto. El cobalto se convirtió en el primer metal descubierto desde el período prehistórico. Todos los demás metales conocidos (hierro, cobre, plata, oro, zinc, mercurio, estaño, plomo y bismuto) no tuvieron descubridores registrados.
Durante el siglo XIX, una parte significativa de la producción mundial de azul cobalto (un pigmento hecho con compuestos de cobalto y alúmina) y esmalta (vidrio de cobalto en polvo para uso como pigmento en cerámica y pintura) se llevó a cabo en el Blaafarveværket noruego. Las primeras minas para la producción de esmalto en el siglo XVI se ubicaron en Noruega, Suecia, Sajonia y Hungría. Con el descubrimiento de mineral de cobalto en Nueva Caledonia en 1864, la extracción de cobalto en Europa disminuyó. Con el descubrimiento de depósitos de mineral en Ontario, Canadá en 1904 y el descubrimiento de depósitos aún más grandes en la provincia de Katanga en el Congo en 1914, las operaciones mineras cambiaron nuevamente. Cuando comenzó el conflicto de Shaba en 1978, las minas de cobre de la provincia de Katanga casi detuvieron la producción.El impacto de este conflicto en la economía mundial del cobalto fue menor de lo esperado: el cobalto es un metal raro, el pigmento es altamente tóxico y la industria ya había establecido formas efectivas para reciclar materiales de cobalto. En algunos casos, la industria pudo cambiar a alternativas sin cobalto.
En 1938, John Livingood y Glenn T. Seaborg descubrieron el radioisótopo cobalto-60. Este isótopo fue utilizado en la Universidad de Columbia en la década de 1950 para establecer la violación de la paridad en la desintegración beta radiactiva.
Después de la Segunda Guerra Mundial, EE. UU. quería garantizar el suministro de mineral de cobalto para usos militares (como lo habían estado haciendo los alemanes) y buscó cobalto dentro de la frontera de EE. UU. Se encontró un suministro adecuado del mineral en Idaho cerca del cañón Blackbird en la ladera de una montaña. La empresa Calera Mining Company inició la producción en el sitio.
Se ha argumentado que el cobalto será uno de los principales objetos de la competencia geopolítica en un mundo que funciona con energía renovable y depende de las baterías, pero esta perspectiva también ha sido criticada por subestimar el poder de los incentivos económicos para expandir la producción.
Ocurrencia
La forma estable de cobalto se produce en supernovas a través del proceso r. Comprende el 0,0029% de la corteza terrestre. El cobalto libre (el metal nativo) no se encuentra en la Tierra debido al oxígeno en la atmósfera y al cloro en el océano. Ambos son lo suficientemente abundantes en las capas superiores de la corteza terrestre como para evitar que se forme el cobalto de metal nativo. Excepto como se entregó recientemente en hierro meteórico, el cobalto puro en forma de metal nativo es desconocido en la Tierra. El elemento tiene una abundancia media, pero los compuestos naturales de cobalto son numerosos y se encuentran pequeñas cantidades de compuestos de cobalto en la mayoría de las rocas, suelos, plantas y animales.
En la naturaleza, el cobalto se asocia frecuentemente con el níquel. Ambos son componentes característicos del hierro meteórico, aunque el cobalto es mucho menos abundante en los meteoritos de hierro que el níquel. Al igual que con el níquel, el cobalto en las aleaciones de hierro meteórico puede haber estado lo suficientemente bien protegido del oxígeno y la humedad para permanecer como el metal libre (pero aleado), aunque ninguno de los elementos se ve en esa forma en la antigua corteza terrestre.
El cobalto en forma compuesta se encuentra en minerales de cobre y níquel. Es el principal componente metálico que se combina con azufre y arsénico en los minerales de cobaltita sulfídica (CoAsS), safflorita (CoAs 2), glaucodot ((Co,Fe)AsS) y skutterudita (CoAs 3). El mineral cattierita es similar a la pirita y se encuentra junto con la vaesita en los depósitos de cobre de la provincia de Katanga. Cuando llega a la atmósfera, se produce la meteorización; los minerales sulfurados se oxidan y forman eritrita rosa ("vista de cobalto": Co 3 (AsO 4) 2 ·8H 2 O) y esferocobaltita (CoCO 3).
El cobalto también es un componente del humo del tabaco. La planta del tabaco absorbe fácilmente y acumula en sus hojas metales pesados como el cobalto del suelo circundante. Estos son posteriormente inhalados durante el consumo de tabaco.
En el océano
El cobalto es un metal traza involucrado en la fotosíntesis y la fijación de nitrógeno detectado en la mayoría de las cuencas oceánicas y es un micronutriente limitante para el fitoplancton y las cianobacterias. La cobalamina compleja que contiene Co solo es sintetizada por cianobacterias y algunas arqueas, por lo que las concentraciones de cobalto disuelto son bajas en la parte superior del océano. Al igual que el Mn y el Fe, el Co tiene un perfil híbrido de absorción biológica por parte del fitoplancton a través de la fotosíntesis en la parte superior del océano y la recolección en las profundidades del océano, aunque la mayor parte de la recolección está limitada por ligandos orgánicos complejos. El co se recicla en el océano mediante la materia orgánica en descomposición que se hunde debajo de la capa superior del océano, aunque la mayor parte es eliminada por bacterias oxidantes.
Las fuentes de cobalto para muchos cuerpos oceánicos incluyen ríos y escorrentía terrestre con alguna entrada de fuentes hidrotermales. En las profundidades del océano, las fuentes de cobalto se encuentran en la parte superior de los montes submarinos (que pueden ser grandes o pequeños) donde las corrientes oceánicas barren el fondo del océano para limpiar los sedimentos a lo largo de millones de años, lo que les permite formar costras de ferromanganeso. Aunque se ha realizado un mapeo limitado del fondo marino, la investigación preliminar indica que hay una gran cantidad de estas costras ricas en cobalto ubicadas en la Zona Clarion Clipperton.un área que genera un interés creciente para las empresas mineras en aguas profundas debido al entorno rico en minerales dentro de su dominio. El aporte antropogénico contribuye como una fuente no natural pero en cantidades muy bajas. Las concentraciones de cobalto disuelto (dCo) en los océanos están controladas principalmente por depósitos donde las concentraciones de oxígeno disuelto son bajas. El ciclo bioquímico complejo del cobalto en el océano aún no se comprende por completo, pero se han encontrado patrones de concentraciones más altas en áreas de bajo oxígeno, como la Zona Mínima de Oxígeno (OMZ) en el Océano Atlántico Sur.
El cobalto se considera tóxico para los ambientes marinos en altas concentraciones. Las concentraciones seguras caen alrededor de 18 μg/L en aguas marinas para el plancton como las diatomeas. La mayoría de los niveles de toxicidad costera están influenciados por aportes antropogénicos como la escorrentía de aguas residuales y la quema de combustibles fósiles. Se han registrado altos niveles de Co y Se en pescados y mariscos provenientes de áreas costeras con niveles más altos de metales traza. Aunque los científicos son conscientes de la toxicidad amenazante, se ha prestado menos atención en comparación con otros metales traza como el mercurio y el plomo en los sistemas de agua contaminada.
Producción
| País | Producción | Reservas |
|---|---|---|
| 64.000 | 3,500,000 | |
| 5,600 | 250.000 | |
| 5,000 | 1,200,000 | |
| 4,300 | 250.000 | |
| 4200 | 500,000 | |
| 4,000 | 280.000 | |
| 3.800 | 150.000 | |
| 3,200 | 51,000 | |
| 2,900 | 270.000 | |
| 2,800 | - | |
| 2,500 | 29,000 | |
| 1,500 | ||
| 650 | 23,000 | |
| Otros países | 5,900 | 560.000 |
| total mundial | 110,000 | 7,100,000 |
Los principales minerales de cobalto son la cobaltita, la eritrita, el glaucodot y la skutterudita (ver arriba), pero la mayor parte del cobalto se obtiene reduciendo los subproductos de cobalto de la minería y fundición de níquel y cobre.
Dado que el cobalto generalmente se produce como subproducto, el suministro de cobalto depende en gran medida de la viabilidad económica de la extracción de cobre y níquel en un mercado determinado. Se proyectó que la demanda de cobalto crecería un 6 % en 2017.
Los depósitos primarios de cobalto son raros, como los que se encuentran en depósitos hidrotermales, asociados con rocas ultramáficas, tipificadas por el distrito de Bou-Azzer en Marruecos. En dichos lugares, los minerales de cobalto se extraen exclusivamente, aunque en una concentración más baja, y por lo tanto requieren más procesamiento posterior para la extracción de cobalto.
Existen varios métodos para separar el cobalto del cobre y el níquel, según la concentración de cobalto y la composición exacta del mineral usado. Un método es la flotación por espuma, en la que los tensioactivos se unen a los componentes del mineral, lo que lleva a un enriquecimiento de los minerales de cobalto. El tostado posterior convierte los minerales en sulfato de cobalto, y el cobre y el hierro se oxidan al óxido. La lixiviación con agua extrae el sulfato junto con los arsenatos. Los residuos se lixivian más con ácido sulfúrico, dando una solución de sulfato de cobre. El cobalto también se puede lixiviar de la escoria de la fundición de cobre.
Los productos de los procesos antes mencionados se transforman en el óxido de cobalto (Co 3 O 4). Este óxido se reduce a metal por reacción aluminotérmica o reducción con carbón en un alto horno.
Extracción
El Servicio Geológico de los Estados Unidos estima las reservas mundiales de cobalto en 7.100.000 toneladas métricas. La República Democrática del Congo (RDC) produce actualmente el 63% del cobalto del mundo. Esta participación de mercado puede alcanzar el 73% para 2025 si las expansiones planificadas por productores mineros como Glencore Plc se llevan a cabo como se espera. Pero para 2030, la demanda global podría ser 47 veces mayor que en 2017, estimó Bloomberg New Energy Finance.
Los cambios que Congo hizo a las leyes mineras en 2002 atrajeron nuevas inversiones en proyectos congoleños de cobre y cobalto. La mina Mutanda de Glencore envió 24 500 toneladas de cobalto en 2016, el 40 % de la producción de la República Democrática del Congo y casi una cuarta parte de la producción mundial. Después del exceso de oferta, Glencore cerró Mutanda durante dos años a fines de 2019. El proyecto de minería Katanga de Glencore también se reanudará y debería producir 300 000 toneladas de cobre y 20 000 toneladas de cobalto para 2019, según Glencore.
Después de alcanzar máximos de casi una década a principios de 2018 por encima de los 100 000 USD por tonelada, los precios del cobalto utilizado en la cadena de suministro mundial de baterías eléctricas cayeron un 45 % en los dos años siguientes. Con el aumento de la demanda de vehículos eléctricos (EV) durante 2020 y hasta 2021, los precios del cobalto aumentaron en enero de 2021. El índice de precios del cobalto de marzo de 2021 muestra que los precios aumentaron mes a mes a US $ 54,000 por tonelada el 19 de marzo de 2021, lo que representa un aumento del 35 %. más de 2 meses.
El cobalto está clasificado como un mineral crítico por los Estados Unidos, Japón, la República de Corea, el Reino Unido y la Unión Europea.
República Democrática del Congo
En 2005, el principal productor de cobalto fueron los depósitos de cobre en la provincia de Katanga en la República Democrática del Congo. Anteriormente, la provincia de Shaba, el área tenía casi el 40% de las reservas mundiales, informó el Servicio Geológico Británico en 2009. En 2015, la República Democrática del Congo (RDC) suministró el 60% de la producción mundial de cobalto, 32 000 toneladas a $ 20,000 a $ 26,000 por tonelada. El crecimiento reciente de la producción podría deberse, al menos en parte, a cómo cayó la producción minera durante las violentas guerras civiles de la República Democrática del Congo a principios de la década de 2000, o a los cambios que el país hizo en su Código de Minería en 2002 para alentar la inversión extranjera y multinacional y que no atraer a varios inversores, incluido Glencore.
La minería artesanal suministró del 17% al 40% de la producción de la RDC. Unos 100.000 mineros de cobalto en la RDC del Congo usan herramientas manuales para excavar cientos de pies, con poca planificación y menos medidas de seguridad, dicen trabajadores y funcionarios gubernamentales y de ONG, así como las observaciones de los reporteros de The Washington Post sobre las visitas a minas aisladas. La falta de precauciones de seguridad frecuentemente causa lesiones o la muerte. La minería contamina los alrededores y expone a la vida silvestre local y a las comunidades indígenas a metales tóxicos que se cree que causan defectos de nacimiento y dificultades respiratorias, según funcionarios de salud.
Los activistas de derechos humanos han alegado, y el periodismo de investigación ha confirmado, que se utiliza mano de obra infantil en la extracción de cobalto de las minas artesanales africanas. Esta revelación llevó al fabricante de teléfonos móviles Apple Inc., el 3 de marzo de 2017, a dejar de comprar mineral de proveedores como Zhejiang Huayou Cobalt, que se abastece de minas artesanales en la República Democrática del Congo, y comenzar a usar solo proveedores que cumplen con los estándares de su lugar de trabajo.
La UE y los principales fabricantes de automóviles (OEM) están presionando a nivel mundial para que la producción mundial de cobalto se obtenga y produzca de manera sostenible, responsable y con trazabilidad de la cadena de suministro. Las empresas mineras están adoptando y practicando iniciativas ESG en línea con la Guía de la OCDE y poniendo en práctica actividades de huella de carbono cero o baja en la producción de la cadena de suministro de baterías de iones de litio. Estas iniciativas ya se están llevando a cabo con las principales empresas mineras, empresas de Minería Artesanal y de Pequeña Escala (MAPE). Los fabricantes de automóviles y las cadenas de suministro de fabricantes de baterías Tesla, VW, BMW, BASF y Glencore están participando en varias iniciativas, como la Iniciativa de cobalto responsable y el estudio Cobalto para el desarrollo. En 2018, BMW Group, en asociación con BASF,
La dinámica política y étnica de la región ha provocado en el pasado brotes de violencia y años de conflicto armado y desplazamiento de población. Esta inestabilidad afectó el precio del cobalto y también creó incentivos perversos para que los combatientes de la Primera y Segunda Guerra del Congo prolongaran la lucha, ya que el acceso a las minas de diamantes y otros recursos valiosos ayudó a financiar sus objetivos militares, que con frecuencia equivalían al genocidio, y también enriqueció a los propios luchadores. Si bien la República Democrática del Congo no ha sido invadida recientemente por las fuerzas militares vecinas en la década de 2010, algunos de los depósitos minerales más ricos se encuentran junto a áreas donde los tutsis y los hutus todavía chocan con frecuencia, los disturbios continúan aunque en menor escala y los refugiados aún huyen de los brotes de violencia.
El cobalto extraído de pequeños emprendimientos mineros artesanales congoleños en 2007 suministró a una sola empresa china, Congo DongFang International Mining. Una subsidiaria de Zhejiang Huayou Cobalt, uno de los productores de cobalto más grandes del mundo, Congo DongFang suministró cobalto a algunos de los fabricantes de baterías más grandes del mundo, que produjeron baterías para productos omnipresentes como los iPhone de Apple. Debido a las violaciones laborales acusadas y las preocupaciones ambientales, LG Chem posteriormente auditó a Congo DongFang de acuerdo con las pautas de la OCDE. LG Chem, que también produce materiales para baterías para empresas automotrices, impuso un código de conducta a todos los proveedores que inspecciona.
El proyecto Mukondo Mountain, operado por Central African Mining and Exploration Company (CAMEC) en la provincia de Katanga, puede ser la reserva de cobalto más rica del mundo. Produjo aproximadamente un tercio de la producción mundial total de cobalto en 2008. En julio de 2009, CAMEC anunció un acuerdo a largo plazo para entregar toda su producción anual de concentrado de cobalto desde Mukondo Mountain a Zhejiang Galico Cobalt & Nickel Materials of China.
En febrero de 2018, la firma global de gestión de activos AllianceBernstein definió a la República Democrática del Congo como económicamente "la Arabia Saudita de la era de los vehículos eléctricos", debido a sus recursos de cobalto, como esencial para las baterías de iones de litio que impulsan los vehículos eléctricos.
El 9 de marzo de 2018, el presidente Joseph Kabila actualizó el código de minería de 2002, aumentó los cargos por regalías y declaró al cobalto y al coltán "metales estratégicos".
El código de minería de 2002 se actualizó efectivamente el 4 de diciembre de 2018.
En diciembre de 2019, International Rights Advocates, una ONG de derechos humanos, presentó una demanda histórica contra Apple, Tesla, Dell, Microsoft y la empresa Google Alphabet por "beneficiarse a sabiendas y ayudar e incitar al uso cruel y brutal de niños pequeños" en la extracción de cobalto.. Las empresas en cuestión negaron su participación en el trabajo infantil.
Canadá
En 2017, algunas compañías de exploración planeaban inspeccionar antiguas minas de plata y cobalto en el área de Cobalt, Ontario, donde se cree que se encuentran depósitos importantes.
Sherritt International de Canadá procesa minerales de cobalto en depósitos de níquel de las minas de Moa en Cuba, y la isla tiene varias otras minas en Mayarí, Camagüey y Pinar del Río. Las inversiones continuas de Sherritt International en la producción cubana de níquel y cobalto mientras adquiría derechos mineros durante 17 a 20 años hicieron que el país comunista fuera el tercero en reservas de cobalto en 2019, antes que el propio Canadá.
Aplicaciones
En 2016 se utilizaron 116.000 toneladas (128.000 toneladas cortas) de cobalto. El cobalto se ha utilizado en la producción de aleaciones de alto rendimiento. También se puede utilizar para fabricar baterías recargables, y la llegada de los vehículos eléctricos y su éxito entre los consumidores probablemente tenga mucho que ver con la creciente producción de la RDC. Otros factores importantes fueron el Código de Minería de 2002, que fomentó la inversión de empresas extranjeras y transnacionales como Glencore, y el fin de la Primera y Segunda Guerra del Congo.
Aleaciones
Históricamente, las superaleaciones a base de cobalto han consumido la mayor parte del cobalto producido. La estabilidad térmica de estas aleaciones las hace adecuadas para palas de turbinas de gas y motores a reacción de aviones, aunque las aleaciones monocristalinas a base de níquel las superan en rendimiento. Las aleaciones a base de cobalto también son resistentes a la corrosión y al desgaste, lo que las hace, como el titanio, útiles para fabricar implantes ortopédicos que no se desgastan con el tiempo. El desarrollo de aleaciones de cobalto resistentes al desgaste comenzó en la primera década del siglo XX con las aleaciones de estelita, que contenían cromo con cantidades variables de tungsteno y carbono. Las aleaciones con carburos de cromo y tungsteno son muy duras y resistentes al desgaste.Las aleaciones especiales de cobalto-cromo-molibdeno como Vitallium se utilizan para piezas protésicas (reemplazos de cadera y rodilla). Las aleaciones de cobalto también se utilizan para prótesis dentales como un sustituto útil del níquel, que puede ser alergénico. Algunos aceros de alta velocidad también contienen cobalto para aumentar la resistencia al calor y al desgaste. Las aleaciones especiales de aluminio, níquel, cobalto y hierro, conocidas como Alnico, y de samario y cobalto (samario-cobalto imán) se utilizan en imanes permanentes. También está aleado con un 95 % de platino para joyería, lo que produce una aleación adecuada para la fundición fina, que también es ligeramente magnética.
Baterías
El óxido de cobalto de litio (LiCoO 2) se usa ampliamente en los cátodos de las baterías de iones de litio. El material está compuesto por capas de óxido de cobalto con el litio intercalado. Durante la descarga (es decir, cuando no se está cargando activamente), el litio se libera en forma de iones de litio. Las baterías de níquel-cadmio (NiCd) y de hidruro metálico de níquel (NiMH) también incluyen cobalto para mejorar la oxidación del níquel en la batería. Transparency Market Research estimó el mercado mundial de baterías de iones de litio en $30 mil millones en 2015 y predijo un aumento a más de $75 mil millones para 2024.
Aunque en 2018 la mayor parte del cobalto de las baterías se utilizó en un dispositivo móvil, una aplicación más reciente del cobalto son las baterías recargables para automóviles eléctricos. Esta industria ha quintuplicado su demanda de cobalto, lo que hace urgente encontrar nuevas materias primas en zonas más estables del mundo. Se espera que la demanda continúe o aumente a medida que aumente la prevalencia de los vehículos eléctricos. La exploración en 2016–2017 incluyó el área alrededor de Cobalt, Ontario, un área donde muchas minas de plata dejaron de operar hace décadas. El cobalto para vehículos eléctricos aumentó un 81 % desde el primer semestre de 2018 hasta las 7.200 toneladas en el primer semestre de 2019, para una capacidad de batería de 46,3 GWh. El futuro de los coches eléctricos puede depender de la minería en aguas profundas, ya que el cobalto abunda en las rocas del lecho marino.
Dado que el trabajo infantil y esclavo ha sido reportado repetidamente en la minería de cobalto, principalmente en las minas artesanales de la República Democrática del Congo, las empresas de tecnología que buscan una cadena de suministro ética se han enfrentado a la escasez de esta materia prima y el precio del metal cobalto alcanzó un máximo de nueve años en octubre. 2017, más de US$30 la libra, frente a US$10 a finales de 2015. Después de un exceso de oferta, el precio bajó a un precio más normal de $15 en 2019. Como reacción a los problemas con la minería artesanal de cobalto en la República Democrática del Congo, varios proveedores de cobalto y sus Los clientes han formado la Fair Cobalt Alliance (FCA), cuyo objetivo es acabar con el uso de mano de obra infantil y mejorar las condiciones laborales de la extracción y el procesamiento de cobalto en la República Democrática del Congo. Los miembros de FCA incluyen Zhejiang Huayou Cobalt, Sono Motors, theIniciativa Cobalto Responsable, Fairphone, Glencore y Tesla, Inc.
La Unión Europea está investigando la posibilidad de eliminar los requisitos de cobalto en la producción de baterías de iones de litio. A partir de agosto de 2020, los fabricantes de baterías han reducido gradualmente el contenido de cobalto del cátodo de 1/3 (NMC 111) a 2/10 (NMC 442) al actual 1/10 (NMC 811) y también han introducido el cátodo LFP sin cobalto en la batería. paquetes de autos eléctricos como el Tesla Model 3. En septiembre de 2020, Tesla describió sus planes para fabricar sus propias celdas de batería sin cobalto.
Catalizadores
Varios compuestos de cobalto son catalizadores de oxidación. El acetato de cobalto se utiliza para convertir el xileno en ácido tereftálico, el precursor del tereftalato de polietileno polimérico a granel. Los catalizadores típicos son los carboxilatos de cobalto (conocidos como jabones de cobalto). También se utilizan en pinturas, barnices y tintas como "agentes secantes" mediante la oxidación de aceites secantes. Los mismos carboxilatos se utilizan para mejorar la adherencia entre el acero y el caucho en los neumáticos radiales con cinturón de acero. Además, se utilizan como aceleradores en sistemas de resina de poliéster.
Los catalizadores a base de cobalto se utilizan en reacciones que involucran monóxido de carbono. El cobalto también es un catalizador en el proceso Fischer-Tropsch para la hidrogenación de monóxido de carbono en combustibles líquidos. La hidroformilación de alquenos a menudo utiliza octacarbonilo de cobalto como catalizador, aunque a menudo se reemplaza por catalizadores más eficientes a base de iridio y rodio, por ejemplo, el proceso Cativa.
La hidrodesulfuración del petróleo utiliza un catalizador derivado del cobalto y el molibdeno. Este proceso ayuda a limpiar el petróleo de impurezas de azufre que interfieren con la refinación de combustibles líquidos.
Pigmentos y colorantes
Antes del siglo XIX, el cobalto se usaba predominantemente como pigmento. Se ha utilizado desde la Edad Media para hacer smalt, un vidrio de color azul. Smalt se produce fundiendo una mezcla de mineral tostado esmaltita, cuarzo y carbonato de potasio, que produce un vidrio de silicato azul oscuro, que se muele finamente después de la producción. Smalt fue ampliamente utilizado para colorear vidrio y como pigmento para pinturas. En 1780, Sven Rinman descubrió el verde cobalto y en 1802 Louis Jacques Thénard descubrió el azul cobalto. Los pigmentos de cobalto como el azul cobalto (aluminato de cobalto), el azul cerúleo (estannato de cobalto(II)), varios tonos de verde cobalto (una mezcla de óxido de cobalto(II) y óxido de zinc) y el violeta de cobalto (fosfato de cobalto) se utilizan como pigmentos de artista debido a su estabilidad cromática superior.La aureolina (amarillo cobalto) ahora se reemplaza en gran medida por pigmentos amarillos más resistentes a la luz.
Radioisótopos
El cobalto-60 (Co-60 o Co) es útil como fuente de rayos gamma porque se puede producir en cantidades predecibles con alta actividad al bombardear el cobalto con neutrones. Produce rayos gamma con energías de 1,17 y 1,33 MeV.
El cobalto se utiliza en radioterapia de haz externo, esterilización de suministros médicos y desechos médicos, tratamiento de radiación de alimentos para esterilización (pasteurización en frío), radiografía industrial (p. ej., radiografías de integridad de soldadura), mediciones de densidad (p. ej., mediciones de densidad de concreto) e interruptores de altura de llenado de tanques.. El metal tiene la desafortunada propiedad de producir un polvo fino, lo que causa problemas con la protección contra la radiación. El cobalto de las máquinas de radioterapia ha sido un peligro grave cuando no se desecha correctamente, y uno de los peores accidentes de contaminación por radiación en América del Norte ocurrió en 1984, cuando una unidad de radioterapia desechada que contenía cobalto-60 se desmontó por error en un depósito de chatarra en Juárez, México.
El cobalto-60 tiene una vida media radiactiva de 5,27 años. La pérdida de potencia requiere el reemplazo periódico de la fuente en radioterapia y es una de las razones por las que las máquinas de cobalto han sido reemplazadas en gran medida por aceleradores lineales en la radioterapia moderna. El cobalto-57 (Co-57 o Co) es un radioisótopo de cobalto que se usa con mayor frecuencia en pruebas médicas, como radiomarcador para la absorción de vitamina B 12 y para la prueba de Schilling. El cobalto-57 se utiliza como fuente en la espectroscopia Mössbauer y es una de varias fuentes posibles en los dispositivos de fluorescencia de rayos X.
Los diseños de armas nucleares podrían incorporar intencionalmente Co, parte del cual se activaría en una explosión nuclear para producir Co. El Co, disperso como precipitación nuclear, a veces se denomina bomba de cobalto.
Otros usos
- El cobalto se utiliza en la galvanoplastia por su atractivo aspecto, dureza y resistencia a la oxidación.
- También se utiliza como capa base de imprimación para esmaltes porcelánicos.
Rol biológico
El cobalto es esencial para el metabolismo de todos los animales. Es un componente clave de la cobalamina, también conocida como vitamina B 12, el principal reservorio biológico de cobalto como elemento ultratraza. Las bacterias en los estómagos de los animales rumiantes convierten las sales de cobalto en vitamina B 12, un compuesto que solo pueden producir bacterias o arqueas. Por tanto, una presencia mínima de cobalto en los suelos mejora notablemente la salud de los animales de pastoreo, y se recomienda una ingesta de 0,20 mg/kg al día porque no tienen otra fuente de vitamina B 12.
Las proteínas basadas en cobalamina usan corrin para retener el cobalto. La coenzima B 12 presenta un enlace C-Co reactivo que participa en las reacciones. En humanos, B 12 tiene dos tipos de ligandos de alquilo: metilo y adenosilo. MeB 12 promueve las transferencias de grupos metilo (-CH 3). La versión adenosilo de B 12 cataliza reordenamientos en los que un átomo de hidrógeno se transfiere directamente entre dos átomos adyacentes con intercambio concomitante del segundo sustituyente, X, que puede ser un átomo de carbono con sustituyentes, un átomo de oxígeno de un alcohol o una amina. La metilmalonil coenzima A mutasa (MUT) convierte la MMl-CoA en Su-CoA, un paso importante en la extracción de energía de proteínas y grasas.
Aunque mucho menos comunes que otras metaloproteínas (p. ej., las de zinc y hierro), se conocen otras cobaltoproteínas además de B12. Estas proteínas incluyen la metionina aminopeptidasa 2, una enzima que se produce en los seres humanos y otros mamíferos que no utiliza el anillo de corrina de B 12, sino que se une directamente al cobalto. Otra enzima de cobalto que no es corrina es la nitrilo hidratasa, una enzima de las bacterias que metaboliza los nitrilos.
Deficiencia de cobalto
En humanos, el consumo de vitamina B 12 que contiene cobalto satisface todas las necesidades de cobalto. Para el ganado vacuno y ovino, que satisfacen las necesidades de vitamina B 12 mediante la síntesis de bacterias residentes en el rumen, existe una función para el cobalto inorgánico. A principios del siglo XX, durante el desarrollo de la agricultura en la meseta volcánica de la Isla Norte de Nueva Zelanda, el ganado sufría lo que se denominó "enfermedad de los arbustos". Se descubrió que los suelos volcánicos carecían de las sales de cobalto esenciales para la cadena alimentaria del ganado.Se descubrió que la "enfermedad de la costa" de las ovejas en el Desierto de las Noventa Millas del Sudeste de Australia Meridional en la década de 1930 se originaba en deficiencias nutricionales de los oligoelementos cobalto y cobre. La deficiencia de cobalto se superó con el desarrollo de "balas de cobalto", gránulos densos de óxido de cobalto mezclados con arcilla administrados por vía oral para alojarse en el rumen del animal.
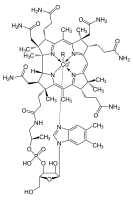 Cobalamina
Cobalamina Ovejas con deficiencia de cobalto
Ovejas con deficiencia de cobalto
Problemas de salud
Se ha estimado que el valor LD 50 para las sales de cobalto solubles está entre 150 y 500 mg/kg. En los EE. UU., la Administración de Salud y Seguridad Ocupacional (OSHA) ha designado un límite de exposición permisible (PEL) en el lugar de trabajo como un promedio ponderado en el tiempo (TWA) de 0,1 mg/m. El Instituto Nacional para la Seguridad y Salud Ocupacional (NIOSH) ha establecido un límite de exposición recomendado (REL) de 0,05 mg/m3, promedio ponderado en el tiempo. El valor IDLH (inmediatamente peligroso para la vida y la salud) es de 20 mg/m.
Sin embargo, la ingestión crónica de cobalto ha causado serios problemas de salud en dosis mucho menores que la dosis letal. En 1966, la adición de compuestos de cobalto para estabilizar la espuma de cerveza en Canadá condujo a una forma peculiar de miocardiopatía inducida por toxinas, que llegó a conocerse como miocardiopatía del bebedor de cerveza.
Además, se sospecha que el cobalto metálico causa cáncer (es decir, posiblemente cancerígeno, IARC Grupo 2B) según las monografías de la Agencia Internacional para la Investigación del Cáncer (IARC).
Causa problemas respiratorios cuando se inhala. También causa problemas en la piel cuando se toca; después del níquel y el cromo, el cobalto es una de las principales causas de dermatitis de contacto.
Contenido relacionado
Levadura en polvo
Alfred Nobel
Metales pesados