Cloruro de platino (IV)
El cloruro de platino (IV) es un compuesto inorgánico de platino y cloro con la fórmula empírica PtCl4. Este sólido marrón contiene platino en el estado de oxidación 4+.
Estructura
Típico del Pt(IV), los centros metálicos adoptan una geometría de coordinación octaédrica, {PtCl6}. Esta geometría se logra formando un polímero en el que la mitad de los ligandos de cloruro forman puentes entre los centros de platino. Debido a su estructura polimérica, el PtCl4 se disuelve solo al romper los ligandos de cloruro que forman puentes. Por lo tanto, la adición de HCl da H2PtCl6. Se conocen aductos de base de Lewis de Pt(IV) del tipo cis-PtCl4L2, pero la mayoría se preparan por oxidación de los derivados de Pt(II).
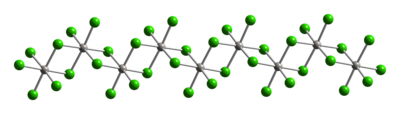 |
| Parte de un (PtCl)4)JUEGO cadena de la estructura cristalina del cloruro platino(IV) |
Formación y reacciones
- H2PtCl6 → PtCl4 + 2 HCl
Se puede obtener un producto más puro calentándolo con gas cloro a 250 °C.
Si se elimina el exceso de ácidos, el PtCl4 cristaliza a partir de soluciones acuosas en grandes cristales rojos de PtCl4·5(H2O) pentahidratado, que se puede deshidratar calentándolo a unos 300 °C en una corriente de cloro seco. El pentahidratado es estable y se utiliza como forma comercial del PtCl4.
El tratamiento de PtCl4 con una base acuosa produce el ion [Pt(OH)6]2−. Con reactivos de Grignard de metilo seguidos de hidrólisis parcial, el PtCl4 se convierte en el grupo cúbico [Pt(CH3)3(OH)]4. Al calentarlo, el PtCl4 desprende cloro para producir PtCl2:
- PtCl4 → PtCl2 + Cl2
También se conocen los haluros más pesados, PtBr4 y PtI4.
Referencias
- Cotton, S.A. Química de metales preciosos, Chapman y Hall (Londres): 1997. ISBN 0-7514-0413-6.
- ^ "Platinum tetrachloride". pubchem.ncbi.nlm.nih.gov. Retrieved 27 de diciembre 2021.
- ^ M. F. Pilbrow (1972). "Crystal structure of platinum tetrachloride". Journal of the Chemical Society, Chemical Communications (5): 270–271. doi:10.1039/C39720000270.
- ^ A. E. Schweizer; G. T. Kerr (1978). "Descomposición térmica del ácido hexacloroplatino". Química Inorgánica. 17 (8): 2326–2327. doi:10.1021/ic50186a067.
- ^ Handbuch der präparativen anorganischen Chemie. 1 (3., umgearb. Aufl ed.). Stuttgart: Enke. 1975. p. 1709. ISBN 978-3-432-02328-1.
- ^ George Samuel Newth (1920). Un libro de texto de química inorgánica. Longmans, Green y co. p. 694.
- ^ Greenwood, N. N.; " Earnshaw, A. (1997). Química de los elementos (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.