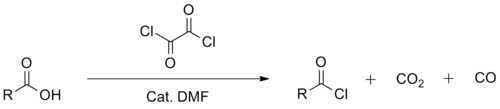Cloruro de oxalilo
cloruro de oxalilo es un compuesto químico orgánico con la fórmula Cl−C(=O)−C(=O)−Cl. Este líquido incoloro y de olor fuerte, el cloruro de diacilo del ácido oxálico, es un reactivo útil en la síntesis orgánica.
Preparación
El cloruro de oxalilo fue preparado por primera vez en 1892 por el químico francés Adrien Fauconnier, quien hizo reaccionar oxalato de dietilo con pentacloruro de fósforo. También se puede preparar tratando ácido oxálico con pentacloruro de fósforo.
El cloruro de oxalilo se produce comercialmente a partir de carbonato de etileno. La fotocloración da el carbonato de percloroetileno C2Cl4 O2CO y cloruro de hidrógeno HCl, que posteriormente se degrada a cloruro de oxalilo y fosgeno COCl2:
- C2H4O2CO + 4 Cl2 → C2Cl4O2CO + 4 HCl
- C2Cl4O2CO → C2O2Cl2 + COCl2
Reacciones
El cloruro de oxalilo reacciona con el agua produciendo únicamente productos gaseosos: cloruro de hidrógeno (HCl), dióxido de carbono (CO2 ) y monóxido de carbono (CO).
- (COCl)2 + H2O → 2 HCl + CO2 + CO
En esto, es bastante diferente de otros cloruros de acilo que se hidrolizan con formación de cloruro de hidrógeno y el ácido carboxílico original.
Aplicaciones en síntesis orgánica
Oxidación de alcoholes
La solución que comprende DMSO y cloruro de oxalilo, seguida de enfriamiento con trietilamina, convierte los alcoholes en los correspondientes aldehídos y cetonas mediante el proceso conocido como oxidación de Swern.
Síntesis de cloruros de acilo
El cloruro de oxalilo se utiliza principalmente junto con un catalizador de N,N-dimetilformamida en síntesis orgánica para la preparación de cloruros de acilo a partir de los ácidos carboxílicos correspondientes. Al igual que el cloruro de tionilo, el reactivo se degrada en productos secundarios volátiles en esta aplicación, lo que simplifica el tratamiento. Uno de los subproductos menores de la reacción catalizada por N,N-dimetilformamida, el cloruro de dimetilcarbamoilo, es un potente carcinógeno, derivado del N,N-dimetilformamida. En comparación con el cloruro de tionilo, el cloruro de oxalilo tiende a ser un reactivo más suave y selectivo. También es más caro que el cloruro de tionilo, por lo que tiende a utilizarse en menor escala.
Esta reacción implica la conversión de N,N-dimetilformamida en el derivado de cloruro de imidoilo (ion clorometileno(dimetil)amonio (CH 3)2N+=CHCl), similar a la primera etapa de la reacción de Vilsmeier-Haack. El cloruro de imidoilo es el agente clorante activo.
Formilación de arenos
El cloruro de oxalilo reacciona con compuestos aromáticos en presencia de cloruro de aluminio para dar el correspondiente cloruro de acilo en un proceso conocido como acilación de Friedel-Crafts. El cloruro de acilo resultante se puede hidrolizar para formar el ácido carboxílico correspondiente.
Preparación de diésteres de oxalato
Al igual que otros cloruros de acilo, el cloruro de oxalilo reacciona con alcoholes para dar ésteres:
- 2 R−CH2−OH + C—C(=O)−C(=O)Cl → R−CH2−O−C(=O)−C(=O)−O−CH2−R - + 2 HCl
Por lo general, estas reacciones se llevan a cabo en presencia de una base como la piridina. El diéster derivado del fenol, éster de oxalato de fenilo, es Cyalume, el ingrediente activo de las barras luminosas.
Otro
Se informó que el cloruro de oxalilo se utilizó en la primera síntesis de dioxano tetracetona (C4O6), un óxido de carbono.
Precauciones
En marzo de 2000, un Airbus A330-300 de Malaysia Airlines sufrió daños irreparables después de que un cargamento de cloruro de oxalilo prohibido (falsamente declarado como hidroxiquinolina) se filtrara en el compartimento de carga. Es tóxico por inhalación, aunque es en un orden de magnitud menos tóxico que el compuesto relacionado fosgeno.