Citocromo
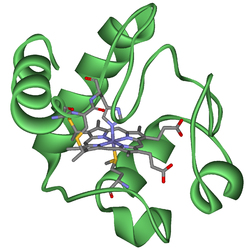
Los citocromos son proteínas con actividad redox que contienen un hemo, con un átomo central de Fe en su núcleo, como cofactor. Están involucrados en la cadena de transporte de electrones y la catálisis redox. Se clasifican según el tipo de hemo y su modo de unión. Cuatro variedades son reconocidas por la Unión Internacional de Bioquímica y Biología Molecular (IUBMB), citocromos a, citocromos b, citocromos c y citocromos d.
La función del citocromo está relacionada con el cambio redox reversible del estado de oxidación ferroso (Fe(II)) al férrico (Fe(III)) del hierro que se encuentra en el núcleo hemo. Además de la clasificación de la IUBMB en cuatro clases de citocromos, en la literatura bioquímica se pueden encontrar varias clasificaciones adicionales, como el citocromo o y el citocromo P450.
Historia
Los citocromos fueron inicialmente descritos en 1884 por Charles Alexander MacMunn como pigmentos respiratorios (miohematina o histohematina). En la década de 1920, Keilin redescubrió estos pigmentos respiratorios y los denominó citocromos o “pigmentos celulares”. Clasificó estas hemoproteínas sobre la base de la posición de su banda de absorción de energía más baja en su estado reducido, como citocromos a (605 nm), b (≈565 nm) y c (550 nm). Las firmas espectroscópicas de ultravioleta (UV) a visible de los hemo todavía se utilizan para identificar el tipo de hemo del estado reducido ligado con bispiridina, es decir, el método del hemocromo de piridina. Dentro de cada clase, citocromo a, b o c, los primeros citocromos se numeran consecutivamente, p. cyt c, cyt c1 y cyt c2, con las más recientes ejemplos designados por su máximo de banda R de estado reducido, p. cita c559.
Estructura y función
El grupo hemo es un sistema de anillos altamente conjugados (lo que permite que sus electrones sean muy móviles) que rodea un ion de hierro. El hierro en los citocromos generalmente existe en un estado ferroso (Fe2+) y férrico (Fe3+) con un ferroxo (Fe4+) estado que se encuentra en los intermedios catalíticos. Los citocromos son, por lo tanto, capaces de realizar reacciones de transferencia de electrones y catálisis por reducción u oxidación de su hierro hemo. La ubicación celular de los citocromos depende de su función. Se pueden encontrar como proteínas globulares y proteínas de membrana.
En el proceso de fosforilación oxidativa, una proteína cc de citocromo globular participa en la transferencia de electrones del complejo III unido a la membrana al complejo IV. El complejo III en sí está compuesto por varias subunidades, una de las cuales es un citocromo de tipo b, mientras que otra es un citocromo de tipo c. Ambos dominios están involucrados en la transferencia de electrones dentro del complejo. El complejo IV contiene un dominio de citocromo a/a3 que transfiere electrones y cataliza la reacción de oxígeno a agua. El fotosistema II, el primer complejo proteico en las reacciones dependientes de la luz de la fotosíntesis oxigénica, contiene una subunidad de citocromo b. La ciclooxigenasa 2, una enzima implicada en la inflamación, es una proteína del citocromo b.
A principios de la década de 1960, Emanuel Margoliash sugirió una evolución lineal de los citocromos que condujo a la hipótesis del reloj molecular. La tasa de evolución aparentemente constante de los citocromos puede ser una herramienta útil para tratar de determinar cuándo varios organismos pueden haberse separado de un ancestro común.
Tipos
Existen varios tipos de citocromos y se pueden distinguir por espectroscopia, estructura exacta del grupo hemo, sensibilidad al inhibidor y potencial de reducción.
Se distinguen cuatro tipos de citocromos por sus grupos prostéticos:
| Tipo | Grupo de prótesis |
|---|---|
| Cytochrome a | heme A |
| Cytochrome b | heme B |
| Cytochrome c | heme C (covalently bound heme b) |
| Cytochrome d | heme D (Heme B with γ-spirolactone) |
No hay "citocromo e," pero el citocromo f, que se encuentra en el complejo citocromo b6f de las plantas, es un citocromo tipo c.
En las mitocondrias y los cloroplastos, estos citocromos a menudo se combinan en el transporte de electrones y las vías metabólicas relacionadas:
| Citocromos | Combinación |
|---|---|
| a y a3 | Cytochrome c oxidase ("Complex IV") con electrones entregados al complejo por soluble citocromo c (de ahí el nombre) |
| b y c1 | Coenzima Q - citocromo c reductasa ("Complex III") |
| b6 y f | Plastoquinol—plastocyanin reductase |
Una familia distinta de citocromos es la familia del citocromo P450, llamada así por el pico característico de Soret formado por la absorbancia de la luz en longitudes de onda cercanas a 450 nm cuando el hierro hemo se reduce (con ditionito de sodio) y forma complejos con monóxido de carbono. Estas enzimas están involucradas principalmente en la esteroidogénesis y la desintoxicación.
Contenido relacionado
Portadores de vida
Eritromicina
Cladística