Cinetoplasto

Un cinetoplasto es una red de ADN circular (denominada kADN) dentro de una mitocondria que contiene muchas copias del genoma mitocondrial. La estructura más común de los cinetoplastos es un disco, pero se han observado en otras configuraciones. Los cinetoplastos solo se encuentran en Excavata de la clase Kinetoplastida. La variación en las estructuras de los cinetoplastos puede reflejar relaciones filogenéticas entre los cinetoplastos. Un cinetoplasto suele estar adyacente al cuerpo basal flagelar del organismo, lo que sugiere que está unido a algunos componentes del citoesqueleto. En Trypanosoma brucei, esta conexión del citoesqueleto se denomina complejo de unión tripartito e incluye la proteína p166.
Trypanosoma
En los tripanosomas, un grupo de protozoos flagelados, el cinetoplasto existe como un gránulo denso de ADN dentro de la mitocondria. Trypanosoma brucei, el parásito que causa la tripanosomiasis africana (enfermedad del sueño africana), es un ejemplo de un tripanosoma con un cinetoplasto. Su cinetoplasto es fácilmente visible en muestras teñidas con DAPI, un tinte fluorescente para ADN, o mediante el uso de hibridación in situ fluorescente (FISH) con BrdU, un análogo de la timidina.
Estructura
El cinetoplasto contiene ADN circular en dos formas: maxicírculos y minicírculos. Los maxicírculos tienen un tamaño de entre 20 y 40 kb y hay unas pocas docenas por cinetoplasto. Hay varios miles de minicírculos por cinetoplasto y tienen un tamaño de entre 0,5 y 1 kb. Los maxicírculos codifican los productos proteicos típicos necesarios para la mitocondria, que está encriptada. Aquí reside la única función conocida de los minicírculos: producir ARN guía (ARNg) para decodificar esta información encriptada de los maxicírculos, normalmente mediante la inserción o eliminación de residuos de uridina. La red de maxicírculos y minicírculos se conecta en cadena para formar una red plana que se asemeja a una cota de malla. La reproducción de esta red requiere que estos anillos se desconecten del cinetoplasto parental y se vuelvan a conectar posteriormente en el cinetoplasto hijo. Este modo único de replicación del ADN puede inspirar posibles dianas farmacológicas.
La estructura del kADN mejor estudiada es la de Crithidia fasciculata, un disco encadenado de maxicírculos y minicírculos de kADN circulares, la mayoría de los cuales no están superenrollados. Fuera del disco de kADN, pero directamente adyacentes, hay dos complejos de proteínas situados a 180° entre sí y que participan en la replicación de los minicírculos.
Variaciones
También se han observado variaciones en las redes de cinetoplastos, que se describen según la disposición y la ubicación de su kADN.
- A pro-kDNA kinetoplast es una estructura similar al paquete que se encuentra en la matriz mitocondrial proximal al cuerpo basal del flagelo. En contraste con la red convencional kDNA, un kinetoplast pro-kDNA contiene muy poca catenación y sus maxicircles y minicircles se relajan en lugar de supercoiled. Pro-kDNA se ha observado en Bodo salados, Bodo designis, Procryptobia sorokini Sí. Bodo sorokini, Rhynchomonas nasuta, y Cephalothamnium cyclopi.
- A poli-kDNA kinetoplast es similar en la estructura kDNA a un kinetoplast pro-kDNA. Contiene poca catenación y ningún supercoiling. La característica distintiva del poli-kDNA es que en lugar de estar compuesto de un solo paquete globular como en pro-kDNA, el poli-kDNA se distribuye entre varios foci discreto a lo largo del lumen mitocondrial. Poly-kDNA has been observed in Dimastigella trypaniformis (comunal en el intestino de una termita), Dismastigella mimosa (un kinetoplastide libre) y Cruzella marina (un parásito del intestino de un chorro de mar).
- A pan-kDNA kinetoplast, como poli-kDNA y pro-kDNA, contiene un menor grado de catenación pero contiene minicircles que son supercoilados. Los kinetoplastos Pan-kDNA llenan la mayor parte de la matriz mitocondrial y no se limitan a foci discreta como poli-kDNA. Pan-kDNA se ha observado en Cryptobia helicis (un parásito del receptaculum seminis of snails), Bodo caudatus, y Cryptobia branchialis (un parásito de peces).
- A mega-kDNA kinetoplast se distribuye uniformemente a lo largo de la matriz mitocondrial, pero no contiene minicircles. En cambio, secuencias de kDNA similares en secuencia a otros minicircles de kinetoplast se conectan en tándem en moléculas más grandes aproximadamente 200kb de longitud. Mega-kDNA (o estructuras similares a mega-kDNA) se han observado en Trypanoplasme borreli (un parásito de pescado) y Jarrellia sp. (un parásito de ballena).
La presencia de esta variedad de estructuras de kADN refuerza la relación evolutiva entre las especies de cinetoplastos. Como el pan-kADN es el que más se parece a un plásmido de ADN, puede ser la forma ancestral del kADN.
Replicación

La replicación del cinetoplasto ocurre simultáneamente a la duplicación del flagelo adyacente y justo antes de la replicación del ADN nuclear. En una red tradicional de kADN de Crithidia fasciculata, el inicio de la replicación es promovido por la desvinculación de los minicírculos de kADN a través de la topoisomerasa II. Los minicírculos libres son liberados en una región entre el cinetoplasto y la membrana mitocondrial llamada zona cinetoflagelar (KFZ). Después de la replicación, los minicírculos migran por mecanismos desconocidos a los complejos proteicos antípodas que contienen varias proteínas de replicación, incluyendo una endonucleasa, helicasa, ADN polimerasa, ADN primasa y ADN ligasa, que inician la reparación de las discontinuidades restantes en los minicírculos recién replicados.
Este proceso ocurre en un minicírculo a la vez, y solo una pequeña cantidad de minicírculos se desvinculan en un momento dado. Para llevar un registro de qué minicírculos se han replicado, al volver a unirse a la red de kADN queda un pequeño espacio en los minicírculos nacientes, que los identifica como ya replicados. Los minicírculos que aún no se han replicado siguen cerrados covalentemente. Inmediatamente después de la replicación, cada progenie se une a la red de kADN proximal a los complejos proteicos antípodas y los espacios se reparan parcialmente.
A medida que avanza la replicación de los minicírculos, para evitar la formación de nuevos minicírculos, toda la red de kADN rotará alrededor del eje central del disco. Se cree que la rotación está directamente relacionada con la replicación del flagelo adyacente, ya que el cuerpo basal hijo también rotará alrededor del cuerpo basal madre en un tiempo y de una manera similar a la rotación del cinetoplasto. Al rotar, los minicírculos del cinetoplasto hijo se ensamblan en forma de espiral y comienzan a moverse hacia el centro del disco a medida que los nuevos minicírculos se desvinculan y se mueven hacia el KFZ para la replicación.
Aunque los mecanismos exactos del kADN maxicircle aún no se han determinado con el mismo detalle que el del kADN minicircle, se observa una estructura llamada nabelschnur (que en alemán significa "cordón umbilical") que une las redes de kADN hijas pero que finalmente se rompe durante la separación. Mediante el uso de sondas FISH para apuntar al nabelschnur, se ha descubierto que contiene kADN maxicircle.
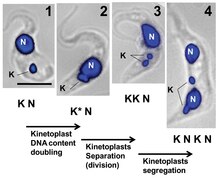
Se describe que la replicación del cinetoplasto ocurre en cinco etapas, cada una en relación con la replicación del flagelo adyacente.
- Etapa I: El kinetoplast todavía no ha iniciado la replicación, no contiene complejos de proteína antipodal, y se coloca en relación con un solo cuerpo basal flagelador.
- Etapa II: El kinetoplast comienza a mostrar complejos de proteína antipodal. El cuerpo basal flagelo comienza la replicación, al igual que el kinetoplast. La asociación del kinetoplast replicante a los dos cuerpos basales hace que desarrolle una apariencia domada.
- Etapa III: El nuevo flagellum comienza a separarse y el kinetoplast toma una forma bilomada.
- Etapa IV: Los kinetoplasts aparecen como discos separados pero permanecen conectados por el nabelschnur.
- Etapa V: Los kinetoplasts hija están completamente separados ya que el nabelschnur está roto. Su estructura es idéntica a la vista en la Etapa I.
Reparación de ADN
Trypanosoma cruzi es capaz de reparar nucleótidos en su ADN genómico o kinetoplasto que han sido dañados por especies reactivas de oxígeno producidas por el huésped del parásito durante la infección. La ADN polimerasa beta expresada en T. cruzi se emplea en la eliminación de daños oxidativos en el ADN mediante el proceso de reparación por escisión de bases. Parece que la ADN polimerasa beta actúa durante la replicación del ADN kinetoplasto para reparar los daños oxidativos en el ADN inducidos por estrés genotóxico en este orgánulo.
Referencias
- ^ a b c Shapiro TA; Englund PT (1995). "La estructura y replicación del ADN de la kinetoplast". Annu. Rev. Microbiol. 49: 117–43. doi:10.1146/annurev.mi.49.100195.001001. PMID 8561456.
- ^ a b c d Shlomai J (2004). "La estructura y replicación del ADN de la kinetoplast". Curr. Mol. Med. 4 (6): 623–47. doi:10.2174/1566524043360096. PMID 15357213.
- ^ a b c d e f g h Lukes J, et al. (2002). "Kinetoplast DNA Network: Evolution of an Improbable Structure". Eukaryotic Celular. 1 (4): 495–502. doi:10.1128/ec.1.4.495-502.2002. PMC 117999. PMID 12455998.
- ^ Zhao, Z; Lindsay, M. E.; Roy Chowdhury, A; Robinson, D. R.; Englund, P. T. (2008). "P166, un enlace entre el ADN mitocondrial trippanosome y el flagellum, media la segregación genoma". El Diario EMBO. 27 (1): 143–54. doi:10.1038/sj.emboj.7601956. PMC 2206137. PMID 18059470.
- ^ a b c d e f g Gluenz E, et al. (marzo de 2011). "El ciclo de replicación de kinetoplast en Trypanosoma brucei es orquestado por morfogenesis celular mediada por citoesqueleto". Biología celular molecular. 31 (5): 1012-1021. doi:10.1128/MCB.01176-10. PMC 3067821. PMID 21173163.
- ^ a b c d e Torri, A. et al. Replicación de ADN en células Eukaróticas. Cold Spring Harbor Laboratory Press. 1996. pages=1029–42. ISBN 0-87969-459-9
- ^ a b Schamber-Reis BL, Nardelli S, Régis-Silva CG, Campos PC, Cerqueira PG, Lima SA, Franco GR, Macedo AM, Pena SD, Cazaux C, Hoffmann JS, Motta MC, Schenkman S, Teixeira SM, Machado CR (2012). "DNA polimerasa beta de Trypanosoma cruzi está involucrado en la replicación de ADN de kinetoplast y reparación de lesiones oxidativas". Mol. Biochem. Parasitol. 183 (2): 122–31. doi:10.1016/j.molbiopara.2012.02.007. PMID 22369885.