Ciclohexenona
Contenido keyboard_arrow_down
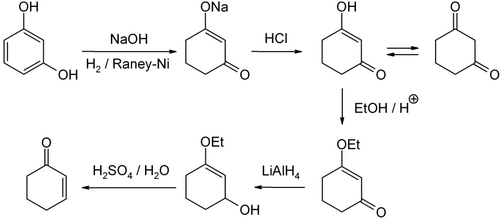
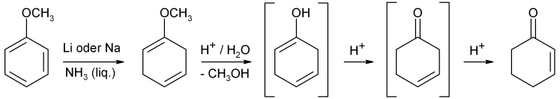
La ciclohexenona es un compuesto orgánico que constituye un intermedio versátil utilizado en la síntesis de diversos productos químicos, como fármacos y fragancias. Es un líquido incoloro, pero las muestras comerciales suelen ser amarillas.Industrialmente, la ciclohexenona se prepara a partir del fenol mediante la reducción de Birch.La ciclohexenona es una cetona, o más precisamente, una enona. Entre las reacciones comunes se incluyen la adición nucleofílica conjugada con reactivos de organocobre, las reacciones de Michael y las anulaciones de Robinson.
Síntesis
Reacciones
Compuestos relacionados
- ciclopropenone
- ciclobutenone
- cyclopentenone
- cicloheptenone
Referencias
- ^ a b c Cyclohexenone en Sigma-Aldrich
- ^ Podraze, K.F. Procedido. Int., 1991, 23, pág. 217.
- ^ Bloques de construcción orgánicos de la industria química, Harry H. Szmant, ISBN 978-0-471-85545-3
- ^ Michael G. Organ y Paul Anderson (1996). "Carbonyl and Conjugate Additions to Cyclohexenone: Experiments Illustrating Reagent Selectivity". Journal of Chemical Education. 73 (12): 1193. Código:1996JChEd..73.1193O. doi:10.1021/ed073p1193.
- ^ Tetraedro Lett. 34, 3881, (1993)
- ^ R. B. Thompson (1947). "Dihidroresorcinol". Sintetías orgánicas. 27: 21. doi:10.15227/orgsyn.027.0021.
- ^ Los investigadores en Japón intentaban utilizar el peróxido de butilo como catalizador para la decarboxilación utilizando una opción solvente de ciclohexanol. Curiosamente encontraron que cuando utilizaron la pureza inferior (por ejemplo, grado técnico, 98%) ciclohexanol, la reacción procedió hasta 4 veces más rápido en comparación con cuando utilizaron ciclohexanol relativamente puro (con99,3%). Encontraron que el ciclohexanol contenía ciclohexenona como una impureza natural, que era tres veces más abundante en el grado técnico ciclohexenone en comparación con el ciclohexanol más purificado (~0.3% versus ~0.1%). Otras investigaciones mostraron que el 1% de ciclohexenona en ciclohexanol decarboxilará la mayoría de los alfa-aminoácidos, incluyendo los no estándar, con un rendimiento del 80-95% en cuestión de varias horas. Las excepciones son ciertos aminoácidos como la histidina, que se informó que tardan más de 26 horas, y los poli-aminoácidos, que no desencarboxila con 2-ciclohexenona y otra ruta debe encontrarse en su lugar.Hashimoto, M; Eda, Y; Yasutomo, O; Toshiaki, I; Aoki, S (1986). "Una nueva decarboxilación de. ALPHA.-aminoácidos. Un método facile de decarboxilación por el uso de 2-ciclohexen-1-uno como catalizador". Cartas de química. 15 (6): 893 –896. doi:10.1246/cl.1986.893. Retrieved 4 de enero 2016.
- ^ Laval, G; Golding, B (2003). "Secuencia única para la Decarboxilación de α-Aminoácidos". Synlett 4): 542 –546. doi:10.1055/s-2003-37512. Retrieved 4 de enero 2016.
- ^ A. G. Ross, X. Li, S. J. Danishefsky (2012). "Preparación de Cyclobutenone". Sintetías orgánicas. 89: 491. doi:10.15227/orgsyn.089.0491.
{{cite journal}}: CS1 maint: múltiples nombres: lista de autores (link) - ^ Y. Ito, S. Fujii, M. Nakatuska, F. Kawamoto, T. Saegusa (1979). "Exansión de anillo de un carbono de Cycloalkanones a Cicloalkenones Conjugados: 2-Cyclohepten-1-One". Sintetías orgánicas. 59: 113. doi:10.15227/orgsyn.059.0113.
{{cite journal}}: CS1 maint: múltiples nombres: lista de autores (link)
Más resultados...