Ciclo ozono-oxígeno
El ciclo ozono-oxígeno es el proceso mediante el cual el ozono se regenera continuamente en la estratosfera de la Tierra, convirtiendo la radiación ultravioleta (UV) en calor. En 1930, Sydney Chapman resolvió la química involucrada. Los científicos atmosféricos llaman comúnmente a este proceso ciclo de Chapman.
La mayor parte de la producción de ozono se produce en la estratosfera superior y la mesosfera tropicales. La masa total de ozono producida por día en el mundo es de unos 400 millones de toneladas métricas. La masa global de ozono es relativamente constante en aproximadamente 3 mil millones de toneladas métricas, lo que significa que el Sol produce aproximadamente el 12% de la capa de ozono cada día.
Fotoquímica
El ciclo de Chapman describe las principales reacciones que determinan naturalmente, en primera aproximación, la concentración de ozono en la estratosfera. Incluye cuatro procesos, y un quinto, menos importante, todos ellos relacionados con átomos y moléculas de oxígeno y radiación ultravioleta:
Creación
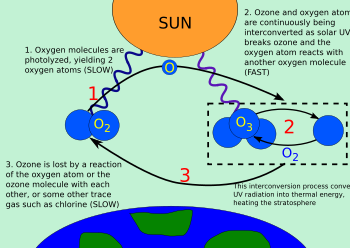
Una molécula de oxígeno se divide (fotoliza) mediante luz UV de mayor frecuencia (extremo superior de UV-B, UV-C y superiores) en dos átomos de oxígeno (ver figura):
- 1. fotodisociación de oxígenoO2 + hν(Se realizaron 242 nm) → 2 O
Cada átomo de oxígeno puede combinarse con una molécula de oxígeno para formar una molécula de ozono:
- 2. Creación de ozono: O + O2 + A → O3 + A
- donde A denota una molécula o átomo adicional, como N2 o O2, requerido para mantener la conservación de la energía y el impulso en la reacción. Cualquier exceso de energía se produce como energía cinética.
El ciclo del ozono-oxigeno
Las moléculas de ozono formadas por la reacción (arriba) absorben radiación con una longitud de onda apropiada entre UV-C y UV-B. La molécula de ozono triatómica se convierte en oxígeno molecular diatómico, más un átomo de oxígeno libre (ver figura):
- 3. fotodisociación del ozonoO3 + hν(240–310 nm) → O2 + O
El oxígeno atómico producido puede reaccionar con otra molécula de oxígeno para reformar el ozono mediante la reacción a la creación de ozono (reacción 2 supra).
Estas dos reacciones forman así el ciclo del ozono-oxigeno, en el que la energía química liberada por la creación del ozono se convierte en energía kinética molecular. El resultado neto del ciclo es la conversión de la luz UV-B penetrante en calor, sin ninguna pérdida neta de ozono. Mientras mantiene la capa de ozono en equilibrio estable, y protegiendo la atmósfera inferior de la radiación UV nociva, el ciclo también proporciona una de las dos principales fuentes de calor en la estratosfera (la otra es energía cinética, liberada cuando O2 es fotolizado en los átomos O individuales).
Eliminación
Si un átomo de oxígeno y una molécula de ozono se encuentran, se recombinan para formar dos moléculas de oxígeno:
- 4. Conversión de ozonoO3 + O → 2 O2
Dos átomos de oxígeno pueden reaccionar para formar una molécula de oxígeno:
- 5. recombinación de oxígeno: 2O + A → O2 + A
- como en la reacción 2 (arriba), A denota otra molécula o átomo, como N2 o O2 necesaria para la conservación de la energía y el impulso.
Tenga en cuenta que la reacción 5 es de menor importancia en la estratosfera, ya que, en condiciones normales, la concentración de átomos de oxígeno es mucho menor que la de las moléculas de oxígeno diatómico. Por tanto, esta reacción es menos común que la creación de ozono (reacción 2).
La cantidad total de ozono en la estratosfera está determinada por el equilibrio entre la producción a partir de la radiación solar y su eliminación. La velocidad de eliminación es lenta, ya que la concentración de átomos de O libres es muy baja.
Reacciones adicionales
Además de estas cinco reacciones, ciertos radicales libres, siendo los más importantes el hidroxilo (OH), el óxido nítrico (NO) y el cloro (Cl) y el bromo (Br) atómicos, catalizan la reacción de recombinación, dando lugar a una formación de ozono. capa más delgada de lo que sería si los catalizadores no estuvieran presentes.
La mayoría de los OH y NO están presentes de forma natural en la estratosfera, pero la actividad humana, especialmente las emisiones de clorofluorocarbonos (CFC) y halones, ha aumentado considerablemente la concentración de Cl y Br, lo que ha provocado el agotamiento de la capa de ozono. Cada átomo de Cl o Br puede catalizar decenas de miles de reacciones de descomposición antes de ser eliminado de la estratosfera.
Principales reacciones en diferentes capas atmosféricas
Thermosphere
Para concentraciones relativas de reactivos dadas, las tasas de creación de ozono y recombinación de oxígeno (reacciones 2 y 5) son proporcionales a la densidad del aire al cubo, mientras que la tasa de conversión de ozono (reacción 4) es proporcional a la densidad del aire al cuadrado, y las reacciones de fotodisociación (reacciones 1 y 3) dependen linealmente de la densidad del aire. Así, en la termosfera superior, donde la densidad del aire es muy baja y el flujo de fotones es alto, la fotodisociación del oxígeno es rápida mientras que la creación de ozono es baja, por lo que su concentración es baja. Por tanto, las reacciones más importantes son la fotodisociación y la recombinación del oxígeno, donde la mayoría de las moléculas de oxígeno se disocian en átomos de oxígeno.
A medida que vamos a la termosfera inferior (por ejemplo, 100 km de altura y abajo), el flujo de fotones en las longitudes de onda de 070 nm cae marcadamente debido a la absorción por oxígeno en la reacción de la fotodisociación de oxígeno (reacción 1). Este régimen de longitud de onda tiene la sección transversal más alta para esta reacción (10)-17 cm2 por molécula de oxígeno), y por lo tanto la tasa de disociación de fotos de oxígeno por molécula de oxígeno disminuye significativamente a estas alturas, desde más de 10-7 por segundo (alrededor de una vez al mes) a 100 km a 10-8 por segundo (alrededor de una vez cada pocos años) a 80 km. Como resultado, la concentración atómica de oxígeno (tanto relativa como absoluta) disminuye considerablemente, y la creación de ozono (reacción 2) está en curso, lo que conduce a una presencia pequeña pero no insignificante del ozono.
Tenga en cuenta que las temperaturas también disminuyen a medida que las tasas de disociación de fotones inferiores significan una menor producción de calor por molécula de aire.
Bajo la termosfera: Tasas de reacción en estado estable
Las especies extrañas de oxígeno (oxígeno atómico y ozono) tienen una tasa de creación neta solo por disociación de oxígeno (reacción 1) y destrucción neta por conversión de ozono o recombinación de oxígeno (reacciones 4 y 5). En estado estacionario estos procesos están equilibrados, por lo que las velocidades de estas reacciones obedecen a:
- (valor de reacción 1) = (valor de reacción 4) + (valor de reacción 5).
En estado estacionario, la creación de ozono también se equilibra con su eliminación. entonces:
- (valor de reacción 2) = (valor de reacción 3) + (valor de reacción 4).
De ello se deduce que:
- (rate de reacción 2) + (valor de reacción 5) = (valor de reacción 3) + (valor de reacción 1).
El lado derecho es la tasa de fotodisociación total, ya sea de oxígeno u ozono.
Debajo de la termosfera, la concentración de oxígeno atómico es muy baja en comparación con el oxígeno molecular. Por lo tanto, es mucho más probable que los átomos de oxígeno choquen con moléculas de oxígeno (diatómicas) que con otros átomos de oxígeno, lo que hace que la recombinación de oxígeno (reacción 5) sea mucho más rara que la creación de ozono (reacción 2). Siguiendo la relación de estado estacionario entre las velocidades de reacción, podemos aproximarnos:
- (rate de reacción 2) = (valor de reacción 3) + (valor de reacción 1)
Mesosfera
En la mesosfera, la fotodisociación del oxígeno domina sobre la fotodisociación del ozono, por lo que tenemos aproximadamente:
- (rate de reacción 2) = (valor de reacción 1) = (valor de reacción 4)
Por lo tanto, el ozono se elimina principalmente mediante la conversión de ozono. Tanto la creación como la conversión de ozono dependen linealmente de la concentración de átomos de oxígeno, pero en la creación de ozono un átomo de oxígeno debe encontrar una molécula de oxígeno y otra molécula de aire (típicamente nitrógeno) simultáneamente, mientras que en la conversión de ozono un átomo de oxígeno solo debe encontrar una molécula de ozono. Así, cuando ambas reacciones están equilibradas, la relación entre las concentraciones de ozono y oxígeno molecular es aproximadamente proporcional a la densidad del aire.
Por lo tanto, la concentración relativa de ozono es mayor en altitudes más bajas, donde la densidad del aire es mayor. Esta tendencia continúa hasta cierto punto hacia la estratosfera y, por lo tanto, a medida que pasamos de 60 km a 30 km de altitud, tanto la densidad del aire como la concentración relativa de ozono aumentan entre 40 y 50 veces.
Estratosfera
La absorción de oxígeno en la mesosfera y la termosfera (en la reacción de fotodisociación del oxígeno) reduce el flujo de fotones en longitudes de onda inferiores a 200 nanómetros, donde la fotodisociación del oxígeno está dominada por bandas continuas y de Schumann-Runge, con una sección transversal de hasta 10-17 cm2. Debido a esta absorción, el flujo de fotones en estas longitudes de onda es tan bajo en la estratosfera, que la fotodisociación del oxígeno queda dominada por la banda de Hertzberg de la longitud de onda del fotón de 200-240 nm, aunque la sección transversal de este proceso es tan baja como 10< sup>-24 - 10-23 cm2. La tasa de fotodisociación del ozono por molécula de ozono tiene una sección transversal 6 órdenes de magnitud mayor en el rango de longitud de onda de 220-300 nm. Con concentraciones de ozono del orden de 10-6-10-5 en relación con el oxígeno molecular, la fotodisociación del ozono se convierte en la reacción de fotodisociación dominante y la mayor parte del calor de la estratosfera se genera a través de esto ocurre, con la mayor tasa de generación de calor por molécula en el límite superior de la estratosfera (estratopausa), donde la concentración de ozono ya es relativamente alta mientras que el flujo de UV todavía es alto también en esas longitudes de onda, antes de agotarse por este mismo proceso de fotodisociación.
Además de que la fotodisociación del ozono se convierta en una reacción de eliminación más dominante, la destrucción catalítica del ozono debido a los radicales libres (principalmente hidrógeno atómico, hidroxilo, óxido nítrico, cloro y bromuro) aumenta la velocidad efectiva de la reacción de conversión del ozono. Ambos procesos actúan para aumentar la eliminación de ozono, lo que lleva a un aumento más moderado de la concentración relativa de ozono a medida que disminuye la altitud, aunque la densidad del aire continúa aumentando.
Debido a la creciente densidad del ozono y del oxígeno a medida que avanzamos a altitudes más bajas, el flujo de fotones UV en longitudes de onda inferiores a 300 nm disminuye sustancialmente y las tasas de fotodisociación del oxígeno caen por debajo de 10-9 por segundo por molécula en 30 kilómetros. Con tasas decrecientes de fotodisociación del oxígeno, las especies impares de oxígeno (moléculas de oxígeno atómico y ozono) difícilmente se forman de novo (en lugar de ser transmutadas entre sí por las otras reacciones), y la mayor parte del oxígeno atómico necesario para la creación de ozono se deriva casi exclusivamente del ozono. eliminación por fotodisociación del ozono. Así, el ozono se agota a medida que descendemos por debajo de los 30 km de altitud y alcanza concentraciones muy bajas en la tropopausa.
Tropósfera
En la troposfera, la formación y destrucción del ozono ya no están controladas por el ciclo ozono-oxígeno. Más bien, la química del ozono troposférico está dominada hoy por contaminantes industriales y otros gases de origen volcánico.
Contenido relacionado
Precisión y exactitud
Evidencia empírica
Teoría del flogisto