Ciclo de las rocas
El ciclo de las rocas es un concepto básico en geología que describe las transiciones a través del tiempo geológico entre los tres tipos principales de... (leer más)
El ciclo celular, o ciclo de división celular, es la serie de eventos que tienen lugar en una célula que hace que se divida en dos células hijas. Estos eventos incluyen la duplicación de su ADN (replicación de ADN) y algunos de sus orgánulos y, posteriormente, la partición de su citoplasma y otros componentes en dos células hijas en un proceso llamado división celular.
En las células con núcleo (eucariotas, es decir, células animales, vegetales, fúngicas y protistas), el ciclo celular se divide en dos etapas principales: la interfase y la fase mitótica (M) (que incluye la mitosis y la citocinesis). Durante la interfase, la célula crece, acumula los nutrientes necesarios para la mitosis y replica su ADN y algunos de sus orgánulos. Durante la fase mitótica, los cromosomas, orgánulos y citoplasma replicados se separan en dos nuevas células hijas. Para garantizar la replicación adecuada de los componentes celulares y la división, existen mecanismos de control conocidos como puntos de control del ciclo celular después de cada uno de los pasos clave del ciclo que determinan si la célula puede avanzar a la siguiente fase.
En las células sin núcleo (procariotas, es decir, bacterias y arqueas), el ciclo celular se divide en los períodos B, C y D. El período B se extiende desde el final de la división celular hasta el comienzo de la replicación del ADN. La replicación del ADN ocurre durante el período C. El período D se refiere a la etapa entre el final de la replicación del ADN y la división de la célula bacteriana en dos células hijas.
El ciclo de división celular es un proceso vital mediante el cual un óvulo fertilizado unicelular se convierte en un organismo maduro, así como el proceso mediante el cual el cabello, la piel, las células sanguíneas y algunos órganos internos se regeneran y curan (con la posible excepción de nervios; ver daño a los nervios). Después de la división celular, cada una de las células hijas comienza la interfase de un nuevo ciclo celular. Aunque las diversas etapas de la interfase no suelen distinguirse morfológicamente, cada fase del ciclo celular tiene un conjunto distinto de procesos bioquímicos especializados que preparan a la célula para el inicio de la división celular.
El ciclo celular eucariótico consta de cuatro fases distintas: fase G 1, fase S (síntesis), fase G 2 (conocida colectivamente como interfase) y fase M (mitosis y citocinesis). La fase M se compone en sí misma de dos procesos estrechamente acoplados: la mitosis, en la que el núcleo de la célula se divide, y la citocinesis, en la que el citoplasma de la célula se divide formando dos células hijas. La activación de cada fase depende de la correcta progresión y finalización de la anterior. Se dice que las células que han dejado de dividirse temporal o reversiblemente han entrado en un estado de reposo llamado fase G 0.
| Expresar | Fase | Abreviatura | Descripción |
|---|---|---|---|
| descansando | brecha 0 | 0 _ | Una fase en la que la célula ha salido del ciclo y ha dejado de dividirse. |
| interfase | brecha 1 | G1 _ | Crecimiento celular. El punto de control G 1 asegura que todo esté listo para la síntesis de ADN. |
| Síntesis | S | replicación del ADN. | |
| brecha 2 | G2 _ | Crecimiento y preparación para la mitosis. El punto de control G 2 asegura que todo esté listo para entrar en la fase M (mitosis) y dividirse. | |
| División celular | Mitosis | METRO | Se produce la división celular. El Metaphase Checkpoint asegura que la célula esté lista para completar la división celular. |
Después de la división celular, cada una de las células hijas comienza la interfase de un nuevo ciclo. Aunque las diversas etapas de la interfase no suelen distinguirse morfológicamente, cada fase del ciclo celular tiene un conjunto distinto de procesos bioquímicos especializados que preparan a la célula para el inicio de la división celular.
G 0 es una fase de reposo donde la célula ha dejado el ciclo y ha dejado de dividirse. El ciclo celular comienza con esta fase. Las células no proliferativas (que no se dividen) en los eucariotas multicelulares generalmente ingresan al estado inactivo G 0 desde G 1 y pueden permanecer inactivos durante largos períodos de tiempo, posiblemente indefinidamente (como suele ser el caso de las neuronas). Esto es muy común para las células que están completamente diferenciadas. Algunas células entran en la fase G0 de forma semipermanente y se consideran posmitóticas, por ejemplo, algunas células del hígado, riñón y estómago. Muchas células no entran en G 0 y continúan dividiéndose a lo largo de la vida de un organismo, por ejemplo, las células epiteliales.
La palabra "posmitótico" se usa a veces para referirse tanto a las células inactivas como a las senescentes. La senescencia celular se produce en respuesta al daño del ADN y al estrés externo y, por lo general, constituye una detención en G 1. La senescencia celular puede hacer que la progenie de una célula no sea viable; a menudo es una alternativa bioquímica a la autodestrucción de una célula dañada por apoptosis.
La interfase representa la fase entre dos fases M sucesivas. La interfase es una serie de cambios que tienen lugar en una célula recién formada y su núcleo antes de que pueda volver a dividirse. También se le llama fase preparatoria o intermitosis. Por lo general, la interfase dura al menos el 91% del tiempo total requerido para el ciclo celular.
La interfase procede en tres etapas, G 1, S y G 2, seguidas por el ciclo de mitosis y citocinesis. El contenido de ADN nuclear de la célula se duplica durante la fase S.
La primera fase dentro de la interfase, desde el final de la fase M anterior hasta el comienzo de la síntesis de ADN, se denomina G 1 (G que indica brecha ). También se denomina fase de crecimiento. Durante esta fase, las actividades biosintéticas de la célula, que se ralentizan considerablemente durante la fase M, se reanudan a un ritmo elevado. La duración de G 1 es muy variable, incluso entre diferentes células de la misma especie. En esta fase, la célula aumenta su suministro de proteínas, aumenta el número de orgánulos (como mitocondrias, ribosomas) y crece en tamaño. En la fase G 1, una celda tiene tres opciones.
El punto decisivo se llama punto de control (punto de restricción). Este punto de control se denomina punto de restricción o INICIO y está regulado por las ciclinas G 1 /S, que provocan la transición de la fase G 1 a la S. El paso por el punto de control G1 compromete a la célula a la división.
La fase S subsiguiente comienza cuando comienza la síntesis de ADN; cuando está completo, todos los cromosomas se han replicado, es decir, cada cromosoma consta de dos cromátidas hermanas. Así, durante esta fase, la cantidad de ADN en la célula se duplica, aunque la ploidía y el número de cromosomas no cambian. Las tasas de transcripción de ARN y síntesis de proteínas son muy bajas durante esta fase. Una excepción a esto es la producción de histonas, la mayoría de las cuales ocurre durante la fase S.
La fase G 2 ocurre después de la replicación del ADN y es un período de síntesis de proteínas y crecimiento celular rápido para preparar la célula para la mitosis. Durante esta fase, los microtúbulos comienzan a reorganizarse para formar un huso (preprofase). Antes de pasar a la fase mitótica, las células deben revisarse en el punto de control G 2 para detectar cualquier daño en el ADN dentro de los cromosomas. El punto de control G 2 está regulado principalmente por la proteína tumoral p53. Si el ADN está dañado, p53 reparará el ADN o desencadenará la apoptosis de la célula. Si p53 es disfuncional o está mutado, las células con ADN dañado pueden continuar a través del ciclo celular, lo que lleva al desarrollo de cáncer.
La fase M relativamente breve consiste en la división nuclear (cariocinesis). Es un período relativamente corto del ciclo celular. La fase M es compleja y altamente regulada. La secuencia de eventos se divide en fases, correspondientes a la finalización de un conjunto de actividades y el inicio del siguiente. Estas fases se conocen secuencialmente como:
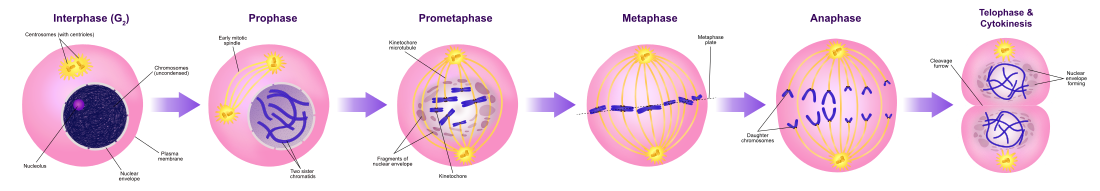
La mitosis es el proceso por el cual una célula eucariota separa los cromosomas de su núcleo celular en dos conjuntos idénticos en dos núcleos. Durante el proceso de mitosis, los pares de cromosomas se condensan y se adhieren a los microtúbulos que atraen a las cromátidas hermanas hacia los lados opuestos de la célula.
La mitosis ocurre exclusivamente en las células eucariotas, pero ocurre de diferentes maneras en diferentes especies. Por ejemplo, las células animales se someten a una mitosis "abierta", donde la envoltura nuclear se rompe antes de que los cromosomas se separen, mientras que los hongos como Aspergillus nidulans y Saccharomyces cerevisiae (levadura) se someten a una mitosis "cerrada", donde los cromosomas se dividen dentro de un núcleo celular intacto..
A la mitosis le sigue inmediatamente la citocinesis, que divide los núcleos, el citoplasma, los orgánulos y la membrana celular en dos células que contienen proporciones aproximadamente iguales de estos componentes celulares. La mitosis y la citocinesis juntas definen la división de la célula madre en dos células hijas, genéticamente idénticas entre sí y con su célula madre. Esto representa aproximadamente el 10% del ciclo celular.
Debido a que la citocinesis generalmente ocurre junto con la mitosis, "mitosis" a menudo se usa indistintamente con "fase M". Sin embargo, hay muchas células en las que la mitosis y la citocinesis ocurren por separado, formando células individuales con múltiples núcleos en un proceso llamado endorreplicación. Esto ocurre sobre todo entre los hongos y mohos mucilaginosos, pero se encuentra en varios grupos. Incluso en animales, la citocinesis y la mitosis pueden ocurrir de forma independiente, por ejemplo, durante ciertas etapas del desarrollo embrionario de la mosca de la fruta. Los errores en la mitosis pueden provocar la muerte celular por apoptosis o causar mutaciones que pueden provocar cáncer.
La regulación del ciclo celular implica procesos cruciales para la supervivencia de una célula, incluida la detección y reparación de daños genéticos, así como la prevención de la división celular descontrolada. Los eventos moleculares que controlan el ciclo celular son ordenados y direccionales; es decir, cada proceso ocurre en forma secuencial y es imposible "revertir" el ciclo.
 Premio Nobel Paul Nurse |  Premio Nobel Tim Hunt |
Dos clases clave de moléculas reguladoras, ciclinas y quinasas dependientes de ciclina (CDK), determinan el progreso de una célula a lo largo del ciclo celular. Leland H. Hartwell, R. Timothy Hunt y Paul M. Nurse ganaron el Premio Nobel de Fisiología o Medicina en 2001 por su descubrimiento de estas moléculas centrales. Muchos de los genes que codifican ciclinas y CDK se conservan entre todos los eucariotas, pero en general, los organismos más complejos tienen sistemas de control del ciclo celular más elaborados que incorporan más componentes individuales. Muchos de los genes relevantes se identificaron por primera vez mediante el estudio de levaduras, especialmente Saccharomyces cerevisiae ; la nomenclatura genética en la levadura denomina a muchos de estos genes cdc (para "ciclo de división celular") seguido de un número de identificación, por ejemplo, cdc25o cdc20.
Las ciclinas forman las subunidades reguladoras y las CDK las subunidades catalíticas de un heterodímero activado; las ciclinas no tienen actividad catalítica y las CDK están inactivas en ausencia de una ciclina asociada. Cuando son activadas por una ciclina unida, las CDK realizan una reacción bioquímica común llamada fosforilación que activa o desactiva proteínas diana para orquestar la entrada coordinada a la siguiente fase del ciclo celular. Diferentes combinaciones de ciclina-CDK determinan las proteínas aguas abajo a las que se dirigen. Las CDK se expresan constitutivamente en las células, mientras que las ciclinas se sintetizan en etapas específicas del ciclo celular, en respuesta a diversas señales moleculares.
Al recibir una señal extracelular promitótica, los complejos G 1 ciclina-CDK se activan para preparar la célula para la fase S, promoviendo la expresión de factores de transcripción que a su vez promueven la expresión de ciclinas S y de enzimas necesarias para la replicación del ADN. Los complejos G 1 ciclina-CDK también promueven la degradación de moléculas que funcionan como inhibidores de la fase S al dirigirlas a la ubiquitinación. Una vez que una proteína ha sido ubiquitinada, el proteosoma la degrada proteolíticamente. Sin embargo, los resultados de un estudio reciente de la dinámica transcripcional de E2F a nivel de una sola célula argumentan que el papel de las actividades de ciclina-CDK G1, en particular de la ciclina D-CDK4/6, es ajustar el tiempo en lugar del compromiso de entrada en el ciclo celular..
Los complejos activos de ciclina S-CDK fosforilan proteínas que forman los complejos de pre-replicación ensamblados durante la fase G 1 en los orígenes de replicación del ADN. La fosforilación tiene dos propósitos: activar cada complejo de pre-replicación ya ensamblado y evitar que se formen nuevos complejos. Esto asegura que cada porción del genoma de la célula se replique una vez y solo una vez. La razón para la prevención de brechas en la replicación es bastante clara, porque las células hijas a las que les faltan todos o parte de los genes cruciales morirán. Sin embargo, por razones relacionadas con los efectos del número de copias de genes, la posesión de copias adicionales de ciertos genes también es perjudicial para las células hijas.
Los complejos mitóticos de ciclina-CDK, que se sintetizan pero se inactivan durante las fases S y G 2, promueven el inicio de la mitosis al estimular las proteínas posteriores involucradas en la condensación cromosómica y el ensamblaje del huso mitótico. Un complejo crítico que se activa durante este proceso es una ubiquitina ligasa conocida como complejo promotor de anafase (APC), que promueve la degradación de proteínas estructurales asociadas con el cinetocoro cromosómico. APC también apunta a las ciclinas mitóticas para la degradación, asegurando que la telofase y la citocinesis puedan continuar.
La ciclina D es la primera ciclina producida en las células que entran en el ciclo celular, en respuesta a señales extracelulares (p. ej., factores de crecimiento). Los niveles de ciclina D se mantienen bajos en las células en reposo que no proliferan. Además, CDK4/6 y CDK2 también están inactivos porque CDK4/6 están unidos por miembros de la familia INK4 (p. ej., p16), lo que limita la actividad de la quinasa. Mientras tanto, los complejos CDK2 son inhibidos por las proteínas CIP/KIP como p21 y p27,Cuando llega el momento de que una célula entre en el ciclo celular, que se desencadena por un estímulo mitogénico, los niveles de ciclina D aumentan. En respuesta a este desencadenante, la ciclina D se une a la CDK4/6 existente y forma el complejo activo ciclina D-CDK4/6. Los complejos de ciclina D-CDK4/6 a su vez monofosforilan la proteína de susceptibilidad al retinoblastoma (Rb) a pRb. El supresor de tumores Rb no fosforilado funciona induciendo la salida del ciclo celular y manteniendo la detención de G0 (senescencia).
En las últimas décadas, se ha aceptado ampliamente un modelo en el que las proteínas pRB se inactivan mediante la fosforilación mediada por ciclina D-Cdk4/6. Rb tiene más de 14 sitios potenciales de fosforilación. La ciclina D-Cdk 4/6 fosforila progresivamente Rb a un estado hiperfosforilado, lo que desencadena la disociación de los complejos pRB-E2F, lo que induce la expresión del gen del ciclo celular G1/S y la progresión a la fase S.
Sin embargo, las observaciones científicas de un estudio reciente muestran que Rb está presente en tres tipos de isoformas: (1) Rb no fosforilado en estado G0; (2) Rb monofosforilado, también conocido como Rb "hipofosforilado" o "parcialmente" fosforilado en el estado G1 temprano, y (3) Rb hiperfosforilado inactivo en el estado G1 tardío. En las células G1 tempranas, el Rb monofosforilado Rb existe como 14 isoformas diferentes, una de cada una tiene una afinidad de unión distinta a E2F. Se ha encontrado que Rb se asocia con cientos de proteínas diferentes y la idea de que diferentes isoformas de Rb monofosforiladas tienen diferentes proteínas asociadas fue muy atractiva. Un informe reciente confirmó que la monofosforilación controla la asociación de Rb con otras proteínas y genera distintas formas funcionales de Rb.Todas las diferentes isoformas de Rb monofosforiladas inhiben el programa transcripcional de E2F y pueden detener las células en la fase G1. Es importante destacar que las diferentes formas monofosforiladas de RB tienen salidas transcripcionales distintas que se extienden más allá de la regulación E2F.
En general, la unión de pRb a E2F inhibe la expresión del gen diana E2F de ciertos genes de transición G1/S y S, incluidas las ciclinas de tipo E. La fosforilación parcial de RB desreprime la supresión mediada por Rb de la expresión del gen objetivo E2F, comienza la expresión de ciclina E. Actualmente se desconoce el mecanismo molecular que hace que la célula cambie a la activación de ciclina E, pero a medida que aumentan los niveles de ciclina E, se forma el complejo activo ciclina E-CDK2, lo que hace que Rb se inactive por hiperfosforilación.La Rb hiperfosforilada está completamente disociada de E2F, lo que permite una mayor expresión de una amplia gama de genes diana de E2F necesarios para impulsar a las células a pasar a la fase S [1]. Recientemente, se ha identificado que la ciclina D-Cdk4/6 se une a una región de hélice alfa C-terminal de Rb que solo se distingue por la ciclina D en lugar de otras ciclinas, ciclina E, A y B.Esta observación basada en el análisis estructural de la fosforilación de Rb respalda que Rb se fosforila en un nivel diferente a través de múltiples complejos Cyclin-Cdk. Esto también hace factible el modelo actual de una inactivación simultánea similar a un interruptor de todas las isoformas de Rb monofosforiladas a través de un tipo de mecanismo de hiperfosforilación de Rb. Además, el análisis mutacional de la hélice C-terminal de Rb específica de ciclina D-Cdk 4/6 muestra que las interrupciones de la unión de ciclina D-Cdk 4/6 a Rb previenen la fosforilación de Rb, detienen las células en G1 y refuerzan las funciones de Rb en el supresor de tumores.. Este mecanismo de transición del ciclo celular impulsado por ciclina-Cdk gobierna una célula comprometida con el ciclo celular que permite la proliferación celular. Un crecimiento de células cancerosas a menudo se acompaña de una desregulación de la actividad de la ciclina D-Cdk 4/6.
El Rb hiperfosforilado se disocia del complejo E2F/DP1/Rb (que estaba unido a los genes sensibles a E2F, "bloqueándolos" efectivamente de la transcripción), activando E2F. La activación de E2F da como resultado la transcripción de varios genes como ciclina E, ciclina A, ADN polimerasa, timidina quinasa, etc. La ciclina E así producida se une a CDK2, formando el complejo ciclina E-CDK2, que empuja a la célula de la fase G 1 a la S (G 1 /S, que inicia la transición G 2 /M). La activación del complejo ciclina B-cdk1 provoca la ruptura de la envoltura nuclear y el inicio de la profase y, posteriormente, su desactivación hace que la célula salga de la mitosis.Un estudio cuantitativo de la dinámica transcripcional de E2F a nivel de una sola célula mediante el uso de células indicadoras fluorescentes diseñadas proporcionó un marco cuantitativo para comprender la lógica de control de la entrada del ciclo celular, desafiando el modelo de libro de texto canónico. Los genes que regulan la amplitud de la acumulación de E2F, como Myc, determinan el compromiso en el ciclo celular y la entrada en la fase S. Las actividades de ciclina-CDK G1 no son el impulsor de la entrada en el ciclo celular. En cambio, ajustan principalmente el momento del aumento de E2F, modulando así el ritmo de la progresión del ciclo celular.
Dos familias de genes, la familia cip /kip ( proteína que interactúa con CDK/proteína inhibidora de la cinasa ) y la familia INK4a /ARF ( inhibidor de la cinasa 4/ marco de lectura alternativo ), impiden la progresión del ciclo celular. Debido a que estos genes son fundamentales en la prevención de la formación de tumores, se conocen como supresores de tumores.
La familia cip/kip incluye los genes p21, p27 y p57. Detienen el ciclo celular en la fase G 1 al unirse e inactivar los complejos ciclina-CDK. p21 es activado por p53 (que, a su vez, es activado por daño en el ADN, por ejemplo, debido a la radiación). p27 es activado por el factor de crecimiento transformante β (TGF β), un inhibidor del crecimiento.
La familia INK4a/ARF incluye p16, que se une a CDK4 y detiene el ciclo celular en la fase G 1, y p14, que previene la degradación de p53.
Los inhibidores sintéticos de Cdc25 también podrían ser útiles para detener el ciclo celular y, por lo tanto, ser útiles como agentes antineoplásicos y anticancerígenos.
Muchos cánceres humanos poseen las actividades hiperactivadas de Cdk 4/6. Dadas las observaciones de las funciones de ciclina D-Cdk 4/6, la inhibición de Cdk 4/6 debería dar como resultado la prevención de la proliferación de un tumor maligno. En consecuencia, los científicos han intentado inventar el inhibidor sintético de Cdk4/6, ya que Cdk4/6 se ha caracterizado por ser un objetivo terapéutico para la eficacia antitumoral. Tres inhibidores de Cdk4/6 (palbociclib, ribociclib y abemaciclib) recibieron actualmente la aprobación de la FDA para su uso clínico en el tratamiento del cáncer de mama en estadio avanzado o metastásico, con receptores de hormonas positivos (HR-positivo, HR+) y HER2-negativo (HER2-)..Por ejemplo, palbociclib es un inhibidor de CDK4/6 activo por vía oral que ha demostrado mejores resultados para el cáncer de mama avanzado positivo para ER/negativo para HER2. El principal efecto secundario es la neutropenia, que puede controlarse mediante la reducción de la dosis.
La terapia dirigida con Cdk4/6 solo tratará los tipos de cáncer en los que se expresa Rb. Las células cancerosas con pérdida de Rb tienen resistencia primaria a los inhibidores de Cdk4/6.
La evidencia actual sugiere que una red transcripcional semiautónoma actúa en concierto con la maquinaria de CDK-ciclina para regular el ciclo celular. Varios estudios de expresión génica en Saccharomyces cerevisiae han identificado entre 800 y 1200 genes que cambian la expresión a lo largo del ciclo celular. Se transcriben en niveles altos en puntos específicos del ciclo celular y permanecen en niveles más bajos durante el resto del ciclo. Si bien el conjunto de genes identificados difiere entre estudios debido a los métodos computacionales y los criterios utilizados para identificarlos, cada estudio indica que una gran parte de los genes de levadura están regulados temporalmente.
Muchos genes expresados periódicamente están impulsados por factores de transcripción que también se expresan periódicamente. Una pantalla de knockouts de un solo gen identificó 48 factores de transcripción (alrededor del 20% de todos los factores de transcripción no esenciales) que muestran defectos de progresión del ciclo celular. Los estudios de todo el genoma que utilizan tecnologías de alto rendimiento han identificado los factores de transcripción que se unen a los promotores de los genes de levadura, y la correlación de estos hallazgos con los patrones de expresión temporal ha permitido la identificación de factores de transcripción que impulsan la expresión génica específica de fase.Los perfiles de expresión de estos factores de transcripción están impulsados por los factores de transcripción que alcanzan su punto máximo en la fase anterior, y los modelos computacionales han demostrado que una red autónoma de CDK de estos factores de transcripción es suficiente para producir oscilaciones de estado estacionario en la expresión génica).
La evidencia experimental también sugiere que la expresión génica puede oscilar con el período observado en la división de células de tipo salvaje independientemente de la maquinaria CDK. orlando et al. utilizaron micromatrices para medir la expresión de un conjunto de 1271 genes que identificaron como periódicos tanto en células de tipo salvaje como en células que carecen de todas las ciclinas mitóticas y de fase S ( clb1,2,3,4,5,6 ). De los 1.271 genes ensayados, 882 continuaron expresándose en las células deficientes en ciclina al mismo tiempo que en las células de tipo salvaje, a pesar de que las células deficientes en ciclina se detienen en el límite entre G 1y fase S. Sin embargo, 833 de los genes analizados cambiaron el comportamiento entre las células de tipo salvaje y las mutantes, lo que indica que estos genes probablemente estén regulados directa o indirectamente por la maquinaria de la ciclina CDK. Algunos genes que continuaron expresándose en el tiempo en las células mutantes también se expresaron en diferentes niveles en las células mutantes y de tipo salvaje. Estos hallazgos sugieren que, si bien la red transcripcional puede oscilar independientemente del oscilador de ciclina CDK, están acoplados de una manera que requiere que ambos aseguren el momento adecuado de los eventos del ciclo celular. Otro trabajo indica que la fosforilación, una modificación postraduccional, de los factores de transcripción del ciclo celular por parte de Cdk1 puede alterar la localización o la actividad de los factores de transcripción para controlar estrictamente el tiempo de los genes diana.
Mientras que la transcripción oscilatoria juega un papel clave en la progresión del ciclo celular de la levadura, la maquinaria de CDK-ciclina opera de forma independiente en el ciclo celular embrionario temprano. Antes de la transición de la mitad de la blástula, no se produce la transcripción cigótica y todas las proteínas necesarias, como las ciclinas de tipo B, se traducen desde el ARNm cargado por la madre.
Los análisis de cultivos sincronizados de Saccharomyces cerevisiae en condiciones que evitan el inicio de la replicación del ADN sin retrasar la progresión del ciclo celular mostraron que la licencia de origen disminuye la expresión de genes con orígenes cerca de sus extremos 3', lo que revela que los orígenes aguas abajo pueden regular la expresión de los genes aguas arriba. Esto confirma las predicciones previas del modelado matemático de una coordinación causal global entre la actividad del origen de la replicación del ADN y la expresión del ARNm, y muestra que el modelado matemático de los datos de micromatrices de ADN se puede utilizar para predecir correctamente modos de regulación biológicos previamente desconocidos.
Los puntos de control del ciclo celular son utilizados por la célula para monitorear y regular el progreso del ciclo celular. Los puntos de control evitan la progresión del ciclo celular en puntos específicos, lo que permite la verificación de los procesos de fase necesarios y la reparación del daño en el ADN. La célula no puede pasar a la siguiente fase hasta que se hayan cumplido los requisitos del punto de control. Los puntos de control generalmente consisten en una red de proteínas reguladoras que monitorean y dictan la progresión de la célula a través de las diferentes etapas del ciclo celular.
Se estima que en las células humanas normales, alrededor del 1% de los daños en el ADN monocatenario se convierten en alrededor de 50 roturas endógenas de ADN bicatenario por célula y por ciclo celular. Aunque estas roturas de doble cadena suelen repararse con alta fidelidad, se considera que los errores en su reparación contribuyen significativamente a la tasa de cáncer en humanos.
Hay varios puntos de control para garantizar que el ADN dañado o incompleto no se transmita a las células hijas. Existen tres puntos de control principales: el punto de control G 1 /S, el punto de control G 2 /M y el punto de control de la metafase (mitótico). Otro punto de control es el punto de control Go, en el que se comprueba la madurez de las celdas. Si las células no pasan este punto de control porque aún no están listas, se descartarán de la división.
La transición G 1 /S es un paso limitante de la velocidad en el ciclo celular y también se conoce como punto de restricción. Aquí es donde la célula comprueba si tiene suficientes materias primas para replicar completamente su ADN (bases de nucleótidos, ADN sintasa, cromatina, etc.). Una célula enferma o desnutrida se quedará atascada en este punto de control.
El punto de control G 2 /M es donde la célula se asegura de tener suficiente citoplasma y fosfolípidos para dos células hijas. Pero a veces, lo que es más importante, verifica si es el momento adecuado para replicar. Hay algunas situaciones en las que muchas células deben replicarse simultáneamente (por ejemplo, un embrión en crecimiento debe tener una distribución celular simétrica hasta que alcance la transición de la mitad de la blástula). Esto se hace controlando el punto de control G 2 /M.
El punto de control de la metafase es un punto de control bastante menor, ya que una vez que una célula está en metafase, se ha comprometido a sufrir mitosis. Sin embargo, eso no quiere decir que no sea importante. En este punto de control, la célula verifica que se haya formado el huso y que todos los cromosomas estén alineados en el ecuador del huso antes de que comience la anafase.
Si bien estos son los tres puntos de control "principales", no todas las celdas tienen que pasar por cada uno de estos puntos de control en este orden para replicarse. Muchos tipos de cáncer son causados por mutaciones que permiten que las células aceleren los diversos puntos de control o incluso los salten por completo. Pasando de la fase S a la M a la S casi consecutivamente. Debido a que estas células han perdido sus puntos de control, cualquier mutación de ADN que pueda haber ocurrido se ignora y se transmite a las células hijas. Esta es una de las razones por las que las células cancerosas tienen una tendencia a acumular mutaciones exponencialmente. Además de las células cancerosas, muchos tipos de células completamente diferenciadas ya no se replican, por lo que abandonan el ciclo celular y permanecen en G 0hasta su muerte. Eliminando así la necesidad de puntos de control celulares. También se ha propuesto un modelo alternativo de la respuesta del ciclo celular al daño del ADN, conocido como punto de control posterior a la replicación.
La regulación de puntos de control juega un papel importante en el desarrollo de un organismo. En la reproducción sexual, cuando ocurre la fertilización del óvulo, cuando el espermatozoide se une al óvulo, libera factores de señalización que notifican al óvulo que ha sido fertilizado. Entre otras cosas, esto induce al ovocito ahora fertilizado a regresar de su estado previamente inactivo, G 0, al ciclo celular ya la replicación y división mitótica.
p53 juega un papel importante en la activación de los mecanismos de control en los puntos de control G 1 /S y G 2 /M. Además de p53, los reguladores de los puntos de control se están investigando intensamente por sus funciones en el crecimiento y la proliferación del cáncer.
El trabajo pionero de Atsushi Miyawaki y colaboradores desarrolló el indicador del ciclo celular basado en la ubiquitinación fluorescente (FUCCI), que permite obtener imágenes de fluorescencia del ciclo celular. Originalmente, una proteína fluorescente verde, mAG, se fusionó con hGem (1/110) y una proteína fluorescente naranja (mKO 2 ) se fusionó con hCdt1 (30/120). Tenga en cuenta que estas fusiones son fragmentos que contienen una señal de localización nuclear y sitios de ubiquitinación para la degradación, pero no son proteínas funcionales. La proteína fluorescente verde se produce durante la fase S, G 2 o M y se degrada durante la fase G 0 o G 1, mientras que la proteína fluorescente naranja se produce durante la fase G 0 o G 1 y se destruye durante la fase S, G2, o fase M. Se desarrolló un FUCCI de infrarrojo cercano y rojo lejano utilizando una proteína fluorescente derivada de cianobacterias (smURFP) y una proteína fluorescente derivada de bacteriofitocromo (película que se encuentra en este enlace).
Una desregulación de los componentes del ciclo celular puede conducir a la formación de tumores. Como se mencionó anteriormente, cuando algunos genes como los inhibidores del ciclo celular, RB, p53, etc. mutan, pueden hacer que la célula se multiplique sin control, formando un tumor. Aunque la duración del ciclo celular en las células tumorales es igual o mayor que la del ciclo celular normal, la proporción de células que están en división celular activa (frente a las células inactivas en fase G 0 ) en los tumores es mucho mayor que la del tejido normal.. Por lo tanto, hay un aumento neto en el número de células ya que el número de células que mueren por apoptosis o senescencia permanece igual.
Las células que experimentan activamente el ciclo celular son el objetivo de la terapia contra el cáncer ya que el ADN está relativamente expuesto durante la división celular y, por lo tanto, es susceptible al daño por fármacos o radiación. Este hecho se utiliza en el tratamiento del cáncer; mediante un proceso conocido como citorreducción, se elimina una masa significativa del tumor que empuja a un número significativo de las células tumorales restantes de la fase G 0 a la G 1 (debido a una mayor disponibilidad de nutrientes, oxígeno, factores de crecimiento, etc.). La radiación o la quimioterapia después del procedimiento de citorreducción mata estas células que acaban de entrar en el ciclo celular.
Las células de mamífero de ciclo más rápido en cultivo, las células de las criptas en el epitelio intestinal, tienen un tiempo de ciclo tan corto como de 9 a 10 horas. Las células madre en la piel de ratón en reposo pueden tener un tiempo de ciclo de más de 200 horas. La mayor parte de esta diferencia se debe a la duración variable de G 1, la fase más variable del ciclo. M y S no varían mucho.
En general, las células son más radiosensibles al final de las fases M y G 2 y más resistentes al final de la fase S.
Para las células con un tiempo de ciclo celular más largo y una fase G 1 significativamente larga, hay un segundo pico de resistencia tarde en G 1.
El patrón de resistencia y sensibilidad se correlaciona con el nivel de compuestos de sulfhidrilo en la célula. Los sulfhidrilos son sustancias naturales que protegen a las células del daño por radiación y tienden a estar en sus niveles más altos en S y en su punto más bajo cerca de la mitosis.
La recombinación homóloga (HR) es un proceso preciso para reparar roturas de doble cadena de ADN. HR está casi ausente en la fase G1, es más activa en la fase S y declina en G 2 /M. La unión de extremos no homólogos, un proceso menos preciso y más mutagénico para reparar roturas de doble cadena, está activo durante todo el ciclo celular.
El ciclo de las rocas es un concepto básico en geología que describe las transiciones a través del tiempo geológico entre los tres tipos principales de... (leer más)
Un ciclo biogeoquímico es el camino por el cual una sustancia química circula los compartimentos biótico y abiótico de la Tierra. El compartimento... (leer más)
En biología, un ciclo de vida biológico es una serie de cambios en la forma que sufre un organismo, volviendo al estado inicial. El concepto está... (leer más)