Cicatrización de la herida
| Abrasión de mano | ||||
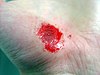 | 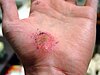 | 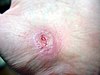 | 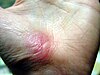 | |
| Día de lesión | 3 días después | 17 días después | 30 días después | |
curación de heridas se refiere a la sustitución por parte de un organismo vivo del tejido destruido o dañado por tejido recién producido.
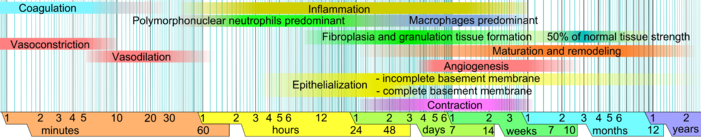
En la piel sana, la epidermis (capa epitelial superficial) y la dermis (capa conectiva más profunda) forman una barrera protectora contra el entorno externo. Cuando se rompe la barrera, se pone en marcha una secuencia regulada de eventos bioquímicos para reparar el daño. Este proceso se divide en fases predecibles: coagulación sanguínea (hemostasia), inflamación, crecimiento tisular (proliferación celular) y remodelación tisular (maduración y diferenciación celular). Se puede considerar que la coagulación de la sangre es parte de la etapa de inflamación en lugar de una etapa separada.

El proceso de curación de heridas no sólo es complejo sino también frágil, y es susceptible de interrupción o fracaso que conduzca a la formación de heridas crónicas que no cicatrizan. Los factores que contribuyen a que las heridas crónicas no cicatricen son la diabetes, las enfermedades venosas o arteriales, las infecciones y las deficiencias metabólicas de la vejez.
El cuidado de las heridas fomenta y acelera la curación mediante la limpieza y la protección contra nuevas lesiones o infecciones. Dependiendo de las necesidades de cada paciente, puede abarcar desde los primeros auxilios más simples hasta especialidades de enfermería completas, como enfermería de heridas, ostomía y continencia y atención en centros de quemados.
Etapas
- Hemostasis (blood clotting): En los primeros minutos de lesión, las plaquetas de la sangre comienzan a pegarse al sitio lesionado. Se transforman en una forma amorfa, más adecuada para la coagulación, y liberan señales químicas para promover la coagulación. Esto resulta en la activación de fibrin, que forma una malla y actúa como "glue" para atar plaquetas entre sí. Esto hace un coágulo que sirve para enchufar el descanso en el vaso sanguíneo, ralentizando/preveniendo sangrado más.
- Inflamación: Durante esta fase se eliminan las células dañadas y muertas, junto con bacterias y otros patógenos o escombros. Esto sucede a través del proceso de la fagocitosis, donde los glóbulos blancos envolven escombros y la destruyen. Los factores de crecimiento derivados de plaquetas se liberan en la herida que causa la migración y división de células durante la fase proliferativa.
- Proliferación (crecimiento del tejido nuevo): En esta fase se producen angiogénesis, deposición de colágeno, formación de tejidos de granulación, epitelialización y contracción de heridas. En la angiogénesis, las células endoteliales vasculares forman nuevos vasos sanguíneos. En la fibroplasia y la formación de tejidos de granulación, los fibroblastos crecen y forman una nueva matriz extracelular provisional (ECM) excretando colágeno y fibronectina. Concurrentemente, se produce la reepithelialización de la epidermis, en la que las células epiteliales proliferan y 'crudecen' sobre la cama de la herida, proporcionando cobertura para el nuevo tejido. En la contracción de la herida, los miofibroblastos disminuyen el tamaño de la herida al agarrar los bordes de la herida y contraer usando un mecanismo que se asemeja a eso en las células musculares lisas. Cuando los roles de las células están cerca de las células completas, sin necesidad de células sufren apoptosis.
- Maturación (remodelización): Durante la maduración y remodelación, el colágeno se realinea en líneas de tensión, y las células que ya no son necesarias se eliminan por la muerte celular programada, o apoptosis.
Momento y reepitelización
El momento oportuno es importante para la curación de heridas. Fundamentalmente, el momento de la reepitelización de la herida puede decidir el resultado de la curación. Si la epitelización del tejido sobre un área denudada es lenta, se formará una cicatriz al cabo de muchas semanas o meses; Si la epitelización de una zona herida es rápida, la curación dará como resultado la regeneración.
Fase temprana versus fase celular

La curación de heridas se divide clásicamente en hemostasia, inflamación, proliferación y remodelación. Aunque es un constructo útil, este modelo emplea una superposición considerable entre fases individuales. Recientemente se ha descrito un modelo complementario en el que se delinean más claramente los numerosos elementos de la cicatrización de heridas. La importancia de este nuevo modelo se vuelve más evidente a través de su utilidad en los campos de la medicina regenerativa y la ingeniería de tejidos (consulte la sección Investigación y desarrollo a continuación). En este constructo, el proceso de cicatrización de heridas se divide en dos fases principales: la fase temprana y la fase celular:
La fase temprana, que comienza inmediatamente después de la lesión de la piel, implica eventos moleculares y celulares en cascada que conducen a la hemostasia y la formación de una matriz extracelular temprana e improvisada que proporciona la fase estructural para la unión celular y la posterior proliferación celular.
La fase celular involucra varios tipos de células que trabajan juntas para generar una respuesta inflamatoria, sintetizar tejido de granulación y restaurar la capa epitelial. Las subdivisiones de la fase celular son:
- Macrofages y componentes inflamatorios (en 1–2 días)
- Interacción epitelial-mesenquimal: reepithelialización (cambio de fenotipo dentro de horas, la migración comienza el día 1 o 2)
- Fibroblatos y miofibroblastos: alineación progresiva, producción de colágeno y contracción de matriz (entre el día 4 y el día 14)
- Células endoteliales y angiogénesis (comienza el día 4)
- Matriz dérmica: elementos de fabricación (comienza el día 4, dura 2 semanas) y alteración/remodelización (comienza después de la semana 2, semanas duras a meses, dependiendo del tamaño de la herida).
Fase inflamatoria
Justo antes de que se inicie la fase inflamatoria, se produce la cascada de coagulación para lograr la hemostasia o detener la pérdida de sangre mediante un coágulo de fibrina. Posteriormente, se liberan varios factores solubles (incluidas quimiocinas y citocinas) para atraer células que fagocitan desechos, bacterias y tejido dañado, además de liberar moléculas de señalización que inician la fase proliferativa de la cicatrización de heridas.
Cascada de coagulación
Cuando el tejido se lesiona por primera vez, la sangre entra en contacto con el colágeno, lo que hace que las plaquetas comiencen a secretar factores inflamatorios. Las plaquetas también expresan glicoproteínas pegajosas en sus membranas celulares que les permiten agregarse formando una masa.
La fibrina y la fibronectina se entrecruzan y forman un tapón que atrapa proteínas y partículas y previene una mayor pérdida de sangre. Este tapón de fibrina-fibronectina es también el principal soporte estructural de la herida hasta que se deposita el colágeno. Las células migratorias utilizan este tapón como matriz para atravesarlo, y las plaquetas se adhieren a él y secretan factores. El coágulo finalmente se lisa y se reemplaza con tejido de granulación y luego con colágeno.
Las plaquetas, las células presentes en mayor número poco después de que se produce una herida, liberan mediadores en la sangre, incluidas citocinas y factores de crecimiento. Los factores de crecimiento estimulan a las células a acelerar su tasa de división. Las plaquetas liberan otros factores proinflamatorios como serotonina, bradicinina, prostaglandinas, prostaciclinas, tromboxano e histamina, que tienen varios propósitos, incluido aumentar la proliferación y migración celular al área y hacer que los vasos sanguíneos se dilaten y se vuelvan porosos. En muchos sentidos, las plaquetas extravasadas en un traumatismo desempeñan una función similar a la de los macrófagos tisulares y los mastocitos expuestos a firmas moleculares microbianas en la infección: se activan y secretan mediadores moleculares (aminas vasoactivas, eicosanoides y citocinas) que inician el proceso inflamatorio.
Vasoconstricción y vasodilatación
Inmediatamente después de que se rompe un vaso sanguíneo, las membranas celulares rotas liberan factores inflamatorios como tromboxanos y prostaglandinas que causan espasmos en el vaso para prevenir la pérdida de sangre y recolectar células y factores inflamatorios en el área. Esta vasoconstricción dura de cinco a diez minutos y es seguida por vasodilatación, un ensanchamiento de los vasos sanguíneos, que alcanza su punto máximo aproximadamente 20 minutos después de la herida. La vasodilatación es el resultado de factores liberados por las plaquetas y otras células. El principal factor implicado en provocar la vasodilatación es la histamina. La histamina también hace que los vasos sanguíneos se vuelvan porosos, lo que permite que el tejido se vuelva edematoso porque las proteínas del torrente sanguíneo se filtran al espacio extravascular, lo que aumenta su carga osmolar y atrae agua hacia el área. El aumento de la porosidad de los vasos sanguíneos también facilita la entrada de células inflamatorias, como los leucocitos, al lugar de la herida desde el torrente sanguíneo.
Neutrófilos polimorfonucleares
Una hora después de la herida, los neutrófilos polimorfonucleares (PMN) llegan al sitio de la herida y se convierten en las células predominantes en la herida durante los primeros dos días después de que se produce la lesión, con números especialmente altos en el segundo día. Son atraídos al sitio por la fibronectina, los factores de crecimiento y sustancias como las quininas. Los neutrófilos fagocitan los desechos y matan las bacterias liberando radicales libres en lo que se llama un estallido respiratorio. También limpian la herida secretando proteasas que descomponen el tejido dañado. Los neutrófilos funcionales en el sitio de la herida solo tienen una vida útil de alrededor de dos días, por lo que generalmente sufren apoptosis una vez que han completado sus tareas y son fagocitados y degradados por los macrófagos.
Otros leucocitos que ingresan al área incluyen las células T colaboradoras, que secretan citoquinas para hacer que más células T se dividan y aumenten la inflamación y mejoren la vasodilatación y la permeabilidad de los vasos. Las células T también aumentan la actividad de los macrófagos.
Macrófagos
Una de las funciones de los macrófagos es fagocitar otros fagocitos gastados, bacterias y tejido dañado, y también desbridan el tejido dañado mediante la liberación de proteasas.
Los macrófagos funcionan en la regeneración y son esenciales para la cicatrización de heridas. Son estimulados por el bajo contenido de oxígeno de su entorno para producir factores que inducen y aceleran la angiogénesis y también estimulan las células que reepitelizan la herida, crean tejido de granulación y establecen una nueva matriz extracelular. Al secretar estos factores, los macrófagos contribuyen a impulsar el proceso de curación de heridas a la siguiente fase. Reemplazan a los PMN como células predominantes en la herida dos días después de la lesión.
El bazo contiene la mitad de los monocitos del cuerpo en reserva, listos para ser utilizados en el tejido lesionado. Atraídos al sitio de la herida por factores de crecimiento liberados por las plaquetas y otras células, los monocitos del torrente sanguíneo ingresan al área a través de las paredes de los vasos sanguíneos. La cantidad de monocitos en la herida alcanza su punto máximo entre uno y un día y medio después de que se produce la lesión. Una vez que están en el sitio de la herida, los monocitos maduran y se convierten en macrófagos. Los macrófagos también secretan una serie de factores, como factores de crecimiento y otras citocinas, especialmente durante el tercer y cuarto día después de la herida. Estos factores atraen a la zona las células implicadas en la etapa de proliferación de la curación.
En la cicatrización de heridas que resultan en una reparación incompleta, se produce una contracción de la cicatriz, lo que genera distintos grados de imperfecciones estructurales, deformidades y problemas de flexibilidad. Los macrófagos pueden restringir la fase de contracción. Los científicos han informado que la eliminación de los macrófagos de una salamandra provocó el fracaso de una respuesta de regeneración típica (regeneración de las extremidades), provocando en lugar de ello una respuesta de reparación (cicatrización).
Disminución de la fase inflamatoria
A medida que la inflamación disminuye, se secretan menos factores inflamatorios, los existentes se descomponen y la cantidad de neutrófilos y macrófagos se reduce en el sitio de la herida. Estos cambios indican que la fase inflamatoria está finalizando y la fase proliferativa está en marcha. La evidencia in vitro, obtenida utilizando el modelo dérmico equivalente, sugiere que la presencia de macrófagos en realidad retrasa la contracción de la herida y, por tanto, la desaparición de los macrófagos de la herida puede ser esencial para que se produzcan fases posteriores.
Debido a que la inflamación desempeña un papel en la lucha contra las infecciones, la eliminación de residuos y la inducción de la fase de proliferación, es una parte necesaria de la curación. Sin embargo, la inflamación puede provocar daños en los tejidos si dura demasiado. Por tanto, la reducción de la inflamación es frecuentemente un objetivo en entornos terapéuticos. La inflamación dura mientras haya restos en la herida. Por lo tanto, si el sistema inmunológico del individuo está comprometido y no puede eliminar los desechos de la herida y/o si hay un exceso de detritos, tejido desvitalizado o biopelícula microbiana en la herida, estos factores pueden causar una fase inflamatoria prolongada. y evitar que la herida comience adecuadamente la fase de proliferación de curación. Esto puede provocar una herida crónica.
Fase proliferativa
Aproximadamente dos o tres días después de que se produce la herida, los fibroblastos comienzan a ingresar al sitio de la herida, lo que marca el inicio de la fase proliferativa incluso antes de que haya terminado la fase inflamatoria. Como en las otras fases de la cicatrización de heridas, los pasos de la fase proliferativa no ocurren en serie, sino que se superponen parcialmente en el tiempo.
Angiogénesis
También llamado neovascularización, el proceso de angiogénesis ocurre simultáneamente con la proliferación de fibroblastos cuando las células endoteliales migran al área de la herida. Debido a que la actividad de los fibroblastos y las células epiteliales requiere oxígeno y nutrientes, la angiogénesis es imprescindible para otras etapas de la cicatrización de heridas, como la migración epidérmica y de fibroblastos. El tejido en el que se ha producido la angiogénesis suele tener un aspecto rojo (eritematoso) debido a la presencia de capilares.
La angiogénesis ocurre en fases superpuestas en respuesta a la inflamación:
- Período latente: Durante la fase haemostática e inflamatoria del proceso de curación de la herida, la vasodilatación y la permeabilización permiten la extravasación de leucocitos y el desbridamiento y descontaminación de la zona de la herida. La inflamación del tejido ayuda a la angiogénesis posterior al expandir y aflojar la matriz extracelular colágena existente.
- Activación endotelial: A medida que los macrófagos de la herida cambian de modo inflamatorio a modo curativo, comienza a secretar factores de quimiotácticos endoteliales y de crecimiento para atraer células endoteliales adyacentes. Las células endoteliales activadas responden retrayendo y reduciendo las uniones celulares, aflojándose de su endotelio incrustado. Característicamente las células endoteliales activadas muestran nucleoli agrandado.
- Degradación de la membrana basal endotelial: Los macrófagos de la herida, las células más pequeñas y las células endoteliales en sí mismos secretan proteas para descomponer lamina basal vascular existente.
- Vascular brote: Con el desglose de la membrana basal endotelial, las células endoteliales de capilares preexistentes y los venules post-capilar pueden dividir y migrar químicamente hacia la herida, colocando nuevos vasos en el proceso. El brote vascular puede ser ayudado por hipoxia ambiental y acidosis en el ambiente de la herida, ya que la hipoxia estimula el factor de transcripción endotelial, factor hipoxia inducible (HIF) para transactivar genes angiogénicos como VEGF y GLUT1. Los vasos diseminados pueden autoorganizarse en morfologías luminales, y la fusión de canales ciegos da lugar a nuevas redes capilares.
- maduración vascular: el endotelio de los vasos maduros estableciendo nueva matriz extracelular endotelial, seguida de formación lamina basal. Por último, el buque establece una capa pericita.
Las células madre de las células endoteliales, que se originan en partes de vasos sanguíneos ilesos, desarrollan pseudópodos y empujan a través de la MEC hacia el sitio de la herida para establecer nuevos vasos sanguíneos.
Las células endoteliales son atraídas al área de la herida por la fibronectina que se encuentra en la costra de fibrina y quimiotácticamente por factores angiogénicos liberados por otras células, p. de macrófagos y plaquetas cuando se encuentra en un ambiente con poco oxígeno. El crecimiento y la proliferación endotelial también se estimulan directamente por la hipoxia y la presencia de ácido láctico en la herida. Por ejemplo, la hipoxia estimula el factor de transcripción endotelial, el factor inducible por hipoxia (HIF), para transactivar un conjunto de genes proliferativos, incluido el factor de crecimiento endotelial vascular (VEGF) y el transportador de glucosa 1 (GLUT1).
Para migrar, las células endoteliales necesitan colagenasas y activador del plasminógeno para degradar el coágulo y parte de la MEC. Las metaloproteinasas dependientes de zinc digieren la membrana basal y la ECM para permitir la migración, proliferación y angiogénesis celular.
Cuando los macrófagos y otras células productoras de factores de crecimiento ya no se encuentran en un ambiente hipóxico lleno de ácido láctico, dejan de producir factores angiogénicos. Por tanto, cuando el tejido está adecuadamente perfundido, se reduce la migración y proliferación de células endoteliales. Con el tiempo, los vasos sanguíneos que ya no son necesarios mueren por apoptosis.
Fibroplasia y formación de tejido de granulación
Simultáneamente con la angiogénesis, los fibroblastos comienzan a acumularse en el sitio de la herida. Los fibroblastos comienzan a ingresar al sitio de la herida de dos a cinco días después de la herida, cuando termina la fase inflamatoria, y su número alcanza su punto máximo entre una y dos semanas después de la herida. Al final de la primera semana, los fibroblastos son las células principales de la herida. La fibroplasia termina de dos a cuatro semanas después de la herida.
Como modelo, el mecanismo de la fibroplasia puede conceptualizarse como un proceso análogo a la angiogénesis (ver arriba): solo que el tipo de célula involucrada son los fibroblastos en lugar de las células endoteliales. Inicialmente hay una fase latente donde la herida sufre exudación plasmática, descontaminación inflamatoria y desbridamiento. El edema aumenta la accesibilidad histológica de la herida para una posterior migración fibroplástica. En segundo lugar, a medida que la inflamación se acerca a su finalización, los macrófagos y los mastocitos liberan crecimiento de fibroblastos y factores quimiotácticos para activar los fibroblastos del tejido adyacente. En esta etapa, los fibroblastos se desprenden de las células circundantes y de la ECM. Los fagocitos liberan además proteasas que descomponen la ECM del tejido vecino, liberando a los fibroblastos activados para que proliferen y migren hacia la herida. La diferencia entre el brote vascular y la proliferación de fibroblastos es que el primero se ve potenciado por la hipoxia, mientras que el segundo se inhibe por la hipoxia. El tejido conectivo fibroblástico depositado madura secretando ECM hacia el espacio extracelular, formando tejido de granulación (ver más abajo). Por último, el colágeno se deposita en la ECM.
En los primeros dos o tres días después de la lesión, los fibroblastos migran y proliferan principalmente, mientras que más tarde son las células principales que depositan la matriz de colágeno en el sitio de la herida. Se cree que los orígenes de estos fibroblastos provienen del tejido cutáneo ileso adyacente (aunque nueva evidencia sugiere que algunos se derivan de células madre/precursores adultos circulantes y transmitidos por la sangre). Inicialmente, los fibroblastos utilizan las fibras entrecruzadas de fibrina (bien formadas al final de la fase inflamatoria) para migrar a través de la herida y posteriormente adherirse a la fibronectina. Luego, los fibroblastos depositan sustancia fundamental en el lecho de la herida y luego colágeno, al que pueden adherirse para migrar.
El tejido de granulación funciona como tejido rudimentario y comienza a aparecer en la herida ya durante la fase inflamatoria, de dos a cinco días después de la herida, y continúa creciendo hasta cubrir el lecho de la herida. El tejido de granulación está formado por nuevos vasos sanguíneos, fibroblastos, células inflamatorias, células endoteliales, miofibroblastos y los componentes de una nueva matriz extracelular provisional (MEC). La ECM provisional tiene una composición diferente a la ECM del tejido normal y sus componentes se originan a partir de fibroblastos. Dichos componentes incluyen fibronectina, colágeno, glucosaminoglicanos, elastina, glicoproteínas y proteoglicanos. Sus principales componentes son la fibronectina y el hialuronano, que crean una matriz muy hidratada y facilitan la migración celular. Posteriormente, esta matriz provisional se reemplaza con una MEC que se parece más a la que se encuentra en el tejido no lesionado.
Los factores de crecimiento (PDGF, TGF-β) y la fibronectina estimulan la proliferación, la migración al lecho de la herida y la producción de moléculas de ECM por parte de los fibroblastos. Los fibroblastos también secretan factores de crecimiento que atraen células epiteliales al sitio de la herida. La hipoxia también contribuye a la proliferación de fibroblastos y la excreción de factores de crecimiento, aunque muy poco oxígeno inhibirá su crecimiento y la deposición de componentes de la ECM, y puede provocar cicatrices fibróticas excesivas.
Deposición de colágeno
Uno de los fibroblastos n#39; Las funciones más importantes son la producción de colágeno.
La deposición de colágeno es importante porque aumenta la fuerza de la herida; antes de colocarla, lo único que mantiene cerrada la herida es el coágulo de fibrina-fibronectina, que no ofrece mucha resistencia a la lesión traumática. Además, las células implicadas en la inflamación, la angiogénesis y la construcción del tejido conectivo se adhieren, crecen y se diferencian en la matriz de colágeno depositada por los fibroblastos.
El colágeno tipo III y la fibronectina generalmente comienzan a producirse en cantidades apreciables entre aproximadamente 10 horas y 3 días, dependiendo principalmente del tamaño de la herida. Su deposición alcanza su punto máximo entre una y tres semanas. Son las sustancias tensoras predominantes hasta la última fase de maduración, en la que son reemplazadas por el colágeno tipo I más fuerte.
Aunque los fibroblastos producen nuevo colágeno, las colagenasas y otros factores lo degradan. Poco después de la herida, la síntesis supera la degradación, por lo que los niveles de colágeno en la herida aumentan, pero posteriormente la producción y la degradación se igualan, por lo que no hay ganancia neta de colágeno. Esta homeostasis señala el inicio de la fase de maduración posterior. La granulación cesa gradualmente y los fibroblastos disminuyen en número en la herida una vez finalizado su trabajo. Al final de la fase de granulación, los fibroblastos comienzan a cometer apoptosis, convirtiendo el tejido de granulación de un entorno rico en células a uno compuesto principalmente de colágeno.
Epitelización
La formación de tejido de granulación en una herida abierta permite que tenga lugar la fase de reepitelización, a medida que las células epiteliales migran a través del tejido nuevo para formar una barrera entre la herida y el medio ambiente. Los queratinocitos basales de los bordes de la herida y los apéndices dérmicos, como los folículos pilosos, las glándulas sudoríparas y las glándulas sebáceas (aceite), son las principales células responsables de la fase de epitelización de la cicatrización de las heridas. Avanzan en una sábana a través del sitio de la herida y proliferan en sus bordes, cesando el movimiento cuando se encuentran en el medio. En la curación que produce una cicatriz, no se forman glándulas sudoríparas, folículos pilosos ni nervios. Con la falta de folículos pilosos, nervios y glándulas sudoríparas, la herida y la cicatriz de curación resultante representan un desafío para el cuerpo con respecto al control de la temperatura.
Los queratinocitos migran sin proliferar primero. La migración puede comenzar tan pronto como unas horas después de la herida. Sin embargo, las células epiteliales requieren tejido viable para migrar, por lo que si la herida es profunda, primero debe llenarse con tejido de granulación. Por tanto, el momento de inicio de la migración es variable y puede ocurrir aproximadamente un día después de la herida. Las células de los márgenes de la herida proliferan el segundo y tercer día después de la herida para proporcionar más células para la migración.
Si no se rompe la membrana basal, las células epiteliales se reemplazan en tres días mediante división y migración ascendente de células en el estrato basal de la misma manera que ocurre en la piel ilesa. Sin embargo, si la membrana basal se daña en el sitio de la herida, la reepitelización debe ocurrir desde los márgenes de la herida y desde los apéndices de la piel, como los folículos pilosos y las glándulas sudoríparas y sebáceas que ingresan a la dermis y que están revestidas con queratinocitos viables. Si la herida es muy profunda, los apéndices de la piel también pueden dañarse y la migración sólo puede ocurrir desde los bordes de la herida.
La migración de queratinocitos sobre el sitio de la herida es estimulada por la falta de inhibición del contacto y por sustancias químicas como el óxido nítrico. Antes de comenzar a migrar, las células deben disolver sus desmosomas y hemidesmosomas, que normalmente anclan las células mediante filamentos intermedios en su citoesqueleto a otras células y a la MEC. Las proteínas receptoras transmembrana llamadas integrinas, que están formadas por glicoproteínas y normalmente anclan la célula a la membrana basal mediante su citoesqueleto, se liberan de los filamentos intermedios de la célula y se reubican en los filamentos de actina para servir como uniones a la MEC para los pseudópodos durante migración. De este modo, los queratinocitos se desprenden de la membrana basal y pueden penetrar en el lecho de la herida.
Antes de comenzar a migrar, los queratinocitos cambian de forma, se vuelven más largos y planos y extienden procesos celulares como lamellipodia y procesos anchos que parecen volantes. Se forman filamentos de actina y pseudópodos. Durante la migración, las integrinas del seudópodo se adhieren a la MEC y los filamentos de actina de la proyección arrastran la célula. La interacción con moléculas de la MEC a través de integrinas promueve aún más la formación de filamentos de actina, lamellipodios y filopodios.
Las células epiteliales trepan unas sobre otras para poder migrar. Esta capa creciente de células epiteliales a menudo se denomina lengua epitelial. Las primeras células que se adhieren a la membrana basal forman el estrato basal. Estas células basales continúan migrando a través del lecho de la herida y las células epiteliales que se encuentran encima de ellas también se deslizan. Cuanto más rápido se produzca esta migración, menos cicatriz quedará.
La fibrina, el colágeno y la fibronectina en la MEC pueden indicar aún más a las células que se dividan y migren. Al igual que los fibroblastos, los queratinocitos migratorios utilizan la fibronectina reticulada con fibrina que se depositó en la inflamación como un lugar de unión para arrastrarse.

A medida que los queratinocitos migran, se mueven sobre el tejido de granulación pero permanecen debajo de la costra, separando así la costra del tejido subyacente. Las células epiteliales tienen la capacidad de fagocitar desechos como tejido muerto y materia bacteriana que de otro modo obstruirían su camino. Debido a que deben disolver cualquier costra que se forme, la migración de los queratinocitos se ve favorecida mejor por un ambiente húmedo, ya que uno seco conduce a la formación de una costra más grande y más dura. Para avanzar a lo largo del tejido, los queratinocitos deben disolver el coágulo, los desechos y partes de la ECM para poder pasar. Secretan activador de plasminógeno, que activa el plasminógeno y lo convierte en plasmina para disolver la costra. Las células sólo pueden migrar sobre tejido vivo, por lo que deben excretar colagenasas y proteasas como las metaloproteinasas de matriz (MMP) para disolver las partes dañadas de la MEC en su camino, particularmente en la parte frontal de la hoja migratoria. Los queratinocitos también disuelven la membrana basal, utilizando en su lugar la nueva MEC depositada por los fibroblastos para atravesarla.
A medida que los queratinocitos continúan migrando, se deben formar nuevas células epiteliales en los bordes de la herida para reemplazarlas y proporcionar más células para la hoja que avanza. La proliferación detrás de los queratinocitos migratorios normalmente comienza unos días después de la herida y ocurre a un ritmo 17 veces mayor en esta etapa de epitelización que en los tejidos normales. Hasta que se recubre toda el área de la herida, las únicas células epiteliales que proliferan están en los bordes de la herida.
Los factores de crecimiento, estimulados por integrinas y MMP, hacen que las células proliferen en los bordes de la herida. Los propios queratinocitos también producen y secretan factores, incluidos factores de crecimiento y proteínas de la membrana basal, que ayudan tanto en la epitelización como en otras fases de la curación. Los factores de crecimiento también son importantes para la defensa inmune innata de las heridas de la piel mediante la estimulación de la producción de péptidos antimicrobianos y citocinas quimiotácticas de neutrófilos en los queratinocitos.
Los queratinocitos continúan migrando a través del lecho de la herida hasta que las células de ambos lados se encuentran en el medio, momento en el que la inhibición del contacto hace que dejen de migrar. Cuando han terminado de migrar, los queratinocitos secretan las proteínas que forman la nueva membrana basal. Las células revierten los cambios morfológicos que sufrieron para comenzar a migrar; restablecen desmosomas y hemidesmosomas y vuelven a anclarse a la membrana basal. Las células basales comienzan a dividirse y diferenciarse de la misma manera que lo hacen en la piel normal para restablecer los estratos que se encuentran en la piel reepitelizada.
Contracción
La contracción es una fase clave de la curación de heridas con reparación. Si la contracción continúa durante demasiado tiempo, puede provocar desfiguración y pérdida de función. Por lo tanto, existe un gran interés en comprender la biología de la contracción de la herida, que puede modelarse in vitro utilizando el ensayo de contracción en gel de colágeno o el modelo dérmico equivalente.
La contracción comienza aproximadamente una semana después de la herida, cuando los fibroblastos se han diferenciado en miofibroblastos. En heridas de espesor total, la contracción alcanza su punto máximo entre 5 y 15 días después de la herida. La contracción puede durar varias semanas y continúa incluso después de que la herida esté completamente reepitelizada. Una herida grande puede volverse entre un 40 y un 80 % más pequeña después de la contracción. Las heridas pueden contraerse a una velocidad de hasta 0,75 mm por día, dependiendo de qué tan suelto esté el tejido en el área de la herida. La contracción no suele ocurrir de forma simétrica; más bien, la mayoría de las heridas tienen un 'eje de contracción' lo que permite una mayor organización y alineación de las células con el colágeno.
Al principio, la contracción ocurre sin participación de los miofibroblastos. Posteriormente, los fibroblastos, estimulados por factores de crecimiento, se diferencian en miofibroblastos. Los miofibroblastos, que son similares a las células del músculo liso, son responsables de la contracción. Los miofibroblastos contienen el mismo tipo de actina que la que se encuentra en las células del músculo liso.
Los miofibroblastos son atraídos por la fibronectina y los factores de crecimiento y se mueven a lo largo de la fibronectina unida a la fibrina en la ECM provisional para llegar a los bordes de la herida. Forman conexiones con la ECM en los bordes de la herida y se unen entre sí y a los bordes de la herida mediante desmosomas. Además, en una adhesión llamada fibronexus, la actina del miofibroblasto se une a través de la membrana celular a moléculas de la matriz extracelular como la fibronectina y el colágeno. Los miofibroblastos tienen muchas adherencias de este tipo, que les permiten tirar de la MEC cuando se contraen, reduciendo el tamaño de la herida. En esta parte de la contracción, el cierre se produce más rápidamente que en la primera parte, independiente de los miofibroblastos.
A medida que la actina de los miofibroblastos se contrae, los bordes de la herida se juntan. Los fibroblastos depositan colágeno para reforzar la herida a medida que los miofibroblastos se contraen. La etapa de contracción en la proliferación termina cuando los miofibroblastos dejan de contraerse y cometen apoptosis. La ruptura de la matriz provisional conduce a una disminución del ácido hialurónico y un aumento del sulfato de condroitina, lo que gradualmente hace que los fibroblastos dejen de migrar y proliferar. Estos eventos señalan el inicio de la etapa de maduración de la cicatrización de heridas.
Maduración y remodelación
Cuando los niveles de producción y degradación de colágeno se igualan, se dice que ha comenzado la fase de maduración de la reparación del tejido. Durante la maduración, el colágeno tipo III, que prevalece durante la proliferación, es reemplazado por colágeno tipo I. Las fibras de colágeno originalmente desorganizadas se reorganizan, se entrecruzan y se alinean a lo largo de líneas de tensión. El inicio de la fase de maduración puede variar mucho, dependiendo del tamaño de la herida y de si inicialmente se cerró o se dejó abierta, oscilando entre aproximadamente tres días y tres semanas. La fase de maduración puede durar un año o más, dependiendo del tipo de herida.
A medida que avanza la fase, aumenta la resistencia a la tracción de la herida. El colágeno alcanzará aproximadamente el 20% de su resistencia a la tracción después de tres semanas, aumentando al 80% después de 12 meses. La fuerza máxima de la cicatriz es el 80% de la de la piel sana. Dado que se reduce la actividad en el sitio de la herida, la cicatriz pierde su apariencia roja a medida que los vasos sanguíneos que ya no son necesarios se eliminan mediante apoptosis.
Las fases de curación de heridas normalmente progresan de manera predecible y oportuna; si no lo hacen, la curación puede progresar de forma inadecuada hasta convertirse en una herida crónica, como una úlcera venosa, o en una cicatriz patológica, como una cicatriz queloide.
Factores que afectan la cicatrización de heridas
Muchos factores que controlan la eficacia, la velocidad y la forma de cicatrización de las heridas se clasifican en dos tipos: factores locales y sistémicos.
Factores locales
- Moistura; mantener una herida húmeda en lugar de seca hace la curación de la herida más rápido y con menos dolor y menos cicatrización
- Factores mecánicos
- Oedema
- Radiación ionizante
- Técnica falsa de cierre de la herida
- Ischemia y necrosis
- Cuerpos extranjeros. El afeitado, pequeños cuerpos extranjeros pueden penetrar la piel dejando poca herida superficial pero causando lesiones internas y sangrado interno. Para un cuerpo extranjero de vidrio, "frecuentemente, una herida de piel inocente disfraza la naturaleza extensa de las lesiones debajo". La lesión nerviosa de primer grado requiere unas pocas horas a unas pocas semanas para recuperarse. Si un cuerpo extranjero pasa por un nervio y causa lesiones nerviosas de primer grado durante la entrada, la sensación del cuerpo extranjero o dolor debido a la herida interna puede retrasarse unas horas a unas semanas después de la entrada. Un aumento repentino de dolor durante las primeras semanas de curación de heridas podría ser un signo de un nervio recuperado reportando lesiones internas en lugar de una infección recién desarrollada.
- Baja tensión de oxígeno
- Perfusión
Factores sistémicos
- Inflamación
- Diabetes – Los individuos con diabetes muestran una capacidad reducida en la curación de heridas agudas. Además, las personas diabéticas son susceptibles a desarrollar úlceras crónicas de pie diabético, una complicación grave de la diabetes que afecta al 15% de las personas con diabetes y representa el 84% de todas las amputaciones de las piernas inferiores relacionadas con la diabetes. Las habilidades curativas deficientes de diabéticos con úlceras de pie diabético y/o heridas agudas implican múltiples mecanismos fisiofisiológicos. Esta curación deteriorada implica hipoxia, fibroblasto y disfunción epidérmica, angiogénesis y neovascularización deterioradas, altos niveles de metalloproteas, daño de especies reactivas de oxígeno y AGEs (productos finales avanzados de glucocación), disminución de la resistencia inmunitaria anfitriona y neuropatía.
- Nutrientes – La malnutrición o las deficiencias nutricionales tienen un impacto reconocible en la curación de heridas post trauma o intervención quirúrgica. Los nutrientes que incluyen proteínas, carbohidratos, arginina, glutamina, ácidos grasos poliinsaturados, vitamina A, vitamina C, vitamina E, magnesio, cobre, zinc y hierro desempeñan un papel significativo en la curación de heridas. Las grasas y los carbohidratos proporcionan la mayoría de la energía necesaria para la curación de heridas. Glucose es la fuente más prominente del combustible y se utiliza para crear ATP celular, proporcionando energía para la angiogénesis y la deposición de nuevos tejidos. A medida que las necesidades nutricionales de cada paciente y su herida asociada son complejas, se sugiere que el apoyo nutricional personalizado beneficiaría tanto la curación aguda como crónica de la herida.
- Enfermedades metabólicas
- Immunosuppression
- Trastornos del tejido conectivo
- Fumar – Fumar causa un retraso en la reparación de la velocidad de la herida, especialmente en las fases proliferativas e inflamatorias. También aumenta la probabilidad de ciertas complicaciones, como la ruptura de la herida, la herida y la necrosis de solapa, la disminución de la fuerza de tracción de la herida y la infección. El tabaquismo pasivo también perjudica un proceso adecuado de curación de heridas.
- Edad: El aumento de la edad (más de 60 años) es un factor de riesgo para la curación de heridas con deficiencias. Se reconoce que, en adultos mayores de buena salud general, los efectos del envejecimiento causan un retraso temporal en la curación, pero ninguna deficiencia importante con respecto a la calidad de la curación. La curación tardía de la herida en pacientes de edad creciente se asocia con la respuesta inflamatoria alterada; por ejemplo, la infiltración retardada de células T de la herida con alteraciones en la producción de quimioquinas, y la capacidad fagocítica reducida de macrofrago.
- Alcohol – El consumo de alcohol perjudica la curación de heridas y también aumenta las posibilidades de infección. El alcohol afecta la fase proliferativa de la curación. Una sola unidad de alcohol causa un efecto negativo en la reepithelialización, cierre de heridas, producción de colágeno y angiogénesis.
En la década de 2000 surgieron los primeros modelos matemáticos del proceso de curación, basados en supuestos simplificados y en un sistema de ecuaciones diferenciales resuelto a través de MATLAB. Los modelos muestran que la "tasa del proceso de curación" parece estar "altamente influenciado por la actividad y el tamaño de la lesión en sí, así como por la actividad del agente curativo".
Investigación y desarrollo
Hasta aproximadamente el año 2000, el paradigma clásico de la curación de heridas, que involucraba células madre restringidas a linajes específicos de órganos, nunca había sido seriamente cuestionado. Desde entonces, la noción de que las células madre adultas tienen plasticidad celular o la capacidad de diferenciarse en células que no pertenecen al linaje ha surgido como una explicación alternativa. Para ser más específicos, las células progenitoras hematopoyéticas (que dan lugar a células maduras en la sangre) pueden tener la capacidad de desdiferenciarse nuevamente en células madre hematopoyéticas y/o transdiferenciarse en células que no son de linaje, como los fibroblastos.
Células madre y plasticidad celular
Las células madre adultas multipotentes tienen la capacidad de autorrenovarse y dar lugar a diferentes tipos de células. Las células madre dan lugar a células progenitoras, que son células que no se renuevan solas, pero que pueden generar varios tipos de células. El alcance de la participación de las células madre en la cicatrización de heridas cutáneas es complejo y no se comprende completamente. La inyección de células madre conduce a la curación de heridas principalmente mediante la estimulación de la angiogénesis.
Se cree que la epidermis y la dermis son reconstituidas por células madre mitóticamente activas que residen en el vértice de las crestas de la red (células madre basales o BSC), el bulto de los folículos pilosos (células madre foliculares del cabello o HFSC) y la dermis papilar (células madre dérmicas). Además, la médula ósea también puede contener células madre que desempeñan un papel importante en la cicatrización de heridas cutáneas.
En circunstancias raras, como en lesiones cutáneas extensas, se induce a subpoblaciones de autorrenovación en la médula ósea a participar en el proceso de curación, mediante lo cual dan lugar a células secretoras de colágeno que parecen desempeñar un papel durante la reparación de la herida. Estas dos subpoblaciones de autorrenovación son (1) células madre mesenquimales (MSC) derivadas de la médula ósea y (2) células madre hematopoyéticas (HSC). La médula ósea también alberga una subpoblación progenitora (células progenitoras endoteliales o EPC) que, en el mismo tipo de entorno, se movilizan para ayudar en la reconstrucción de los vasos sanguíneos. Además, se cree que las lesiones extensas de la piel también promueven el tráfico temprano de una subclase única de leucocitos (fibrocitos circulantes) a la región lesionada, donde realizan diversas funciones relacionadas con la cicatrización de heridas.
Reparación y regeneración de heridas
Una lesión es una interrupción de la morfología y/o funcionalidad de un tejido determinado. Después de una lesión, el tejido estructural sana con una regeneración completa o incompleta. El tejido sin interrupción de la morfología casi siempre se regenera por completo. Un ejemplo de regeneración completa sin interrupción de la morfología es el tejido no lesionado, como la piel. La piel no lesionada tiene un reemplazo y regeneración continua de células que siempre resulta en una regeneración completa.
Existe una distinción sutil entre 'reparación' y 'regeneración'. Reparación significa regeneración incompleta. Reparación o regeneración incompleta, se refiere a la adaptación fisiológica de un órgano después de una lesión en un esfuerzo por restablecer la continuidad sin tener en cuenta el reemplazo exacto del tejido perdido/dañado. La regeneración verdadera de tejido o regeneración completa se refiere a la sustitución del tejido perdido/dañado por un tejido 'exacto' copia, de modo que tanto la morfología como la funcionalidad queden completamente restauradas. Aunque después de una lesión los mamíferos pueden regenerarse completamente de forma espontánea, normalmente no lo hacen por completo. Un ejemplo de tejido que se regenera completamente tras una interrupción de su morfología es el endometrio; El endometrio después del proceso de degradación a través del ciclo menstrual sana con una regeneración completa.
En algunos casos, después de una degradación del tejido, como en la piel, se puede inducir una regeneración más cercana a la regeneración completa mediante el uso de estructuras biodegradables (colágeno-glicoaminoglicano). Estos andamios son estructuralmente análogos a la matriz extracelular (MEC) que se encuentra en la dermis normal o no lesionada. Las condiciones fundamentales requeridas para la regeneración de tejidos a menudo se oponen a las condiciones que favorecen la reparación eficiente de la herida, incluida la inhibición de (1) la activación plaquetaria, (2) la respuesta inflamatoria y (3) la contracción de la herida. Además de brindar soporte para la unión de fibroblastos y células endoteliales, los andamios biodegradables inhiben la contracción de la herida, lo que permite que el proceso de curación avance hacia una vía más regenerativa y con menos cicatrices. Se han investigado agentes farmacéuticos que pueden desactivar la diferenciación de miofibroblastos.
Una nueva forma de pensar deriva de la noción de que los sulfatos de heparán son un actor clave en la homeostasis del tejido: el proceso que hace que el tejido reemplace las células muertas por células idénticas. En las áreas de las heridas, la homeostasis del tejido se pierde a medida que los sulfatos de heparán se degradan, lo que impide la sustitución de las células muertas por células idénticas. Los análogos de sulfato de heparán no pueden ser degradados por todas las heparanasas y glucanasas conocidas y se unen a los puntos de unión de sulfato de heparina libres en la ECM, preservando así la homeostasis normal del tejido y previniendo la cicatrización.
Reparación o regeneración respecto al factor 1-alfa inducible por hipoxia (HIF-1a). En circunstancias normales, después de una lesión, HIF-1a es degradado por las prolil hidroxilasas (PHD). Los científicos descubrieron que la simple regulación positiva de HIF-1a a través de inhibidores de PHD regenera tejido perdido o dañado en mamíferos que tienen una respuesta de reparación; y la continua regulación a la baja de Hif-1a da como resultado una curación con una respuesta cicatrizante en mamíferos con una respuesta regenerativa previa a la pérdida de tejido. El acto de regular HIF-1a puede desactivar o activar el proceso clave de regeneración de los mamíferos.
Cicatrización de heridas sin cicatrices
Cicatrización de heridas sin cicatrices es un concepto basado en la curación o reparación de la piel (u otros tejidos/órganos) después de una lesión con el objetivo de curar subjetivamente y relativamente menos tejido cicatricial de lo que normalmente se espera. La curación sin cicatrices a veces se mezcla con el concepto de curación sin cicatrices, que es la curación de heridas que no deja absolutamente ninguna cicatriz (libre de cicatrices). Sin embargo son conceptos diferentes.
Un reverso de la cicatrización de heridas sin cicatrices es la escarificación (la cicatrización de heridas deja más cicatrices). Históricamente, ciertas culturas consideran atractiva la escarificación; sin embargo, este no es el caso en la sociedad occidental moderna, en la que muchos pacientes acuden a clínicas de cirugía plástica con expectativas poco realistas. Dependiendo del tipo de cicatriz, el tratamiento puede ser invasivo (inyecciones intralesionales de esteroides, cirugía) y/o conservador (terapia de compresión, gel de silicona tópico, braquiterapia, terapia fotodinámica). El juicio clínico es necesario para equilibrar con éxito los beneficios potenciales de los diversos tratamientos disponibles con la probabilidad de una respuesta deficiente y las posibles complicaciones resultantes de estos tratamientos. Es posible que muchos de estos tratamientos solo tengan un efecto placebo y la base de evidencia para el uso de muchos de los tratamientos actuales es deficiente.
Desde la década de 1960, la comprensión de los procesos biológicos básicos implicados en la reparación de heridas y la regeneración de tejidos se ha ampliado debido a los avances en la biología celular y molecular. Actualmente, los objetivos principales en el tratamiento de heridas son lograr un cierre rápido de la herida con un tejido funcional que tenga una cicatriz estética mínima. Sin embargo, el objetivo final de la biología de la cicatrización de heridas es inducir una reconstrucción más perfecta del área de la herida. La curación de heridas sin cicatrices sólo se produce en tejidos fetales de mamíferos y la regeneración completa se limita a los vertebrados inferiores, como las salamandras y los invertebrados. En los seres humanos adultos, el tejido lesionado se repara mediante la deposición de colágeno, la remodelación del colágeno y la eventual formación de cicatrices, mientras que se cree que la curación de heridas fetales es más un proceso regenerativo con una formación mínima o nula de cicatrices. Por lo tanto, la curación de heridas fetales se puede utilizar para proporcionar un modelo mamífero accesible de una respuesta de curación óptima en tejidos humanos adultos. Las pistas sobre cómo se podría lograr esto provienen de estudios sobre la curación de heridas en embriones, donde la reparación es rápida y eficiente y da como resultado una regeneración esencialmente perfecta de cualquier tejido perdido.
La etimología del término cicatrización de heridas sin cicatrices tiene una larga historia. En forma impresa, el anticuado concepto de curación sin cicatrices surgió a principios del siglo XX y apareció en un artículo publicado en el London Lancet. Este proceso implicó cortar en una inclinación quirúrgica, en lugar de un ángulo recto...; Así lo describieron varios periódicos.
Cáncer
Después de la inflamación, la restauración de la integridad y función normal del tejido se preserva mediante interacciones de retroalimentación entre diversos tipos de células mediadas por moléculas de adhesión y citocinas secretadas. La alteración de los mecanismos de retroalimentación normales en el cáncer amenaza la integridad del tejido y permite que un tumor maligno escape del sistema inmunológico. Un ejemplo de la importancia de la respuesta de curación de heridas dentro de los tumores se ilustra en el trabajo de Howard Chang y sus colegas de la Universidad de Stanford que estudian el cáncer de mama.
Suplementos orales de colágeno
Los resultados preliminares son prometedores para el uso a corto y largo plazo de suplementos de colágeno oral para la curación de heridas y el envejecimiento de la piel. Los suplementos de colágeno oral también aumentan la elasticidad, la hidratación y la densidad del colágeno dérmico de la piel. La suplementación con colágeno es generalmente segura y no se han reportado eventos adversos. Se necesitan más estudios para dilucidar el uso médico en enfermedades de la barrera cutánea como la dermatitis atópica y determinar los regímenes de dosificación óptimos.
Apósitos para heridas
Los apósitos modernos para ayudar en la reparación de heridas han sido objeto de considerable investigación y desarrollo en los últimos años. Los científicos pretenden desarrollar apósitos para heridas que tengan las siguientes características:
- Proveer protección contra la herida
- Quitar el exceso de exudado
- Propiedades antimicrobianas
- Mantener un ambiente húmedo
- Tener alta permeabilidad al oxígeno
- Retirada fácilmente de un sitio de la herida
- Características no anáfilácticas
Los apósitos de gasa de algodón han sido el estándar de atención, a pesar de sus propiedades secas que pueden adherirse a las superficies de las heridas y causar molestias al retirarlos. Investigaciones recientes se han propuesto mejorar los apósitos de gasa de algodón para acercarlos a lograr propiedades modernas de apósito para heridas, recubriendo el apósito de gasa de algodón con un nanocompuesto de quitosano/Ag/ZnO. Estos apósitos actualizados aumentan la absorción de agua y mejoran la eficacia antibacteriana.
Limpieza de heridas
Se puede limpiar la suciedad o el polvo de la superficie de la herida, las bacterias, el tejido que ha muerto y el líquido de la herida. La evidencia que respalda la técnica más efectiva no es clara y no hay evidencia suficiente para concluir si la limpieza de las heridas es beneficiosa para promover la curación o si las soluciones de limpieza de heridas (polihexametilenbiguanida, peróxido de oxígeno acuoso, etc.) son mejores que el agua esterilizada o las soluciones salinas para ayudar a curar las úlceras venosas de las piernas. No está claro si la elección de la solución limpiadora o el método de aplicación marca alguna diferencia en la curación de las úlceras venosas de la pierna.
Simulando la cicatrización de heridas desde una perspectiva de crecimiento
Se ha dedicado un esfuerzo considerable a comprender las relaciones físicas que rigen la cicatrización de heridas y la posterior cicatrización, con modelos matemáticos y simulaciones desarrolladas para dilucidar estas relaciones. El crecimiento de tejido alrededor del sitio de la herida es el resultado de la migración de células y la deposición de colágeno por parte de estas células. La alineación del colágeno describe el grado de cicatrización; La orientación del colágeno en forma de cesta es característica de la piel normal, mientras que las fibras de colágeno alineadas provocan cicatrices importantes. Se ha demostrado que el crecimiento de tejido y el grado de formación de cicatrices se pueden controlar modulando la tensión en el lugar de la herida.
El crecimiento del tejido se puede simular utilizando las relaciones antes mencionadas desde un punto de vista bioquímico y biomecánico. Las sustancias químicas biológicamente activas que desempeñan un papel importante en la cicatrización de heridas se modelan con difusión Fickiana para generar perfiles de concentración. La ecuación de equilibrio para sistemas abiertos al modelar la curación de heridas incorpora el crecimiento masivo debido a la migración y proliferación celular. Aquí se utiliza la siguiente ecuación:
Dtρ0 = Div (R) + R0,
donde ρ representa la densidad de masa, R representa un flujo de masa (de la migración celular) y R0 representa una fuente masiva (de proliferación, división o agrandamiento celular). Relaciones como estas se pueden incorporar en modelos basados en agentes, donde se puede probar la sensibilidad a parámetros individuales como la alineación inicial del colágeno, las propiedades de las citoquinas y las tasas de proliferación celular.
Intenciones de cierre de herida
La curación exitosa de heridas depende de varios tipos de células, mediadores moleculares y elementos estructurales.
Intención principal
La intención principal es la curación de una herida limpia sin pérdida de tejido. En este proceso se juntan los bordes de la herida de modo que queden uno al lado del otro (reaproximados). El cierre de la herida se realiza con suturas (puntos), grapas o cinta adhesiva o pegamento.
La intención principal sólo se puede implementar cuando la herida es precisa y hay una alteración mínima del tejido local y de la membrana basal epitelial, p. incisiones quirúrgicas.
Este proceso es más rápido que la curación por segunda intención. También hay menos cicatrices asociadas con la intención primaria, ya que no hay grandes pérdidas de tejido para llenar con tejido de granulación, aunque se formará algo de tejido de granulación.
- Ejemplos de intención primaria incluyen: laceraciones bien reparadas, fracturas óseas bien reducidas, curación después de la cirugía de solapa.
- La eliminación temprana de los apósitos de heridas limpias o contaminadas afecta a la curación primaria de las heridas.
Intención secundaria
- La intención secundaria se aplica cuando la intención primaria no es posible debido a daño o pérdida de tejidos significativos, generalmente debido a la herida que ha sido creada por traumas graves.
- La herida está permitida a granulado.
- El cirujano puede empacar la herida con una gasa o utilizar un sistema de drenaje.
- La granulación resulta en una cicatriz más amplia.
- El proceso de curación puede ser lento debido a la presencia de drenaje de la infección.
- El cuidado de los heridos debe realizarse diariamente para fomentar la extracción de escombros de heridas para permitir la formación de tejidos de granulación.
- El uso de antibióticos o antisépticos para la curación de la herida quirúrgica por intención secundaria es controvertido.
- Ejemplos: gingivectomía, gingivoplastia, tomas de extracción de dientes, fracturas mal reducidas, quemaduras, laceraciones severas, úlceras de presión.
- No hay pruebas suficientes de que la elección de apósitos o agentes tópicos afecta a la curación secundaria de heridas.
- There is lack of evidence for the effectiveness of negative pressure wound therapy in wound healing by secondary intention.
Intención terciaria
(Cierre primario retrasado):
- La herida es inicialmente limpiada, desbrida y observada, típicamente 4 o 5 días antes del cierre.
- La herida se deja abierta a propósito.
- Ejemplos: curación de heridas mediante el uso de injertos de tejido.
Si los bordes de la herida no se reaproximan inmediatamente, se produce un retraso en la cicatrización primaria de la herida. Este tipo de curación puede ser deseable en el caso de heridas contaminadas. Al cuarto día, la fagocitosis de los tejidos contaminados está en marcha y tienen lugar los procesos de epitelización, deposición de colágeno y maduración. Los materiales extraños están protegidos por macrófagos que pueden metamorfosearse en células epitelioides, que están rodeadas por leucocitos mononucleares, formando granulomas. Por lo general, la herida se cierra quirúrgicamente en este punto, o se come la costra, y si la "limpieza" Si la cicatrización de la herida es incompleta, puede producirse una inflamación crónica que da lugar a cicatrices prominentes.
Resumen de los factores de crecimiento implicados
Los siguientes son los principales factores de crecimiento implicados en la cicatrización de heridas:
| Factor de crecimiento | Abreviatura | Principales orígenes | Efectos |
|---|---|---|---|
| Factor de crecimiento epidérmico | EGF |
|
|
| Factor de crecimiento transformador-α | TGF-α |
|
|
| Factor de crecimiento del hepatocito | HGF |
|
|
| Factor de crecimiento endotelial vascular | VEGF |
|
|
| Factor de crecimiento derivado de plaquetas | PDGF |
|
|
| Factores de crecimiento fibroblastos 1 y 2 | FGF-1, −2 |
|
|
| Factor de crecimiento transformador-β | TGF-β |
|
|
| Factor de crecimiento de Keratinocyte | KGF |
|
|
| A menos que se especifique en cajas, la referencia es: | |||
Complicaciones de la cicatrización de heridas
Las principales complicaciones son muchas:
- Formación deficiente de la cicatriz: Resultados en deshidratación de heridas o ruptura de la herida debido a la formación inadecuada de tejido de granulación.
- Formación de cicatriz Excesiva: cicatriz hipertrófica, keloide, desmoide.
- Granulación exuberante (carne común).
- Contracción deficiente (en injertos de piel) o contracción excesiva (en quemaduras).
- Otros: Calcificación distrófica, cambios pigmentarios, cicatrices dolorosas, hernia incisión
Otras complicaciones pueden incluir infección y úlcera de Marjolin.
Productos biológicos, sustitutos de la piel, biomembranas y andamios
Los avances en la comprensión clínica de las heridas y su fisiopatología han generado importantes innovaciones biomédicas en el tratamiento de heridas agudas, crónicas y de otro tipo. Se han desarrollado muchos productos biológicos, sustitutos de la piel, biomembranas y andamios para facilitar la curación de heridas a través de diversos mecanismos. Esto incluye una serie de productos con nombres comerciales como Epicel, Laserskin, Transcyte, Dermagraft, AlloDerm/Strattice, Biobrane, Integra, Apligraf, OrCel, GraftJacket. y PermaDerm.
Notas y referencias
- ^ a b c d e f g h i j k l Nguyen DT, Orgill DP, Murphy GT (2009). "4 The Pathophysiologic Basis for Wound Healing and Cutaneous Regeneration". In Orgill DP, Blanco C (eds.). Biomaterials for Treating Skin Loss. Elsevier. pp. 25–57. ISBN 978-1-84569-554-5.
- ^ a b Rieger S, Zhao H, Martin P, Abe K, Lisse TS (January 2015). "The role of nuclear hormone receptors in cutaneous wound repair". Cell Biochemistry and Function. 33 (1): 1–13. doi:10.1002/cbf.3086. PMC 4357276. PMID 25529612.
- ^ a b c d e f g h i j k l Stadelmann WK, Digenis AG, Tobin GR (August 1998). "Physiology and healing dynamics of chronic cutaneous wounds". American Journal of Surgery. 176 (2A Suppl): 26S–38S. doi:10.1016/S0002-9610(98)00183-4. PMID 9777970.
- ^ Enoch, S. Price, P. (2004). Cellular, molecular and biochemical differences in the pathophysiology of healing between acute wounds, chronic wounds and wounds in the elderly Archived 2017-07-06 at the Wayback Machine.
- ^ Rasche H (2001). "Haemostasis and thrombosis: an overview". European Heart Journal Supplements. 3 (Supplement Q): Q3–Q7. doi:10.1016/S1520-765X(01)90034-3.
- ^ Versteeg HH, Heemskerk JW, Levi M, Reitsma PH (January 2013). "New fundamentals in hemostasis". Physiological Reviews. 93 (1): 327–58. doi:10.1152/physrev.00016.2011. PMID 23303912. S2CID 10367343.
- ^ a b c d e f g h Midwood KS, Williams LV, Schwarzbauer JE (June 2004). "Tissue repair and the dynamics of the extracellular matrix". The International Journal of Biochemistry & Cell Biology. 36 (6): 1031–7. doi:10.1016/j.biocel.2003.12.003. PMID 15094118.
- ^ a b Chang HY, Sneddon JB, Alizadeh AA, Sood R, West RB, Montgomery K, et al. (February 2004). "Gene expression signature of fibroblast serum response predicts human cancer progression: similarities between tumors and wounds". PLOS Biology. 2 (2): E7. doi:10.1371/journal.pbio.0020007. PMC 314300. PMID 14737219.
- ^ Garg, H.G. (2000). Scarless Wound Healing. New York Marcel Dekker, Inc. Electronic book.
- ^ Reference list is found on image main page.
- ^ Cubison TC, Pape SA, Parkhouse N (December 2006). "Evidence for the link between healing time and the development of hypertrophic scars (HTS) in paediatric burns due to scald injury". Burns. 32 (8): 992–9. doi:10.1016/j.burns.2006.02.007. PMID 16901651.
- ^ Kraft J, Lynde C. "Giving Burns the First, Second and Third Degree - Classification of burns". skincareguide.ca. Archived from the original on 26 December 2011. Retrieved 31 January 2012.
Formation of a thick eschar, slow healing (>1month), Obvious scarring,
- ^ a b "POST BURN SCAR RELATIVE TO RE-EPITHELIALIZATION". Burnsurgery.org. 2011. Archived from the original on 25 April 2012. Retrieved 16 March 2011.
Healing in 2 weeks – minimal to no scar; Healing in 3 weeks – minimal to no scar except in high risk scar formers;Healing in 4 weeks or more – hypertrophic in more than 50% of patients
- ^ Galko MJ, Krasnow MA (August 2004). "Cellular and genetic analysis of wound healing in Drosophila larvae". PLOS Biology. 2 (8): E239. doi:10.1371/journal.pbio.0020239. PMC 479041. PMID 15269788.
- ^ a b c d e Rosenberg L., de la Torre J. (2006). Wound Healing, Growth Factors Archived 2008-11-21 at the Wayback Machine. Emedicine.com. Accessed January 20, 2008.
- ^ Sandeman SR, Allen MC, Liu C, Faragher RG, Lloyd AW (November 2000). "Human keratocyte migration into collagen gels declines with in vitro ageing". Mechanisms of Ageing and Development. 119 (3): 149–57. doi:10.1016/S0047-6374(00)00177-9. PMID 11080534. S2CID 21115977.
- ^ a b c d Dealey C. (1999). The care of wounds: A guide for nurses. Oxford; Malden, Mass. Blackwell Science. Electronic book.
- ^ Theoret CL (2004). "Update on wound repair". Clinical Techniques in Equine Practice. 3 (2): 110–122. doi:10.1053/j.ctep.2004.08.009.
- ^ a b c d e f g h de la Torre J., Sholar A. (2006). Wound healing: Chronic wounds Archived 2008-10-29 at the Wayback Machine. Emedicine.com. Accessed January 20, 2008.
- ^ a b c d e f g h Greenhalgh DG (September 1998). "The role of apoptosis in wound healing". The International Journal of Biochemistry & Cell Biology. 30 (9): 1019–30. doi:10.1016/S1357-2725(98)00058-2. PMID 9785465.
- ^ Muller MJ, Hollyoak MA, Moaveni Z, Brown TL, Herndon DN, Heggers JP (December 2003). "Retardation of wound healing by silver sulfadiazine is reversed by Aloe vera and nystatin". Burns. 29 (8): 834–6. doi:10.1016/S0305-4179(03)00198-0. PMID 14636760.
- ^ Martin P, Leibovich SJ (November 2005). "Inflammatory cells during wound repair: the good, the bad and the ugly". Trends in Cell Biology. 15 (11): 599–607. doi:10.1016/j.tcb.2005.09.002. PMID 16202600.
- ^ a b c d e f g h Santoro MM, Gaudino G (March 2005). "Cellular and molecular facets of keratinocyte reepithelization during wound healing". Experimental Cell Research. 304 (1): 274–86. doi:10.1016/j.yexcr.2004.10.033. PMID 15707592.
- ^ a b "The phases of cutaneous wound healing" (PDF). Expert Reviews in Molecular Medicine. Cambridge University Press. 5. 21 March 2003. Archived from the original (PDF) on 8 March 2008.
- ^ a b c d e f Deodhar AK, Rana RE (1997). "Surgical physiology of wound healing: a review". Journal of Postgraduate Medicine. 43 (2): 52–6. PMID 10740722. Archived from the original on 2011-02-26. Retrieved 2005-10-27.
- ^ Ovchinnikov DA (September 2008). "Macrophages in the embryo and beyond: much more than just giant phagocytes". Genesis. 46 (9): 447–62. doi:10.1002/dvg.20417. PMID 18781633. S2CID 38894501.
Macrophages are present essentially in all tissues, beginning with embryonic development and, in addition to their role in host defense and in the clearance of apoptotic cells, are being increasingly recognized for their trophic function and role in regeneration.
- ^ a b c d Newton PM, Watson JA, Wolowacz RG, Wood EJ (August 2004). "Macrophages restrain contraction of an in vitro wound healing model". Inflammation. 28 (4): 207–14. doi:10.1023/B:IFLA.0000049045.41784.59. PMID 15673162. S2CID 9612298.
- ^ a b c d e f g h Mercandetti M, Cohen AJ (2005). "Wound Healing: Healing and Repair". Emedicine.com. Archived from the original on 21 November 2008. Retrieved 20 January 2008.
- ^ Swirski FK, Nahrendorf M, Etzrodt M, Wildgruber M, Cortez-Retamozo V, Panizzi P, Figueiredo JL, Kohler RH, et al. (July 2009). "Identification of splenic reservoir monocytes and their deployment to inflammatory sites". Science. 325 (5940): 612–6. Bibcode:2009Sci...325..612S. doi:10.1126/science.1175202. PMC 2803111. PMID 19644120.
- ^ Jia T, Pamer EG (July 2009). "Immunology. Dispensable but not irrelevant". Science. 325 (5940): 549–50. Bibcode:2009Sci...325..549J. doi:10.1126/science.1178329. PMC 2917045. PMID 19644100.
- ^ a b c d e f g h i Lorenz HP, Longaker MT (2003). "Wounds: Biology, Pathology, and Management" (PDF). In Norton JA (ed.). Surgery. New York, NY: Springer. pp. 191–208. doi:10.1007/978-0-387-68113-9_10. ISBN 978-0-387-30800-5. S2CID 83849346. Archived from the original (PDF) on 24 August 2014.
- ^ a b c d e Hinz B (April 2006). "Masters and servants of the force: the role of matrix adhesions in myofibroblast force perception and transmission". European Journal of Cell Biology. 85 (3–4): 175–81. doi:10.1016/j.ejcb.2005.09.004. PMID 16546559.
- ^ Souppouris A (2013-05-23). "Scientists identify cell that could hold the secret to limb regeneration". the verge.com. Archived from the original on 2017-07-31. Retrieved 2017-09-18.
Researchers have identified a cell that aids limb regrowth in Salamanders. Macrophages are a type of repairing cell that devour dead cells and pathogens, and trigger other immune cells to respond to pathogens.
- ^ Godwin JW, Pinto AR, Rosenthal NA (June 2013). "Macrophages are required for adult salamander limb regeneration". Proceedings of the National Academy of Sciences of the United States of America. University of Texas. 110 (23): 9415–20. Bibcode:2013PNAS..110.9415G. doi:10.1073/pnas.1300290110. PMC 3677454. PMID 23690624.
- ^ a b c d Falanga V. (2005). Wound Healing. American Academy of Dermatology (AAD).
- ^ a b c Kuwahara R.T. and Rasberry R. 2007. Chemical Peels Archived 2008-10-25 at the Wayback Machine. Emedicine.com. Accessed September 15, 2007.
- ^ a b c d e f g h i j Romo T. and Pearson J.M. 2005. Wound Healing, Skin Archived 2008-12-07 at the Wayback Machine. Emedicine.com. Accessed December 27, 2006.
- ^ Lansdown AB, Sampson B, Rowe A (February 2001). "Experimental observations in the rat on the influence of cadmium on skin wound repair". International Journal of Experimental Pathology. 82 (1): 35–41. doi:10.1046/j.1365-2613.2001.00180.x. PMC 2517695. PMID 11422539.
- ^ a b c d Song G, Nguyen DT, Pietramaggiori G, Scherer S, Chen B, Zhan Q, Ogawa R, Yannas IV, Wagers AJ, Orgill DP, Murphy GF (2010). "Use of the parabiotic model in studies of cutaneous wound healing to define the participation of circulating cells". Wound Repair and Regeneration. 18 (4): 426–32. doi:10.1111/j.1524-475X.2010.00595.x. PMC 2935287. PMID 20546556.
- ^ Ruszczak Z (November 2003). "Effect of collagen matrices on dermal wound healing". Advanced Drug Delivery Reviews. 55 (12): 1595–611. doi:10.1016/j.addr.2003.08.003. PMID 14623403.
- ^ a b Fig. 9-1. The cellular, biochemical, and mechanical phases of wound healing. Pollock RE, Brunicardi FC, Andersen DK, Billiar TR, Dunn D, Hunter JG, Matthews JJ (2009). Schwartz's Principles of Surgery, Ninth Edition. McGraw-Hill Professional. ISBN 978-0-07-154769-7.
- ^ a b c d e f g h DiPietro LA, Burns AL, eds. (2003). Wound Healing: Methods and Protocols. Methods in Molecular Medicine. Totowa, N.J.: Humana Press.
- ^ Fu XB, Sun TZ, Li XK, Sheng ZY (February 2005). "Morphological and distribution characteristics of sweat glands in hypertrophic scar and their possible effects on sweat gland regeneration". Chinese Medical Journal. 118 (3): 186–91. PMID 15740645. Archived from the original on 2018-06-20. Retrieved 2014-06-18.
- ^ a b "BURN INJURIES". nationaltraumainstitute.org. Archived from the original on 3 March 2016. Retrieved 13 July 2016.
When the dermis is destroyed, the scars do not regrow hair, nerves or sweat glands, providing additional challenges to body temperature control.
- ^ a b c d Bartkova J, Grøn B, Dabelsteen E, Bartek J (February 2003). "Cell-cycle regulatory proteins in human wound healing". Archives of Oral Biology. 48 (2): 125–32. doi:10.1016/S0003-9969(02)00202-9. PMID 12642231.
- ^ a b c d Mulvaney M. and Harrington A. 1994. Chapter 7: Cutaneous trauma and its treatment. In, Textbook of Military Medicine: Military Dermatology. Office of the Surgeon General, Department of the Army. Virtual Naval Hospital Project. Accessed through web archive on September 15, 2007.
- ^ a b c d Larjava H., Koivisto L., and Hakkinen L. 2002. Chapter 3: Keratinocyte Interactions with Fibronectin During Wound Healing. In, Heino, J. and Kahari, V.M. Cell Invasion. Medical Intelligence Unit; 33. Georgetown, Tex., Austin, Tex Landes Bioscience, Inc. Electronic book.
- ^ Witte MB, Barbul A (April 2002). "Role of nitric oxide in wound repair". American Journal of Surgery. 183 (4): 406–12. doi:10.1016/S0002-9610(02)00815-2. PMID 11975928.
- ^ Son HJ, Bae HC, Kim HJ, Lee DH, Han D, Park J (2005). "Effects of β-glucan on proliferation and migration of fibroblasts". Current Applied Physics. 5 (5): 468–71. Bibcode:2005CAP.....5..468S. doi:10.1016/j.cap.2005.01.011.
- ^ Falanga V (2004). "The chronic wound: impaired healing and solutions in the context of wound bed preparation". Blood Cells, Molecules & Diseases. 32 (1): 88–94. doi:10.1016/j.bcmd.2003.09.020. PMID 14757419.
- ^ Etscheid M, Beer N, Dodt J (December 2005). "The hyaluronan-binding protease upregulates ERK1/2 and PI3K/Akt signalling pathways in fibroblasts and stimulates cell proliferation and migration". Cellular Signalling. 17 (12): 1486–94. doi:10.1016/j.cellsig.2005.03.007. PMID 16153533.
- ^ Bayram Y, Deveci M, Imirzalioglu N, Soysal Y, Sengezer M (October 2005). "The cell based dressing with living allogenic keratinocytes in the treatment of foot ulcers: a case study". British Journal of Plastic Surgery. 58 (7): 988–96. doi:10.1016/j.bjps.2005.04.031. PMID 16040019.
- ^ Grinnell F (February 1994). "Fibroblasts, myofibroblasts, and wound contraction". The Journal of Cell Biology. 124 (4): 401–4. doi:10.1083/jcb.124.4.401. PMC 2119916. PMID 8106541.
- ^ a b Eichler MJ, Carlson MA (February 2006). "Modeling dermal granulation tissue with the linear fibroblast-populated collagen matrix: a comparison with the round matrix model". Journal of Dermatological Science. 41 (2): 97–108. doi:10.1016/j.jdermsci.2005.09.002. PMID 16226016.
- ^ a b c d Mirastschijski U, Haaksma CJ, Tomasek JJ, Agren MS (October 2004). "Matrix metalloproteinase inhibitor GM 6001 attenuates keratinocyte migration, contraction and myofibroblast formation in skin wounds". Experimental Cell Research. 299 (2): 465–75. doi:10.1016/j.yexcr.2004.06.007. PMID 15350544.
- ^ worldwidewounds.com Archived 2011-07-05 at the Wayback Machine > Figure 3 – The time relationship between the different processes of wound healing. Archived 2011-07-18 at the Wayback Machine by Gregory S Schultz, Glenn Ladwig and Annette Wysocki – in turn adapted from Asmussen PD, Sollner B. Mechanism of wound healing. In: Wound Care. Tutorial Medical Series. Stuttgart: Hippokrates Verlag, 1993.
- ^ Morton LM, Phillips TJ (April 2016). "Wound healing and treating wounds: Differential diagnosis and evaluation of chronic wounds". Journal of the American Academy of Dermatology. 74 (4): 589–605, quiz 605–6. doi:10.1016/j.jaad.2015.08.068. PMID 26979352.
- ^ O'Leary R, Wood EJ, Guillou PJ (2002). "Pathological scarring: strategic interventions". The European Journal of Surgery = Acta Chirurgica. 168 (10): 523–34. PMID 12666691.
- ^ Desmoulière A, Chaponnier C, Gabbiani G (2005). "Tissue repair, contraction, and the myofibroblast". Wound Repair and Regeneration. 13 (1): 7–12. doi:10.1111/j.1067-1927.2005.130102.x. PMID 15659031. S2CID 2590702.
- ^ Metzger S (September 2004). "Clinical and financial advantages of moist wound management". Home Healthcare Nurse. 22 (9): 586–90. doi:10.1097/00004045-200409000-00003. PMID 15359168.
- ^ Iconomou TG, Zuker RM, Michelow BJ (1993). "Management of major penetrating glass injuries to the upper extremities in children and adolescents". Microsurgery. 14 (2): 91–6. doi:10.1002/micr.1920140202. PMID 8469109. S2CID 25492817.
- ^ "Nerve injury". Johns Hopkins Medicine. The Johns Hopkins University, The Johns Hopkins Hospital, and Johns Hopkins Health System. Archived from the original on 27 September 2016. Retrieved 2 October 2016.
- ^ Brem H, Tomic-Canic M (May 2007). "Cellular and molecular basis of wound healing in diabetes". The Journal of Clinical Investigation. 117 (5): 1219–22. doi:10.1172/jci32169. PMC 1857239. PMID 17476353.
- ^ a b c d e f g h Guo S, Dipietro LA (March 2010). "Factors affecting wound healing". Journal of Dental Research. 89 (3): 219–29. doi:10.1177/0022034509359125. PMC 2903966. PMID 20139336.
- ^ Arnold M, Barbul A (June 2006). "Nutrition and wound healing". Plastic and Reconstructive Surgery. 117 (7 Suppl): 42S–58S. doi:10.1097/01.prs.0000225432.17501.6c. PMID 16799374. S2CID 8658373.
- ^ Wong LS, Green HM, Feugate JE, Yadav M, Nothnagel EA, Martins-Green M (April 2004). "Effects of "second-hand" smoke on structure and function of fibroblasts, cells that are critical for tissue repair and remodeling". BMC Cell Biology. 5 (1): 13. doi:10.1186/1471-2121-5-13. PMC 400727. PMID 15066202.
- ^ Gosain A, DiPietro LA (March 2004). "Aging and wound healing". World Journal of Surgery. 28 (3): 321–6. doi:10.1007/s00268-003-7397-6. PMID 14961191. S2CID 28491255.
- ^ Swift ME, Burns AL, Gray KL, DiPietro LA (November 2001). "Age-related alterations in the inflammatory response to dermal injury". The Journal of Investigative Dermatology. 117 (5): 1027–35. doi:10.1046/j.0022-202x.2001.01539.x. PMID 11710909.
- ^ Alfredo Palomino I.; Leighton Estrada R.; Javier Valeriano M.; Sergio Luque M. (September 24, 2019). "Mathematical modeling of injury healing process under the action of an active pharmaceutical ingredient (API)" [Modelamiento matemático del proceso de sanación de heridas bajo la acción de un ingrediente farmacéuticamente activo (IFA).]. Selecciones Matemáticas (in American English and Spanish). 6 (2): 283–288. doi:10.17268/sel.mat.2019.02.14. ISSN 2411-1783. OCLC 8469127433. Archived from the original on July 22, 2020. Retrieved August 29, 2020.
- ^ Krasilnikova, O. A.; Baranovskii, D. S.; Lyundup, A. V.; Shegay, P. V.; Kaprin, A. D.; Klabukov, I. D. (2022-04-27). "Stem and Somatic Cell Monotherapy for the Treatment of Diabetic Foot Ulcers: Review of Clinical Studies and Mechanisms of Action". Stem Cell Reviews and Reports. 18 (6): 1974–1985. doi:10.1007/s12015-022-10379-z. ISSN 2629-3277. PMID 35476187. S2CID 248402820.
- ^ a b c d Min S, Wang SW, Orr W (2006). "Graphic general pathology: 2.3 Incomplete regeneration". Pathology. pathol.med.stu.edu.cn. Archived from the original on 2013-11-10. Retrieved 2012-12-07.
The new tissue is not the same as the tissue that was lost. After the repair process has been completed, there is a loss in the structure or function of the injured tissue. In this type of repair, it is common that granulation tissue (stromal connective tissue) proliferates to fill the defect created by the necrotic cells. The necrotic cells are then replaced by scar tissue.
- ^ a b c d Min S, Wang SW, Orr W (2006). "Graphic general pathology: 2.2 complete regeneration". Pathology. pathol.med.stu.edu.cn. Archived from the original on 2012-12-07. Retrieved 2012-12-07.
(1) Complete regeneration: The new tissue is the same as the tissue that was lost. After the repair process has been completed, the structure and function of the injured tissue are completely normal
- ^ a b c Min S, Wang SW, Orr W (2006). "Graphic general pathology: 2.2 complete regeneration". Pathology. pathol.med.stu.edu.cn. Archived from the original on 2012-12-07. Retrieved 2013-11-10.
After the repair process has been completed, the structure and function of the injured tissue are completely normal. This type of regeneration is common in physiological situations. Examples of physiological regeneration are the continual replacement of cells of the skin and repair of the endometrium after menstruation. Complete regeneration can occur in pathological situations in tissues that have good regenerative capacity.
- ^ Yannas IV, Lee E, Orgill DP, Skrabut EM, Murphy GF (February 1989). "Synthesis and characterization of a model extracellular matrix that induces partial regeneration of adult mammalian skin". Proceedings of the National Academy of Sciences of the United States of America. 86 (3): 933–7. Bibcode:1989PNAS...86..933Y. doi:10.1073/pnas.86.3.933. JSTOR 33315. PMC 286593. PMID 2915988.
- ^ O'Leary R, Ponnambalam S, Wood EJ (September 2003). "Pioglitazone-induced myofibroblast cell death: implications for cutaneous scarring". The British Journal of Dermatology. 149 (3): 665–7. doi:10.1046/j.1365-2133.2003.05501.x. PMID 14511015. S2CID 45852269.
- ^ Tong M, Tuk B, Hekking IM, Vermeij M, Barritault D, van Neck JW (2009). "Stimulated neovascularization, inflammation resolution and collagen maturation in healing rat cutaneous wounds by a heparan sulfate glycosaminoglycan mimetic, OTR4120". Wound Repair and Regeneration. 17 (6): 840–52. doi:10.1111/j.1524-475X.2009.00548.x. PMID 19903305. S2CID 17262546.
- ^ Barritault D, Caruelle JP (March 2006). "[Regenerating agents (RGTAs): a new therapeutic approach]" [Regenerating agents (RGTAs): a new therapeutic approach]. Annales Pharmaceutiques Françaises (in French). 64 (2): 135–44. doi:10.1016/S0003-4509(06)75306-8. PMID 16568015.
- ^ Van Neck et al, Heparan sulfate proteoglycan mimetics thrive tissue regeneration: an overview. In Intech book under the working title "Tissue Regeneration", ISBN 978-953-307-876-2 is scheduled for on line publication on Nov 26, 2011"
- ^ eurekalert.org staff (3 June 2015). "Scientist at LIMR leads study demonstrating drug-induced tissue regeneration". eurekalert.org. Lankenau Institute for Medical Research (LIMR). Archived from the original on 4 July 2015. Retrieved 3 July 2015.
- ^ Zhang Y, Strehin I, Bedelbaeva K, Gourevitch D, Clark L, Leferovich J, Messersmith PB, Heber-Katz E. Drug-induced regeneration in adult mice. Sci Transl Med. 2015;290.
- ^ Rush, J. (2005). Spiritual tattoo: a cultural history of tattooing, piercing, scarification, branding, and implants, Frog Ltd.
- ^ Brown BC, McKenna SP, Siddhi K, McGrouther DA, Bayat A (September 2008). "The hidden cost of skin scars: quality of life after skin scarring". Journal of Plastic, Reconstructive & Aesthetic Surgery. 61 (9): 1049–58. doi:10.1016/j.bjps.2008.03.020. PMID 18617450.
- ^ Bayat A, McGrouther DA, Ferguson MW (January 2003). "Skin scarring". BMJ. 326 (7380): 88–92. doi:10.1136/bmj.326.7380.88. PMC 1125033. PMID 12521975.
- ^ Clark, R. (1996). The molecular and cellular biology of wound repair, Springer Us.
- ^ Tonnesen MG, Feng X, Clark RA (December 2000). "Angiogenesis in wound healing". The Journal of Investigative Dermatology. Symposium Proceedings. 5 (1): 40–6. doi:10.1046/j.1087-0024.2000.00014.x. PMID 11147674.
- ^ a b Ferguson MW, Whitby DJ, Shah M, Armstrong J, Siebert JW, Longaker MT (April 1996). "Scar formation: the spectral nature of fetal and adult wound repair". Plastic and Reconstructive Surgery. 97 (4): 854–60. doi:10.1097/00006534-199604000-00029. PMID 8628785.
- ^ Brockes JP, Kumar A, Velloso CP (2001). "Regeneration as an evolutionary variable". Journal of Anatomy. 199 (Pt 1–2): 3–11. doi:10.1046/j.1469-7580.2001.19910003.x. PMC 1594962. PMID 11523827.
- ^ a b "Scarless Healing". Star. Christchurch, New Zealand. 1906-07-07. pp. Page 4. Archived from the original on 2013-10-08. Retrieved 2013-07-02.
- ^ a b "Scarless Healing". Marlborough Express, Volume XXXIX, Issue 160. paperspast.natlib.govt.nz. 1906-07-12. pp. Page 1. Archived from the original on 2013-10-08. Retrieved 2013-07-02.
- ^ a b "A Wonderful New Surgery". Reading Eagle. 1906-07-06. pp. Page 6. Archived from the original on 2016-03-12. Retrieved 2013-07-02.
- ^ Karin M, Clevers H (January 2016). "Reparative inflammation takes charge of tissue regeneration". Nature. 529 (7586): 307–15. Bibcode:2016Natur.529..307K. doi:10.1038/nature17039. PMC 5228603. PMID 26791721.
- ^ Vlahopoulos SA (August 2017). "Aberrant control of NF-κB in cancer permits transcriptional and phenotypic plasticity, to curtail dependence on host tissue: molecular mode". Cancer Biology & Medicine. 14 (3): 254–270. doi:10.20892/j.issn.2095-3941.2017.0029. PMC 5570602. PMID 28884042.
- ^ J Drugs Dermatol. 2019;18(1):9-16.
- ^ a b Zeng R, Lin C, Lin Z, Chen H, Lu W, Lin C, Li H (November 2018). "Approaches to cutaneous wound healing: basics and future directions". Cell and Tissue Research. 374 (2): 217–232. doi:10.1007/s00441-018-2830-1. PMID 29637308. S2CID 4727434.
- ^ a b McLain NE, Moore ZE, Avsar P, et al. (Cochrane Wounds Group) (March 2021). "Wound cleansing for treating venous leg ulcers". The Cochrane Database of Systematic Reviews. 2021 (3): CD011675. doi:10.1002/14651858.CD011675.pub2. PMC 8092712. PMID 33734426.
- ^ Cumming BD, McElwain DL, Upton Z (January 2010). "A mathematical model of wound healing and subsequent scarring". Journal of the Royal Society, Interface. 7 (42): 19–34. doi:10.1098/rsif.2008.0536. PMC 2839370. PMID 19324672.
- ^ Gurtner GC, Werner S, Barrandon Y, Longaker MT (May 2008). "Wound repair and regeneration". Nature. 453 (7193): 314–21. Bibcode:2008Natur.453..314G. doi:10.1038/nature07039. PMID 18480812. S2CID 205213660.
- ^ Gurtner GC, Dauskardt RH, Wong VW, Bhatt KA, Wu K, Vial IN, Padois K, Korman JM, Longaker MT (August 2011). "Improving cutaneous scar formation by controlling the mechanical environment: large animal and phase I studies". Annals of Surgery. 254 (2): 217–25. doi:10.1097/SLA.0b013e318220b159. PMID 21606834. S2CID 21111114.
- ^ Kuhl E, Steinmann P (June 2004). "Computational modeling of healing: an application of the material force method". Biomechanics and Modeling in Mechanobiology. 2 (4): 187–203. doi:10.1007/s10237-003-0034-3. PMID 14872320. S2CID 8070456.
- ^ Rouillard AD, Holmes JW (September 2012). "Mechanical regulation of fibroblast migration and collagen remodelling in healing myocardial infarcts". The Journal of Physiology. 590 (18): 4585–602. doi:10.1113/jphysiol.2012.229484. PMC 3477759. PMID 22495588.
- ^ a b c d Velnar T, Bailey T, Smrkolj V (2009-10-01). "The wound healing process: an overview of the cellular and molecular mechanisms". The Journal of International Medical Research. 37 (5): 1528–42. doi:10.1177/147323000903700531. PMID 19930861. S2CID 2496871.
- ^ a b Armitage J, Lockwood S (2011-10-01). "Skin incisions and wound closure". Surgery (Oxford). Wound Management. 29 (10): 496–501. doi:10.1016/j.mpsur.2011.06.022.
- ^ Toon CD, Lusuku C, Ramamoorthy R, Davidson BR, Gurusamy KS, et al. (Cochrane Wounds Group) (September 2015). "Early versus delayed dressing removal after primary closure of clean and clean-contaminated surgical wounds". The Cochrane Database of Systematic Reviews. 2015 (9): CD010259. doi:10.1002/14651858.CD010259.pub3. PMC 7087443. PMID 26331392.
- ^ Norman G, Dumville JC, Mohapatra DP, Owens GL, Crosbie EJ (March 2016). "Antibiotics and antiseptics for surgical wounds healing by secondary intention". The Cochrane Database of Systematic Reviews. 3 (4): CD011712. doi:10.1002/14651858.CD011712.pub2. PMC 6599835. PMID 27021482.
- ^ Vermeulen H, Ubbink D, Goossens A, de Vos R, Legemate D, et al. (Cochrane Wounds Group) (2004-01-26). "Dressings and topical agents for surgical wounds healing by secondary intention". The Cochrane Database of Systematic Reviews. 2012 (2): CD003554. doi:10.1002/14651858.CD003554.pub2. PMC 8407283. PMID 15106207.
- ^ Dumville JC, Owens GL, Crosbie EJ, Peinemann F, Liu Z, et al. (Cochrane Wounds Group) (June 2015). "Negative pressure wound therapy for treating surgical wounds healing by secondary intention". The Cochrane Database of Systematic Reviews (6): CD011278. doi:10.1002/14651858.CD011278.pub2. PMID 26042534.
- ^ Table 3-1 in: Mitchell RS, Kumar V, Abbas AK, Nelson F (2007). Robbins Basic Pathology (8th ed.). Philadelphia: Saunders. ISBN 978-1-4160-2973-1.
- ^ Stejskalová A, Almquist BD (July 2017). "Using biomaterials to rewire the process of wound repair". Biomaterials Science. 5 (8): 1421–1434. doi:10.1039/c7bm00295e. PMC 5576529. PMID 28692083.
- ^ Vyas KS, Vasconez HC. Wound Healing: Biologics, Skin Substitutes, Biomembranes and Scaffolds Archived 2017-04-13 at the Wayback Machine. Healthcare. 2014; 2(3):356-400.
Contenido relacionado
Ley de Fick
Peso del cuerpo humano
Presión oncótica